菜豆普通花叶病毒辽宁分离物的鉴定与序列分析
2018-05-04杨彩霞付晶晶廖一鸣吕双玉石长玉
韩 彤,杨彩霞,付晶晶,廖一鸣,吕双玉,贾 苒,石长玉
(沈阳大学 生命科学与工程学院/辽宁省城市有害生物治理与生态安全重点试验室,辽宁 沈阳 110044)
豆科(Leguminosae)菜豆属(PhaseolusL.)植物均为重要的食用作物,在我国广为栽植。但是,菜豆属植物栽培常受到植物病毒的干扰,其中最具破坏性的是菜豆普通花叶病毒(Beancommonmosaicvirus,BCMV)[1]。BCMV是一种世界性分布的马铃薯Y病毒属(Potyvirus)病毒[2]。该病毒最早由美国Stewart和Reddick在菜豆上分离到[3],后由Pierce将其命名为BCMV[4]。BCMV的基因组是一条全长约9.6~10 kb的正义单链RNA,结构特征与典型的Potyvirus成员相同,其5′端具共价结合金属蛋白(virus genome-linked protein,VPg),3′端具有Poly(A)尾巴[5],中间序列编码一个长的多聚蛋白,随后切割产生8~10个产物参与病毒的复制、运动和包装。BCMV传播方式多样,主要经蚜虫非持久性传播[6-7],还可通过机械接种、种子和花粉传毒。自然条件下可侵染多种菜豆属植物,试验条件下还能侵染藜科、茄科、苋科、豆科、番杏科等9个科、44个属的约100多种植物[8-14]。受侵染植物的病害症状主要受病毒株系、环境条件和寄主植物3个方面的影响,通常表现性状为花叶皱缩、叶片变窄或卷曲,豆荚斑驳或畸形[15]。2016年,在辽宁盖州地区发现疑似病毒侵染的菜豆样品,通过RT-PCR试验,明确了侵染菜豆的病毒为BCMV。本文首次报道了辽宁BCMV分离物的分子特征。
1 材料与方法
1.1 试验材料
2015年8月,于辽宁省采集表现黄化症状的菜豆植物样品,保存于-80 ℃超低温冰箱备用(图1)。
1.2 试验方法

图1 表现黄化症状的菜豆Fig.1 The yellow symptoms showing on thePhaseolus vulgaris L. plants
1.2.1 植物总 RNA 提取 取黄化的菜豆叶片100 mg,在研钵中加入液氮后迅速研磨至粉末状,使用RNASimple Total RNA Kit总RNA提取试剂盒(天根生化科技(北京)有限公司)提取菜豆叶片的总RNA。
1.2.2 病毒的RT-PCR检测 对菜豆病叶的总RNA进行提取后,用TIAN Script RT Kit(天根生化科技(北京)有限公司)进行cDNA第一条链的合成。以cDNA为模板,先后参照Potyvirus属通用引物Legpoty-F/Legpoty-R[16]和BCMV特异性引物BCMV-CP-F/BCMV-CP-R[17]对cDNA进行PCR扩增(引物由北京奥科鼎盛生物科技有限公司合成)。PCR反应体系为25 μL,设定PCR程序为:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,试验进行35个循环;72 ℃延伸10 min。反应结束后,用10 g/L琼脂糖凝胶对PCR产物进行电泳检测,将目的条带用TIANgel Midi Purification Kit(天根生化科技(北京)有限公司)回收试剂盒回收和纯化。回收产物与pMD-18T(宝生物工程(大连)有限公司)克隆载体在16 ℃下进行连接3 h后,转入DH5α菌株的感受态细胞。感受态细胞在LB液体培养基中培养1 h后,均匀的涂在固体培养基上进行过夜培养16 h。挑取单菌落,至5 mL LB液体培养基中,280 r/min,37 ℃条件下摇床培养7 h。培养结束后取2 μL菌液进行PCR鉴定。将阳性样品送至生工生物工程(上海)股份有限公司完成测序。
1.2.3 序列分析 测序结果及数据处理等借助DNAStar(DNASTAR Inc.,Madison,USA)和DNAMAN Version 6.0(LynnonBiosoft,Quebe Canada)软件完成。利用NCBI(National Center for Biotechnology Information,美国国立生物技术信息中心)数据库的BLAST程序(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源序列搜索。采用DNAStar的Clustal V程序进行同源性分析。利用Clustal_X version 1.83[18]进行完全比对后再用软件MEGA version 5.13[19]的最大似然法绘制亲缘关系树,设置种子重复数是1 000。分支节点上的数值为后验概率,高于50%显示。用于序列比较和关系树构建的病毒序列信息见表1。
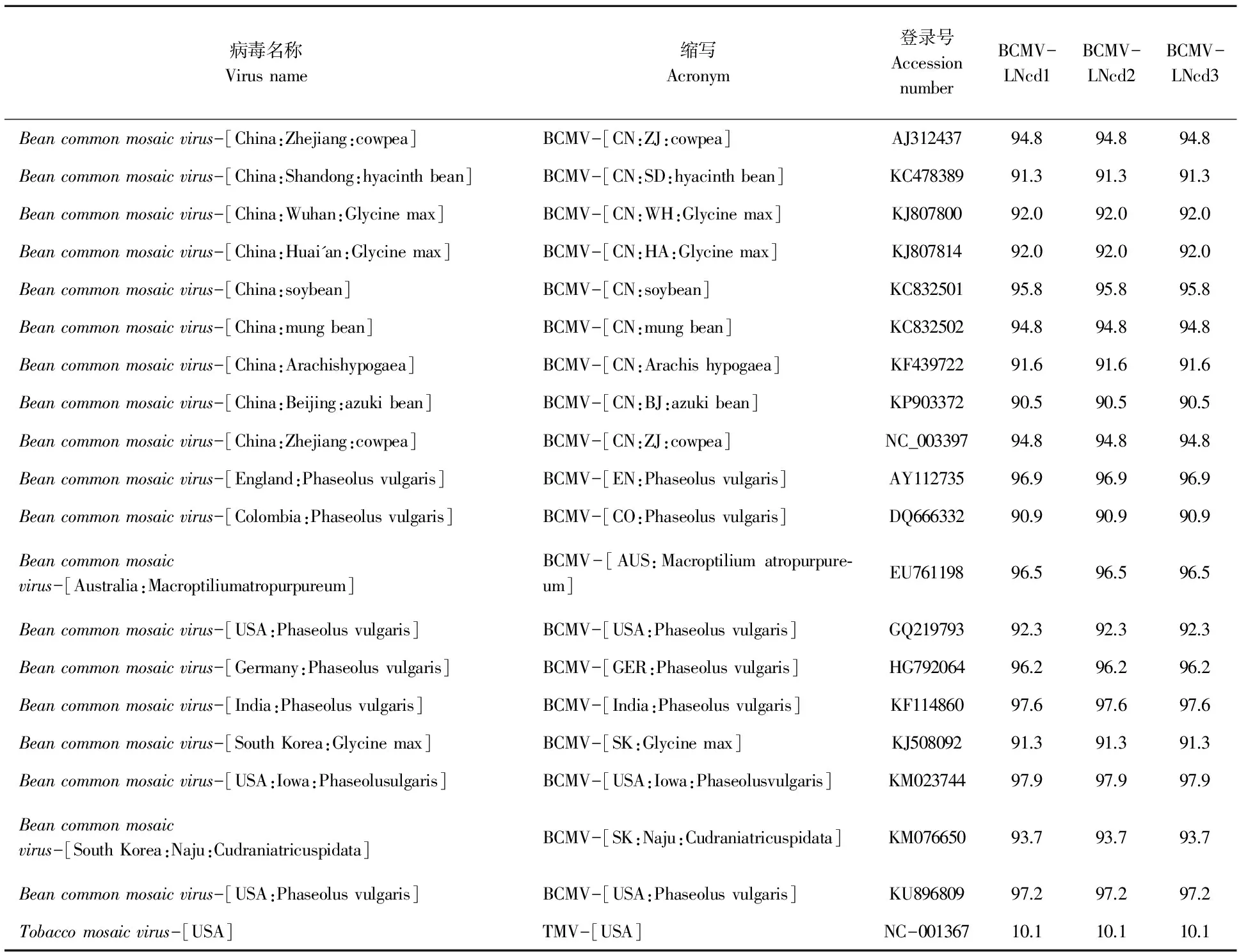
表1 BCMV 3个辽宁分离物与其它报道BCMV分离物的cp基因的氨基酸序列同源性
2 结果与分析
2.1 RT-PCR检测结果
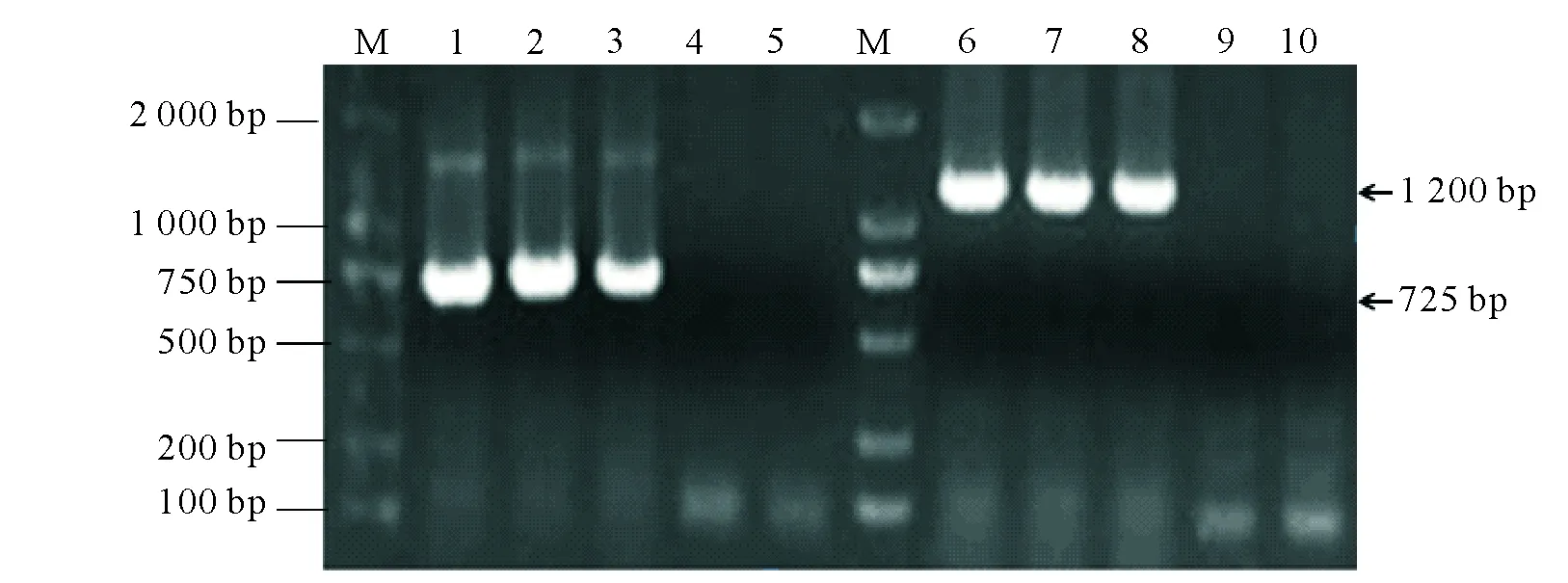
M:Marker DL2000;1-5:Legpoty-F/Legpoty-R引物扩增结果;6-10:BCMV-CP-F/BCMV-CP-R引物扩增结果;4和9是健康植物样品;5和10是水为对照M:Marker DL2000;lanes 1-5 are results amplified with Legpoty-F/Legpoty-R;lanes 6-10 are results amplified with BCMV-CP-F/BCMV-CP-R;4 and 9 are healthy plants control;5 and 10 are water control图2 菜豆病叶的BCMV病毒RT-PCR检测结果Fig.2 Detection of BCMV virus in Phaseolus vulgaris L.diseased leaves by RT-PCR
利用Legpoty-F/Legpoty-R引物[16]对菜豆病叶的cDNA进行扩增得到约725 bp的目的片段,而健康菜豆中没有检测到该片段。Blast检测显示该片段与BCMV高度同源。于是,利用已报道的BCMV特异性引物BCMV-CP-F/BCMV-CP-R引物[17]继续扩增,获得长约1.2 kb的片段,包含了完整的外壳蛋白基因(coat protein,cp)(图2)。
2.2 序列分析
盖州的3个菜豆样品上BCMV分离物CP基因均为861 bp(GenBank登录号是MF361092-MF361094),编码287个氨基酸,氨基酸同源性为100%。3个分离物与已经报道的BCMV的同源性分析显示,它们均与BCMV的美国艾奥瓦州菜豆分离物BCMV-[USA:Iowa:Phaseolus vulgaris](KM023744)同源性最高,为97.9%,其次是与印度菜豆分离物BCMV-[India:Phaseolus vulgaris](KF114860)同源性为97.6%,与英国菜豆分离物BCMV-[EN:Phaseolus vulgaris](AY112735)同源性为96.9%,与澳大利亚分离物BCMV-[AUS:Macroptiliumatropurpureum](EU761198)同源性为96.5%。与中国分离物同源性在91.3%~95.8%,其中最高的是BCMV-[CN:soybean](KC832501)95.8%,其次是BCMV-[CN:ZJ:cowpea](NC_003397)、BCMV-[CN:mung bean](KC832502)和BCMV-[CN:ZJ:cowpea](AJ312437),均为94.8%(表1)。系统进化树分析显示,BCMV没有明显的聚类限制,它们主要聚类在两个分支上,盖州3个分离物与BCMV-[CN:mung bean](KC832502)、BCMV-[AUS:Macroptiliumatropurpureum](EU761198)、BCMV-[India:Phaseolus vulgaris] 和BCMV-[USA:Iowa:Phaseolus vulgaris](KM023744)聚集在一个分支上,而其他中国分离物与韩国分离物聚集在另一个分支上。

图3 基于已报道的BCMV cp基因核苷酸序列构建的系统树Fig.3 Phylogenetic trees based on cp sequences of the previously reported BCMV
3 结论与讨论
本研究在辽宁盖州地区的菜豆上分离鉴定到BCMV病毒,通过RT-PCR检测、克隆和测序,获得完整的cp基因。基于cp基因的同源性比较,发现3个分离物与BCMV的美国艾奥瓦州菜豆分离物BCMV-[USA:Iowa:Phaseolusvulgaris](KM023744)同源性最高,为97.9%。根据国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICTV)第9次报告中的马铃薯Y病毒的分类标准,cp基因氨基酸序列相似性小于80%,或者核苷酸序列相似性小于76%,可认为是不同病毒种[5]。因此,侵染菜豆病毒是BCMV的辽宁分离物,这是辽宁首次报道菜豆上自然存在BCMV病毒。
BCMV是众多能自然侵染豆科植物病毒中危害性最强的,BCMV具有寄主范围广泛、传毒效率较高、传播方式多样等特点,极易造成豆科植物特别是菜豆的减产甚至绝收,对农业生产造成极大的危害。近年来,BCMV先后从中国的浙江、台湾、山东、南京、湖北的豇豆、绿豆、黑眼豇豆、扁豆、花生和芝麻[20-24]上分离出来,但在辽宁未见BCMV相关报道。菜豆等豆科作物在辽宁普遍种植,这些作物是否也受到BCMV的侵染和危害? 本研究经过试验确定辽宁菜豆黄化病害相关病毒是BCMV。后续将加大对辽宁地区BCMV病害调查范围,提供更多BCMV辽宁分离物序列信息,为BCMV的防治提供重要的理论依据。
参考文献:
[1] Lana A F,Lohuis H,Bos L.Relationships among strains of bean common mosaic virus and blackeye cowpea mosaic virus-members of the potyvirus group[J].Annals of Applied Biology,2010,113(3):493-505.
[2] Barnett O W.Potyviridea,a proposed family of plant viruses[J].Archives of Virology,1991,118(1/2):139-141.
[3] Stewart V B,Reddick D.Bean mosaic[J].Phytopathology,1917,7:61.
[4] Pierce W H.Viruses of the bean[J].Phytopathology,1934,24:87-115.
[5] King A M,Adams M J,Lefkoitz E J.Virus taxonomy:ninth report of the international committee on taxonomy of viruses[R].Amsterdam,Netherlands:Elsevier,2012.
[6] Edwarson J R,Christie R G,Ko N.Potyvirus cylindrical inclusions-Subdivision-IV[J].Phytopathology,1984,74:1111-1114.
[7] Klein R E,Wyatt S D,Kaiser W J.Incidence of bean common mosaic virus in USDA Phaseolous germ plasm collection[J].Plant Disease,1988,72(4):301-302.
[8] Edwardson J R,Christie RG,Ko N.Potyvirus cylindrical inclusions-Subdivision-IV[J].Phytopathology,1984,74:1111-1114.
[9] Udayashankar A C,Chandra Nayaka S,Niranjana S R,et al.First report ofBeancommonmosaicvirusinfecting lablab purpureus in India[J].Plant Disease,2011,95(7):881.
[10] Ha C,Revi P,Harding R M,et al.Identification and sequence analysis of potyviruses infecting crops in Vietnam[J].Archives of Virology,2008,153(1):45-60.
[11] Choi H,Kim M,Park J,et al.First report of the Peanut stripe stain ofBeancommonmosaicvirus(BCMV-Pst)infecting mungben in Korea[J].Plant Pathology Journal,2006,22(22):46-50.
[12] 郑红英,陈炯,程晔,等.菜豆普通花叶病毒长菜豆分离物外壳蛋白基因的序列分析及原核表达[J].植物病理学报,2003,33(1):95-96.
Zheng H Y,Chen J,Cheng Y,et al.Sequence analysis of coat protein gene of a BCMV isolate infecting asparagus bean and its expression inEscherichiacoli[J].Acta Phytopathologica Sinica,2003,33(1):95-96.
[13] 候珊珊,崔小雯,杨炳辉,等.山东花生病毒种类检测和花生条纹病毒分子变异分析[C]//彭友良,王振中.中国植物病毒病理学会2010年学术年会论文集.北京:中国农业科学技术出版社,2010:396-396.
Hou S S,Cui X W,Yang B H,et al.Detection of peanut viruses and analysis of molecular variation ofPeanutstripevirusin Shandong[C]//Peng Y L,Wang Z Z.Proceedings of the Annual meeting of Chinese Society of Plant Pathology(2010).Beijing:China Agriculture Press,396-396.
[14] Yan L Y,Xu Z Y,Liao B.Molccular detection of peanut stripe virus isolated from Sesame(SesamunindiciumL.)[J].Chinese Journal of Oil Crop Sciences,2009,31(1):19-22.
[15] 郑红英,陈炯,侯明生,等.菜豆普通花叶病毒研究进展[J].浙江农业学报,2002,14(1):55-60.
Zheng H Y,Chen J,Hou M S,et al.Research advances onBeancommonmosaicvirus[J].Acta Agriculturae Zhejiangensis,2002,14(1):55-60.
[16] 陈炯,陈剑平.Potyvirus属成员基因组全序列的简并引物PCR和RACE扩增方法[J].病毒学报,2002,18(4):371-374.
Chen J,Chen J P.Determination of genome sequence of potyviruses by degenerated PCR and RACE methods[J].Chinese Journal of Virology,2002,18(4):371-374.
[17] 沈良,崔瑾,夏妍,等.一种新发现的侵染绿豆的菜豆普通花叶病毒分子鉴定[J].华北农学报,2014,29(4):164-168.
Shen L,Cui J,Xia Y,et al.Molecular identification of a newly discoveredBeancommonmosaicvirusof Mung bean[J].Acta Agriculturae Boreali-Sinica,2014,29(4):164-168.
[18] Thompson J D,Gibson T J,Plewniak F,et al.The CLUSTAL_X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Research,1997,25:4876-4882.
[19] Tamura K,Peterson D,Peterson N,et al.MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28(10):2731-2739.
[20] Zheng H,Chen J,Chen J,et al.Beancommonmosaicvirusisolates causing different symptoms in asparagus bean in China differ greatly in the 5′-parts of their genomes[J].Archives of Virology,2002,147(6):1257-1262.
[21] Wang H L,Fang C C.Molecular sequencing and analysis of the viral genomic regions ofBlackeyecowpeamosaicvirusTaiwan strain[J].Plant Pathol Bulletin,2004,13(2):117-126.
[22] 苏文敏.三种豆科作物菜豆普通花叶病毒分离物的分子鉴定及全基因组序列测定和分析[D].泰安:山东农业大学,2013.
Su W M.Molecular identification and analysis of the complete genome sequences ofBeancommonmosaicvirusfrom three Legumes[D].Tai’an:Shandong Agricultural University,2013.
[23] Cui X Y,Shen L,Yuan X X,et al.First report ofBeancommonmosaicvirusinfecting Mungbean(Vignaradiata)in China[J].Plant Disease,2014,98(11):1590.
[24] Zhou G C,Wu X Y,Zhang Y M,et al.A genomic survey of thirty soybean-infectingBeancommonmosaicvirus(BCMV)isolates from China pointed BCMV as a potential threat to soybean production[J].Virus Research,2014,191:125-133.
