转录因子HY5在植物光形态建成和氮代谢中的调控作用
2018-05-04王志冉王红艳邓海峰许传强
王志冉 王红艳 邓海峰 许传强
(沈阳农业大学园艺学院,设施园艺省部共建教育部重点实验室,环渤海湾地区设施园艺蔬菜优质高效生产协同创新中心,辽宁沈阳110866)
转录因子HY5(ELONGATED HYPOCOTYL5)是亮氨酸拉链(bZIP)类的转录因子,它能通过不同的感受光信号接收光信号,并将光信号传递给下游作用元件,进而调控植物的生长发育。研究发现,植物的光形态建成(photomorphogenesis)和氮素的吸收同化都会受到HY5转录因子的调控,而且这些调控方式都会受光照的诱导(Chen et al.,2016;Li & He,2016)。HY5是调控光形态建成的重要因子。植物光形态建成的表型,如幼苗下胚轴的伸长、植株的黄化与去黄化等与HY5的表达具有密切关系。此外,HY5也会启动光形态建成下游的光敏色素、隐花色素、UV-B光感受器(Casal,2013),进而调控植物基本的发育进程,例如细胞的分裂与伸长,叶绿体的发育和营养元素的吸收同化等(Oyama et al.,1997)。近期的一项研究证明HY5也是调控植物氮碳平衡的重要因子。HY5在光照条件下积累,促进光合产物从地上部移动到根,同时HY5也是长距离运输的信号分子,它能够促进主根的生长,同时诱导硝酸盐从根系向地上部运输,从而调节了植物的碳氮平衡(Chen et al.,2016)。可见,转录因子HY5在植物光形态建成、内源激素信号转导、氮代谢及碳氮平衡方面具有重要调控作用。
1 转录因子HY5在光介导的信号转导中的调控作用
HY5是定位到细胞核内的组成型蛋白质,由168个氨基酸组成,分子量为18.5 kDa(Oyama et al.,1997),是第1个被发现参与光形态建成并进行深入研究的转录因子(Ang et al.,1998;Li et al.,2010)。光是植物生长发育所必需的,能够调节幼苗光形态建成和种子萌发等过程(Jiao et al.,2007)。光照条件下生长的拟南芥,在种子破土到幼苗生长的过程中,植株主要表现出下胚轴缩短、子叶展开、根和茎的顶端分生组织细胞的数量调控,同时叶绿体迅速积累,植株呈现出去黄化(de-etioletion)的现象,这些都是光形态建成的具体表现;相反,在黑暗中生长的幼苗呈现的表型叫做暗形态建成(skotomorphogenesis),其代表性的特征主要是:细长的下胚轴,两片子叶未展开,顶端形成弯弯的勾状结构,叶绿体发育不完全并呈现出黄化的表型等(Srivastava et al.,2015;Gangappa &Botto,2016;Li & He,2016)。光照是调控植物光形态建成最重要的环境因子之一,决定了植物种子的萌发、幼苗的去黄化、器官发育、开花和种子发育等生长发育进程(Kircher & Schopfer,2012)。不同的光感受器吸收光并将光信号传递给HY5转录因子,进一步响应特异性的激素、养分吸收、非生物胁迫(冷害、高盐)和新陈代谢等生命活动涉及的信号通路以适应植物的生长与发育(Kircher &Schopfer,2012)。
在可见光和UV-B的光照条件下,HY5能够激活自身基因的转录,促进基因的表达(Abbas et al.,2014;Binkert et al.,2014)。COP1(constitutive photomorphogeneic 1)是光信号转导因子中非常重要的一个蛋白,称为光形态建成调控因子。它对红光、远红光和蓝光信号都能做出反应,对光信号的转导起限速作用,是光受体信号转导中的关键因子(Hardtke et al.,2000)。研究发现HY5能够与COP1相互作用,黑暗条件下COP1在细胞核内积累,HY5与COP1的N末端结合,使HY5泛素化并降解,负调控HY5下游光形态建成下游基因的表达(Holm et al.,2002;Yoon et al.,2006;Cloix et al.,2012);在光照条件下,COP1移动到细胞核外,不能与HY5相互作用,HY5大量积累,促进了HY5转录因子下游信号的传递,加快反应进程(Osterlund et al.,2000;Huang et al.,2012)。这一原理可以解释光照条件下幼苗的去黄化现象。
在可见光或UV-B的光照条件下,HY5能够通过诱导色素生物合成关键基因的表达来调控色素的合成与积累(Holm et al.,2002;Shin et al.,2007;Stracke et al.,2010)。花青素是黄酮类化合物,可以保护植物组织免受许多环境胁迫,花青素的生物合成与温度的变化密切相关,能够增强胁迫条件下植物的生存能力(Pastore et al.,2017)。花青素生物合成早期基因包括查尔酮合成酶基因CHS(chalcone synthase)、查尔酮异构酶基因CHI(chalcone isomerase)等,转录因子HY5与光诱导型基因CHS的启动子直接结合,进行转录水平的调控(Ang et al.,1998;Shin et al.,2007),HY5 还能够与CHI基因的启动子结合,也能够促进花青素的生物合成。HY5和它的同源基因HYH在低温条件下诱导CHS和CHI基因的表达,诱导花青素的积累主要依赖于光信号的转导增加HY5的蛋白水平来实现的(Zhang et al.,2011)。研究表明,高温能够抑制植物花青素的生物合成,甚至在一些成熟果实(如苹果和葡萄)的果皮中,花青素的含量也会减少(Mori et al.,2007;Lin-Wang et al.,2011;Movahed et al.,2016)。高温抑制花青素的生物合成是通过E3泛素连接酶COP1与花色素苷的正调控因子HY5共同调控的。与低温(17 ℃)条件相比,高温(28 ℃)条件下拟南芥花色素苷的含量显著升高,原因是环境温度的升高会降低花青素生物合成基因的表达量,然而在cop1与hy5突变体中花青素的合成与积累不受温度变化的影响(Kim et al.,2017)。总之,高温条件下抑制花青素的生物合成是通过COP1-HY5信号途径完成的。研究表明,PSY(phytoene synthase)是八氢番茄红素合成酶基因,是调控类胡萝卜素生物合成的关键基因,HY5能诱导PSY基因的表达(Toledo-Ortiz et al.,2014)。HY5参与光信号转导在调控植物体内色素合成过程中发挥着重要的作用。
HY5转录因子是光照在昼夜交替过程中一个重要的信号转换集成点(Zhang et al.,2011),植株地上部接收的光信号能够经过茎并传递到根系,激活根系中的光敏色素(Lee et al.,2016)。HY5能够在拟南芥根细胞的所有组织中表达,而HYH在根系的木质部细胞中表达。将在黑暗条件下生长的hy5突变体、hyh突变体与hy5 hyh双突变体给予一定的光照干扰,hy5突变体的根系生长就会受到阻碍,而hyh突变体与hy5 hyh双突变体的根系生长不会受到光照的干扰,这说明了HY5在光控制的根系的光形态建成中起着重要的作用(Zhang et al.,2017)。
2 转录因子HY5在激素信号转导途径中的调控作用
植物激素作为植物体内的痕量信号分子,对于调节植物的生长发育过程和对环境的应答具有十分重要的意义(康云艳 等,2007)。赤霉素(GA)、脱 落 酸(ABA)、 生 长 素(auxin,IAA)、 乙 烯(ethylene)、细胞分裂素(cytokinin)等激素的生物合成信号转导都会受到HY5的调控,HY5位于调控网络的中心位置(Gangappa & Botto,2016),与多种激素信号通路相偶联共同调控植物的光形态建成(图1)。
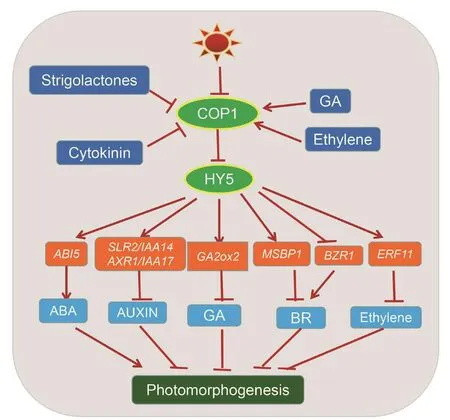
图1 HY5通过不同激素信号转导途径调控植物光形态建成(Gangappa & Botto,2016)
2.1 生长素
hy5突变体在幼苗生长过程中表现出下胚轴细长的表型,产生这一现象的部分原因是由于HY5通过改变植物体内生长素和细胞分裂素之间的平衡,影响了信号转导。通过基因芯片技术和半定量RT-PCR技术筛选出2个生长素信号的负调控因子AXR2(IAA7)和SLR(IAA14),这2个基因在hy5突变体中都上调表达(Cluis et al.,2004)。Sibout等(2006)同样发现HY5通过抑制生长素信号的传递抑制下胚轴的伸长。HY5调控植物根系的表型还会受到氮素供应水平和供应形式的影响,这也是由HY5与生长素之间的信号交流进行调控的(Huang et al.,2015)。研究发现,植物能够感知来自周围环境中的远红光信号,远红光信号的改变使红光与远红光的比例(R∶FR)发生改变,光敏色素接收信号,同时传递给光敏色素依赖型转录因子HY5,HY5通过减少根系表皮细胞质膜上的PIN3与LAX3生长素运输蛋白的丰度调控根系的生长。环境中远红光的增加,降低了根系表皮细胞生长素的信号强度,从而使侧根原基发生减少,根系密度降低(van Gelderen et al.,2018)。HY5作为长距离运输的信号分子,与生长素之间的信号交流主要是将地上部接收的光照信号传递到根系,在植物幼苗根系的生长发育和根系系统结构表型方面发挥重要的作用。
2.2 油菜素内酯
油菜素内酯(BR)是植物体内必不可少的激素,在植物生长发育过程中发挥着重要的作用,BR能够促进植物细胞的伸长,提高抗逆性与抗病能力(Oyama et al.,1997)。研究表明,在黑暗中生长的双子叶植物幼苗会在下胚轴的顶端形成一个钩状结构,钩状结构的形成依赖于生长素浓度梯度,其他激素与光照条件也参与了钩状结构的形成(Sun et al.,2010)。光照与BR参与调控子叶的开放以及顶端钩状结构的形成,在种子从土壤中萌发冲破土壤的过程中,有利于植物保护茎尖分生组织不被破坏(Li & He,2016)。无钩突变体在种子埋入土壤时不能顺利萌发(Oyama et al.,1997)。光照能够调控HY5转录因子,BR能够调控BR合成抑制剂因子BZR1(brassinazole 1)转录因子,HY5能够和BZR1相互作用调控拟南芥幼苗的光形态建成。HY5与BZR1蛋白互作,使BZR1发生磷酸化导致活性降解,从而在拟南芥种子破土后,促进两片子叶展开,而顶端勾状结构也随之消失,调控了植物的光形态建成(Li & He,2016)。膜类固醇结合蛋白MSBP1(membrane steroid binding protein 1)可与类固醇激素在体外结合,负调控BR信号,调控细胞的分裂和伸长(Yang et al.,2005;Song et al.,2009)。在油菜素内酯信号转导途径中,HY5还能够直接诱导BR信号转导途径中的负调控因子MSBP1基因的表达(Shi et al.,2011)。总之,HY5抑制油菜素内酯信号途径的传导,在BR信号转导途径中起负调控作用,促进植物光形态建成表型的产生。
2.3 赤霉素
GA是光形态建成中的负调控因子,其中一个作用是能够抑制HY5蛋白的积累(Gar cí a-Martinez &Gil,2001;Alabadı´ et al.,2004), 还 有 研 究 表明GA主要通过COP1对HY5蛋白进行调控(Yu et al.,2013)。GA能够抑制HY5的积累,HY5也能够调控GA的含量。DELLA蛋白是GA信号通路中的一个重要的蛋白结构域,光照通过抑制GA的生物合成同时增强DELLA的活性来抑制GA的信号转导(Achard et al.,2007),通过 ChIP-Seq分析,HY5能够作用于许多GA代谢过程中的相关基因(Lee et al.,2016)。HY5能够调控GA降解水平基因GA2ox2的表达(Weller et al.,2009),同时GA2ox2酶活性的增加能够提高DELLA的活性,使GA大量降解(Achard et al.,2007)。以目前的结论推测HY5与GA信号之间可能存在着反馈调节机制,GA负调控HY5的积累,同时HY5也促进GA的降解,它们之间的相互作用也是调控植物光形态建成进程的一条信号通路。
2.4 乙烯
内源激素乙烯能够使植物发生典型的“三重反应”,使幼苗的根系缩短变粗,对乙烯信号相关基因突变体和hy5突变体进行表型分析,发现乙烯对于幼苗下胚轴生长的促进作用在突变体中被抑制了,确定了HY5是乙烯调控拟南芥幼苗下胚轴生长的关键因子(于延文,2013)。同时光照也是调控拟南芥下胚轴生长的关键因素,光照促进下胚轴生长,黑暗抑制下胚轴生长。在光照条件下,乙烯能够促进光敏色素互作因子PIF3的表达,同时抑制HY5蛋白的降解,从而促进下胚轴生长,然而在黑暗条件下,ERF1与WDL5能够被乙烯诱导,抑制下胚轴的生长(Yu & Huang,2017)。ERF11(ethylene response factor 11)是乙烯的生物合成抑制子,通过抑制乙烯合成基因ACS2/5的表达调控乙烯的生物合成。HY5也能够启动ERF11基因的表达,抑制乙烯的信号转导(Li et al.,2011)。在拟南芥幼苗的去黄化过程中,HY5能够与ERF4(ethylene responsive element binding protein 4)基因的启动子结合。ERF4也是活性氧响应的基因,它能够抑制活性氧的积累,在低温条件下保护光系统减少光抑制(Chen et al.,2013)。HY5在乙烯信号转导途径中不仅调控了植物光形态建成的表型,而且也参与了植物对逆境的响应。植物在抵抗强光等逆境时,HY5与乙烯信号通路集成起到了重要的调控作用。
2.5 脱落酸
光照是调控植物生长的重要环境因子,植物激素脱落酸调节植物生长发育的各个方面,在植物对环境胁迫的适应性反应中起着至关重要的作用,也是调节气孔开度的关键(Cutler et al.,2010;Nakashima & Yamaguchi-Shinozaki,2013)。植物能够将外界的光照信号与内源的ABA通路结合起来,以便更好地适应和生存。BBX21是一类B-box蛋白,能够正调控植物的光形态建成,也参与ABA信号转导。BBX21通过干扰HY5转录因子与ABA上游不敏感基因ABI5的启动子结合负调控ABI5基因的表达,这一过程将光照与ABA信号相偶联,调节整个转录协调工作(Chen et al.,2008)。HY5将光信号与ABA信号相偶联,调控种子的萌发,HY5能够与ABA信号的正向调控的转录因子ABI5基因的启动子结合,进行转录水平的调控,抑制种子的萌发(Chen et al.,2008)。HY5调控ABI5基因的表达影响植物的耐盐性,ABA也能通过其信号转导途径影响HY5,从而抑制ABI5基因的表达,提高高盐条件下种子的萌发率(李卓夫,2011)。可见HY5与ABA信号转导途径偶联,并有可能存在着反馈调节机制。HY5与ABA相偶联与乙烯相似,也在植物光形态建成和抗逆方面发挥重要作用。
3 HY5在氮代谢和碳氮平衡中的调控作用
植物对氮素的吸收、转运、同化受光照和养分有效性的影响。植物根系吸收硝酸盐后运输到地上部的叶片、种子等器官中主要是通过硝酸转运蛋白(nitrate transporter,NRT)实现的。依据吸收硝酸盐浓度的不同可以分为高亲和转运蛋白和低亲和转运蛋白,它们是吸收硝酸盐的主要载体(Dechorgnat et al.,2010)。两个bZIP类型的转录因子HY5和HYH都可能是光诱导的硝酸还原酶基因NIA2(nitrate reductase 2)表达的直接诱导因子,无论是在拟南芥幼苗中还是莲座时期,HY5和HYH对氮代谢关键酶硝酸还原酶基因NR的高表达具有关键作用(Jonassen et al.,2008;Lillo,2008)。在拟南芥hy5 hyh双突变体中,光依赖型NIA2的转录水平受到抑制,表明HY5和HYH调节光诱导的NIA2基因的表达(Jonassen et al.,2009a)。但是HY5与HYH具有功能冗余现象,这2个蛋白共同发挥作用还是每个蛋白发挥了不同的作用尚不明确。
无论在不同的硝酸盐供应水平下还是在不同的光照条件下,HY5都正调控亚硝酸还原酶基因NIR1的表达,负调控铵盐转运基因AMT1;2(ammonium transporter1;2)的表达,同时在不同氮素形式(硝态氮、铵态氮和硝酸铵3种形式的氮)和不同氮素浓度供应的条件下也会影响其他氮代谢相关基因的表达(Jonassen et al.,2009b)。HY5需要光照诱导NIR1、AMT1;2和亚硝酸还原酶(nitrite reductase)基因NIA的表达,而且在氮素和光照适宜的条件下,NIR1、AMT1;2和NIA基因的表达量也明显提高。在持续的低氮浓度条件下,HY5缺失突变体的根系系统结构发生变化,硝酸还原酶活性显著降低,铵盐含量显著增加(Huang et al.,2015)。可见HY5参与拟南芥氮素同化吸收的过程十分复杂。光感受器感应到光会诱导氮同化基因的表达,然而在信号级联放大中的转换元件中这些基因的功能还不清楚。
HY5不仅能够诱导氮代谢相关基因的表达,促进植物对氮素的吸收运转,还促进了地上部光合产物的形成以及向地下部的运输。在拟南芥中碳素的固定主要是光合产物以蔗糖的形式从韧皮部转移到植物的库组织中(Chen et al.,2012)。研究发现HY5能够调控蔗糖的代谢途径,能与编码海藻糖-6-磷酸合酶基因TPS1结合控制其转录水平,同时还能够诱导蔗糖转运蛋白(sugar transporter,SWEET11、SWEET12) 转 录 促 进 蔗糖从叶片中输出,运输到地下部(Chen et al.,2016)。同时,HY5也能够从地上部运输到根系。地上部的HY5与根系中的基因结合,将地上部接收的光信号传递至根系,实现光信号的放大。运输到根系的蔗糖也可以作为信号分子,诱导HY5转录因子与根系中的硝酸转运蛋白基因NRT2.1结合,促进NRT2.1的表达。HY5将地上部碳素的同化与根系中氮素的吸收连接,实现了地上部与地下部之间的信息交流,促进了植物碳氮原状平衡(图 2)。
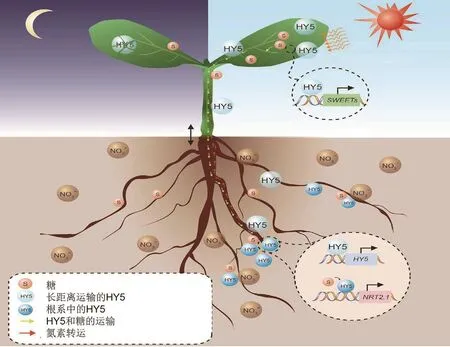
图2 HY5调控碳氮平衡模式图(Chen et al.,2016)
4 展望
综上所述,转录因子HY5不仅促进植物光形态建成和幼苗生长,在激素和代谢途径中的响应作用表明HY5具有多种功能。越来越多的研究结果表明,HY5与其他的激素信号通路集成启动植物光形态建成。并且,HY5也是从茎运输到根的信号分子,调控地上部碳素同化和蔗糖积累,增强了根系对HY5依赖型氮素的吸收,不仅促进了根系对的吸收与转运,而且促进了碳氮平衡。我国在芜菁(周波 等,2008)、油菜(郭继平,2013)、番茄(张田田,2016)中也开展了有关转录因子HY5在光形态建成、逆境等方面的调控作用研究。沈阳农业大学设施蔬菜栽培与生理课题组目前也正在从事转录因子HY5调控嫁接甜瓜氮代谢和碳氮平衡方面的研究工作,结果发现嫁接能够极显著地提高甜瓜幼苗叶片中HY5基因表达。这些研究对进一步探析不同物种中转录因子HY5功能具有十分重要的意义和作用。近年来,伴随着分子生物学技术的成熟发展,利用高通量测序技术、代谢组学和蛋白质组学等技术,可为进一步探究转录因子HY5在植物生长发育过程中的功能及其调控网络提供技术保障。同时,转录因子HY5功能的解析对进一步调控植物生长发育也提供了新的思路和方向。
郭继平.2013.油菜HY5基因的电子克隆及生物信息学分析.北方园艺,(23):116-118.
康云艳,郭世荣,段九菊.2007.新型植物激素与蔬菜作物抗逆性关系研究进展.中国蔬菜,(5):39-42.
李卓夫.2011.转录因子HY5在拟南芥乙烯生物合成及信号转导中的功能分析〔博士论文〕.北京:中国农业科学院.
于延文.2013.乙烯调控拟南芥HY5蛋白稳定性和幼苗下胚轴生长〔硕士论文〕.北京:中国农业科学院.
张田田.2016.番茄SlHY5基因在低温胁迫中的作用〔硕士论文〕.杨凌:西北农林科技大学.
周波,王宇,孙梅,李玉花.2008.津田芜菁bZIP蛋白HY5 cDNA的克隆及表达特性.分子植物育种,6(1):59-64.
Abbas N,Maurya J P,Senapati D,Gangappa S N,Chattopadhyay S.2014.ArabidopsisCAM7 and HY5 physically interact and directly bind to theHY5promoter to regulate its expression and thereby promote photomorphogenesis.The Plant Cell,26:1036-1052.
Achard P,Liao L,Jiang C,Desnos T,Bartlett J,Fu X,Harberd N P.2007.DELLAs contribute to plant photomorphogenesis.Plant Physiology,143:1163-1172.
Alabad í D,Gil J,B lá zquez M A,Gar cí a-Mar tí nez J L.2004.Gibberellins repress photomorphogenesis in darkness.Plant Physiology,134:1050-1057.
Ang L H,Chattopadhyay S,Wei N,Oyama T,Okada K,Batschauer A,Deng X W.1998.Molecular interaction between COP1 and HY5 defines a regulatory switch for light control ofArabidopsisdevelopment.Molecular Cell,1(2):213-222.
Binkert M,Kozma-Bogn á r L,Terecskei K,de Veylder L,Nagy F,Ulm R.2014.UV-B-responsive association of theArabidopsisbZIP transcription factor ELONGATED HYPOCOTYL5 with target genes,including its own promoter.The Plant Cell,26:4200-4213.
Casal J J.2013.Photoreceptor signaling networks in plant responses to shade.Annual Review of Plant Biology,64:403-427.
Chen H,Zhang J,Neff M M,Hong S W,Zhang H,Deng X W,Xiong L.2008.Integration of light and abscisic acid signaling during seed germination and early seedling development.Proceedings of the National Academy of Sciences,105:4495-4500.
Chen L Q,Qu X Q,Hou B H,Sosso D,Osorio S,Fernie A R,Frommer W B.2012.Sucrose efflux mediated by SWEET proteins as a key step for phloem transport.Science,335:207-211.
Chen D,Xu G,Tang W,Jing Y,Ji Q,Fei Z,Lin R.2013.Antagonistic basic helix-loop-helix/bZIP transcription factors form transcriptional modules that integrate light and reactive oxygen species signaling inArabidopsis.The Plant Cell,25:1657-1673.
Chen X,Yao Q,Gao X,Jiang C,Harberd N P,Fu X.2016.Shootto-root mobile transcription factor HY5 coordinates plant carbon and nitrogen acquisition.Current Biology,26:640-646.
Cloix C,Kaiserli E,Heilmann M,Baxter K J,Brown B A,O’Hara A,Jenkins G I.2012.C-terminal region of the UV-B photoreceptor UVR8 initiates signaling through interaction with the COP1 protein.Proceedings of the National Academy of Sciences,109:16366-16370.
Cluis C P,Mouchel C F,Hardtke C S.2004.TheArabidopsistranscription factor HY5 integrates light and hormone signaling pathways.The Plant Journal,38:332-347.
Cutler S R,Rodriguez P L,Finkelstein R R,Abrams S R.2010.Abscisic acid:emergence of a core signaling network.Annual Review of Plant Biology,61:651-679.
Dechorgnat J,Nguyen C T,Armengaud P,Jossier M,Diatloff E,Filleur S,Daniel-Vedele F.2010.From the soil to the seeds:the long journey of nitrate in plants.Journal of Experimental Botany,62:1349-1359.
Gangappa S N,Botto J F.2016.The multifaceted roles of HY5 in plant growth and development.Molecular Plant,9:1353-1365.
Gar cí a-Martinez J L,Gil J.2001.Light regulation of gibberellin biosynthesis and mode of action.Journal of Plant Growth Regulation,20:354-368.
Hardtke C S,Gohda K,Osterlund M T,Oyama T,Okada K,Deng X W.2000.HY5 stability and activity inArabidopsisis regulated by phosphorylation in its COP1 binding domain. The EMBO Journal,19:4997-5006.
Holm M,Ma L G,Qu L J,Deng X W.2002.Two interacting bZIP proteins are direct targets of COP1-mediated control of lightdependent gene expression inArabidopsis.Genes & Development,16:1247-1259.
Huang X,Ouyang X,Yang P,Lau O S,Li G,Li J,Deng X W.2012.ArabidopsisFHY3 and HY5 positively mediate induction of COP1 transcription in response to photomorphogenic UV-B light.The Plant Cell,24:4590-4606.
Huang L,Zhang H,Zhang H,Deng X W,Wei N.2015.HY5 regulates nitrite reductase 1(NIR1)and ammonium transporter1;2(AMT1;2)inArabidopsisseedlings.Plant Science,238:330-339.
Jiao Y,Lau O S,Deng X W.2007.Light-regulated transcriptional networks in higher plants.Nature Reviews Genetics,8:217-230.
Jonassen E M,Lea U S,Lillo C.2008.HY5andHYHare positive regulators of nitrate reductase in seedlings and rosette stage plants.Planta,227:559-564.
Jonassen E M,Sandsmark B A,Lillo C.2009a.Unique status ofNIA2in nitrate assimilation:NIA2expression is promoted by HY5/HYH and inhibited by PIF4.Plant Signaling & Behavior,4(11):1084-1086.
Jonassen E,S é vin D C,Lillo C.2009b.The bZIP transcription factors HY5 and HYH are positive regulators of the main nitrate reductase gene inArabidopsisleaves,NIA2,but negative regulators of the nitrate uptake geneNRT1.1.Journal of Plant Physiology,166:2071-2076.
Kim S,Hwang G,Lee S,Zhu J Y,Paik I,Nguyen T T,Oh E.2017.High ambient temperature represses anthocyanin biosynthesis through degradation of HY5.Frontiers in Plant Science,8:doi:10.3389/fpls.2017.01787.
Kircher S,Schopfer P.2012.Photosynthetic sucrose acts as cotyledonderived long-distance signal to control root growth during early seedling development inArabidopsis.Proceedings of the National Academy of Sciences,109:11217-11221.
Lee H J,Ha J H,Kim S G,Choi H K,Kim Z H,Han Y J,Hyeon T.2016.Stem-piped light activates phytochrome B to trigger light responses inArabidopsis thalianaroots.Sci Signal,9:ra106.
Li J,Li G,Gao S,Martinez C,He G,Zhou Z,Wang H.2010.Arabidopsistranscription factor ELONGATED HYPOCOTYL5 plays a role in the feedback regulation of phytochrome A signaling.The Plant Cell,22:3634-3649.
Li Q F,He J X.2016.BZR1 interacts with HY5 to mediate brassinosteroid-and light-regulated cotyledon opening inArabidopsisin darkness. Molecular Plant,9:113-125.
Li Z,Zhang L,Yu Y,Quan R,Zhang Z,Zhang H,Huang R.2011.The ethylene response factor AtERF11 that is transcriptionally modulated by the bZIP transcription factor HY5 is a crucial repressor for ethylene biosynthesis inArabidopsis.The Plant Journal,68:88-99.
Lillo C.2008.Signalling cascades integrating light-enhanced nitrate metabolism.Biochemical Journal,415:11-19.
Lin-Wang K U I,Micheletti D,Palmer J,Volz R,Lozano L,Espley R,Iglesias I.2011.High temperature reduces apple fruit colour via modulation of the anthocyanin regulatory complex.Plant,Cell & Environment,34:1176-1190.
Mori K,Goto-Yamamoto N,Kitayama M,Hashizume K.2007.Loss of anthocyanins in red-wine grape under high temperature.Journal of Experimental Botany,58:1935-1945.
Movahed N,Pastore C,Cellini A,Allegro G,Valentini G,Zenoni S,Filippetti I.2016.The grapevineVviPrx31peroxidase as a candidate gene involved in anthocyanin degradation in ripening berries under high temperature.Journal of Plant Research,129:513-526.
Nakashima K,Yamaguchi-Shinozaki K.2013.ABA signaling in stress-response and seed development.Plant Cell Reports,32:959-970.
Osterlund M T,Hardtke C S,Wei N,Deng X W.2000.Targeted destabilization of HY5 during light-regulated development ofArabidopsis.Nature,405:462-466.
Oyama T,Shimura Y,Okada K.1997.TheArabidopsisHY5gene encodes a bZIP protein that regulates stimulus-induced development of root and hypocotyl.Genes & Development,11:2983-2995.
Pastore C,Dal Santo S,Zenoni S,Movahed N,Allegro G,Valentini G,Tornielli G B.2017.Whole plant temperature manipulation affects flavonoid metabolism and the transcriptome of grapevine berries.Frontiers in Plant Science,8:929-936.
Shi Q M,Yang X,Song L,Xue H W.2011.ArabidopsisMSBP1is activated by HY5 and HYH and is involved in photomorphogenesis and brassinosteroid sensitivity regulation.Molecular Plant,4:1092-1104.
Shin J,Park E,Choi G.2007.PIF3 regulates anthocyanin biosynthesis in an HY5-dependent manner with both factors directly binding anthocyanin biosynthetic gene promoters inArabidopsis.The Plant Journal,49:981-994.
Sibout R,Sukumar P,Hettiarachchi C,Holm M,Muday G K,Hardtke C S.2006.Opposite root growth phenotypes ofhy5versushy5 hyhmutants correlate with increased constitutive auxin signaling.PLoS Genetics,2:1898-1911.
Song L,Shi Q M,Yang X H,Xu Z H,Xue H W.2009.Membrane steroid-binding protein 1(MSBP1)negatively regulates brassinosteroid signaling by enhancing the endocytosis of BAK1.Cell Research,19:864-876.
Srivastava A K,Senapati D,Srivastava A,Chakraborty M,Gangappa S N,Chattopadhyay S.2015.Short Hypocotyl in White Light1 interacts with Elongated Hypocotyl5(HY5)and Constitutive Photomorphogenic1(COP1)and promotes COP1-mediated degradation of HY5 duringArabidopsisseedling development.Plant Physiology,169:2922-2934.
Stracke R,Favory J J,Gruber H,Bartelniewoehner L,Bartels S,Binkert M,Ulm R.2010.TheArabidopsisbZIP transcription factor HY5 regulates expression of thePFG1/MYB12gene in response to light and ultraviolet-B radiation.Plant,Cell &Environment,33:88-103.
Sun Y,Fan X Y,Cao D M,Tang W,He K,Zhu J Y,Patil S.2010.Integration of brassinosteroid signal transduction with the transcription network for plant growth regulation inArabidopsis.Developmental Cell,19:765-777.
Toledo-Ortiz G,Johansson H,Lee K P,Bou-Torrent J,Stewart K,Steel G,Halliday K J.2014.The HY5-PIF regulatory module coordinates light and temperature control of photosynthetic gene transcription.PLoS Genetics,10:e1004416.
van Gelderen K,Kang C,Paalman R,Keuskamp D H,Hayes S,Pierik R.2018.Far-red light detection in the shoot regulates lateral root development through the HY5 transcription factor.The Plant Cell,tpc-00771.
Weller M,Felsberg J,Hartmann C,Berger H,Steinbach J P,Schramm J,Heese O.2009.Molecular predictors of progression-free and overall survival in patients with newly diagnosed glioblastoma:a prospective translational study of the German Glioma Network.Journal of Clinical Oncology,27:5743-5750.
Yang X H,Xu Z H,Xue H W.2005.Arabidopsismembrane steroid binding protein 1 is involved in inhibition of cell elongation.The Plant Cell,17:116-131.
Yoon M K,Shin J,Choi G,Choi B S.2006.Intrinsically unstructured N-terminal domain of bZIP transcription factor HY5. Proteins:Structure,Function,and Bioinformatics,65:856-866.
Yu Y,Wang J,Zhang Z,Quan R,Zhang H,Deng X W,Huang R.2013.Ethylene promotes hypocotyl growth and HY5 degradation by enhancing the movement of COP1 to the nucleus in the light.PLoS Genetics,9:e1004025.
Yu Y,Huang R.2017.Integration of ethylene and light signaling affects hypocotyl growth inArabidopsis.Frontiers in Plant Science,8:doi:10.3389/fpls.2017.00057.
Zhang Y,Zheng S,Liu Z,Wang L,Bi Y.2011.Both HY5 and HYH are necessary regulators for low temperature-induced anthocyanin accumulation inArabidopsisseedlings.Journal of Plant Physiology,168:367-374.
Zhang Y,Li C,Zhang J,Wang J,Yang J,Lyu Y,Wang G.2017.Dissection ofHY5/HYHexpression inArabidopsisreveals a rootautonomous HY5-mediated photomorphogenic pathway.PLoS One,12:e0180449.
