温度对临沧铁壳麦种子生活力、发芽期α-淀粉酶活性及其基因表达的影响
2018-05-04周国雁隆文杰雷涌涛伍少云
周国雁,隆文杰,雷涌涛,陈 丹,蔡 青,伍少云
(云南省农业科学院生物技术与种质资源研究所/云南省农业生物技术重点实验室/农业部西南作物基因资源与种质创制重点实验室,云南昆明650205)
α-淀粉酶活性决定了种子萌发、淀粉降解和收获前发芽(pre-harvest sprouting,PHS)的水平[1]。迟熟α-淀粉酶(late maturity a-amylase,LMA)是一种在籽粒成熟中后期合成的具有高等电点(isoelectric poin,PI)的α-淀粉酶,在一些文献中也作熟前α-淀粉酶(pre-maturity a-amylase,PMA)[2-4]提及,是影响小麦加工品质和收获前发芽的主要因素[2]。
小麦主要有3类α-淀粉酶同工酶[5]。第1类为TaAMY1[6]、AMY-1[1,7]或α-淀粉酶-1,由第6部分同源染色体长臂(6AL/BL/DL)的 amy1等位基因控制[1,7-8],具有pH 6.3~7.5的高等电点[7,9],主要存在于胚乳内,在籽粒发芽前1~2 d开始表达[1],也因此被称为麦芽α-淀粉酶[7]。其活性约占发芽小麦籽粒总α-淀粉酶活性的84%[9]。第2类为TaAMY2[6]、AMY-2[1,7]或α-淀粉酶-2,存在于籽粒发育早期阶段的果皮中,也因此被称为发育或绿色α-淀粉酶[8],由第7部分同源染色体长臂(7AL/BL/DL)的 amy2基因支配[1,7-8],具有pH4.9~6.0的低等电点,在发芽期的第3天[1]或第5~6天[10]开始表达,对α-淀粉酶-1起辅助作用。这两类是遗传和功能已比较清楚、被广泛描述的主要类型[6]。第3类是TaAMY3[6],出现在籽粒发育的全过程,由第5染色体编码,但对籽粒发芽的作用尚不清楚[10]。谷物籽粒的α-淀粉同工酶活性由环境、遗传因子以及二者的相互作用共同影响[8]。在环境因子中,温度的影响可能是最大且有害的[8]。在低温缓慢干燥条件下,温度仅能提高收获前即将成熟小麦的籽粒α-淀粉酶含量,而生理成熟(physiological maturity,PM)后高温可降低小麦籽粒的α-淀粉酶活性[11]。温度也能强烈地影响小麦籽粒萌发过程中α-淀粉酶活性及其基因的相对表达量[12],即α-淀粉酶活性和其基因表达量不仅与籽粒发芽时的温度呈正相关,而且发芽小麦籽粒的α-淀粉酶活性还与籽粒发芽率呈显著或极显著正相关[13-14]。
临沧铁壳麦是隶属云南小麦亚种(Triticumaestivumssp.yunnanense)的一个原始农家品种,具有典型云南小麦亚种的断穗、带壳或包壳特征,可能还带有强休眠和穗发芽抗性[15]基因,是改良和提高现代小麦生产品种穗发芽抗性的重要优质基因资源。因此,本研究采用实时定量PCR技术,研究经不同温度贮藏后,临沧铁壳麦发芽期的α-淀粉酶活性及其编码基因表达量与贮藏温度、贮藏时间及生活力指标间的关系,可为有效保存、保护和再利用该小麦种质资源提供酶学参考依据。
1 材料与方法
1.1 植物种子及贮藏处理
试验用植物种子为2005年繁殖、2006年1月保存于-7.5±2.5 ℃低温种质库的临沧铁壳麦种子。其入库时种子量约300 g,发芽率达97%。该试验材料为云南小麦亚种内的农家品种,于20世纪70年末80年代初期考察收集于云南省原临沧地区临沧县(现临沧市临翔区),穗部特征为颖壳无毛、无芒、白壳、红粒,在云南省的保存编号为云0006,国家统一保存编号则为XM0927。2016年1月初从种质库中取出已贮藏10年左右的临沧铁壳麦种子,用电子天平将其平均分成25份,每份约12 g,密封于10 cm×15 cm的铝泊袋,并保留少量种子用于检测其出库时的发芽率(随后测得为91%)。然后,将分装好的种子分别贮藏在低温1(LT1,-7.5±2.5 ℃,低温种质库)、低温2(LT2,7.5±2.5 ℃,低温种质库)、室内温度(AT,木质柜)和高温(HT,40±1 ℃,恒温箱)4种温度条件下。但是,由于保持在低温环境下的种子在短时间内的生活力变化会很小,因此只在AT、LT1和LT2三种温度条件下各放置5袋种子,而将另外10袋种子暂留在温度LT1的种质库内保存至高温贮藏试验开始。高温贮藏试验(2016年7月11日)开始时,将存放于LT1温度下的10袋种子转移至温度HT的恒温箱内贮藏。
1.2 种子生活力指标测定
按照农作物种子检验规程(GB/T3543-1995)和贮藏种子的不同温度对贮藏后的种子进行定期发芽试验,以观测其生活力的变化。其中,贮藏在HT条件下的种子每7 d一次,贮藏在其他3种温度条件下的种子每2或3月1次。每次发芽试验用1袋种子,重复4次,每100粒种子为1次重复。种子在20±1 ℃光照培养箱内暗培养7 d,每天10:00 前记录前一天发芽种子粒数,发芽试验结束时,每个重复随机测量10苗的苗高(芽长+根长,cm)。计算发芽势(3 d内的发芽种子数/N×100%)、发芽率(7 d内的发芽种子数/N×100%)、发芽指数[GI=∑(Gi/Di)]、发芽速率(GR=[(7×N1+ 6 ×N2+ … + 1×N7)/(7 ×N)][16-17]和活力指数(VI=GI×S)5项生活力指标。式中,N为参试种子总数,Gi为第Di天发芽的种子数,i=1、2、3…7,N1、N2、N3…N7为第1、2、3…7天发芽的种子数,S为平均苗高。
1.3 α-淀粉酶液提取与活性测定
1.3.1 α-淀粉酶液提取
取上述发芽7 d的种子,吸干表面水分,摘除根芽,称取1 g,置于研钵内,加2 mL蒸馏水,研磨至匀浆,然后转入离心管,4 000 r·min-1离心10 min。取上清液,用蒸馏水定容至25 mL。
1.3.2 麦芽糖含量测定
由于发芽试验设置的发芽时间不同,因此在测定α-淀粉酶活性时需根据发芽种子批次单独配制麦芽糖标准溶液,并据此计算溶液的吸光值和麦芽糖含量,为每批发芽种子建立共享的吸光度(y)与麦芽糖含量(x)的线性回归方程。然后,再以此回归方程计算出待测样品的实际麦芽糖含量,并用其估算待测样品的α-淀粉酶活性。因此,试验期间共获得6个方程:
y1=-0.021+0.265x(R2=0.995,P=0.006<0.01)
y2=-0.032+0.306x(R2=0.987,P=0.000<0.01)
y3=-0.021+0.283x(R2=0.997,P=0.000<0.01)
y4=-0.025+0.288x(R2=0.995,P=0.000<0.01)
y5=-0.027+0.276x(R2=0.994,P=0.007<0.01)
y6=-0.035+0.290x(R2=0.991,P=0.000<0.01)
1.3.3 α-淀粉酶活性测定
采用3, 5-二硝基水杨酸法测定α-淀粉酶活性。向4支试管(其中1支为对照,另3支为待测)各加入α-淀粉酶原液1 mL,70 ℃水浴15 min,取出用流水迅速冷却;每管加入pH5.60的柠檬酸缓冲液1 mL,并向对照管加入0.4 mol·L-1氢氧化钠溶液4 mL,各管均于40 ℃水浴15 min;每管都加入经40 ℃预热的1%淀粉溶液2 mL,摇匀,并立即放进40 ℃恒温水浴5 min;迅速向每管中加入0.4 mol·L-1的氢氧化钠溶液4 mL;分别取每管中的酶促反应液2 mL转至25 mL试管,并加入3,5-二硝基水杨酸2 mL,沸水浴5 min。取出冷却,以蒸馏水稀释至25 mL,通过紫外分光光度计测量520 nm的吸光值。
待测样品的吸光值为其实测值与对照样品的实测值之差(A)。将A值代入上述各回归方程,求得各待测样品的实际麦芽糖含量。
将每克样品孵化5 min后降解产生1 mg麦芽糖作为1单位的α-淀粉酶活性。即待测样品α-淀粉酶活力(mg·g-1)=通过回归方程求得的麦芽糖含量(mg)×淀粉酶原液总体积(mL)/样品重(g)×5 min×显色用酶液体积(mL)。
1.4 α-淀粉酶基因实时定量PCR检测
1.4.1 RNA的提取与反转录
取上述发芽的麦苗幼叶提取RNA。总RNA的提取按照宝生物工程(大连)有限公司(TaKaRa)的试剂盒(TaKaRaMiniBEST Universal RNA Extraction Kit)使用指南操作。cDNA合成则按该公司的反转录试剂盒PrimeScriptTmⅡ 1st Strand cDNA Synthesis Kit使用说明操作,反转录后的cDNA于-20 ℃冰箱保存备用。
1.4.2 定量PCR引物筛选
为研究临沧铁壳麦种子发芽期的α-淀粉酶基因的相对表达量,对已报道[1,8,12]的目标基因 amy1-2、 amy1和 amy2及其内参基因actin、 α-Tubulin等引物,以及周飞[18]设计的引物,共12对引物(表1)进行筛选,最终筛选出用于临沧铁壳麦α-淀粉酶基因表达研究的PCR引物:内参基因为小麦actin基因[19]的引物,目标基因 amy1的引物为amy1-RT, amy3的引物为AMY-2[18](由于引物AMY-2的序列是根据GenBank编号x05809.1的α-淀粉酶基因序列设计的,而这个编号在https://www.ncbi.nlm.nih.gov/nuccore/x05809.1中对应的α-淀粉酶基因是 amy3,所以,由AMY-2检测到的结果是基因 amy3的相对表达量)。
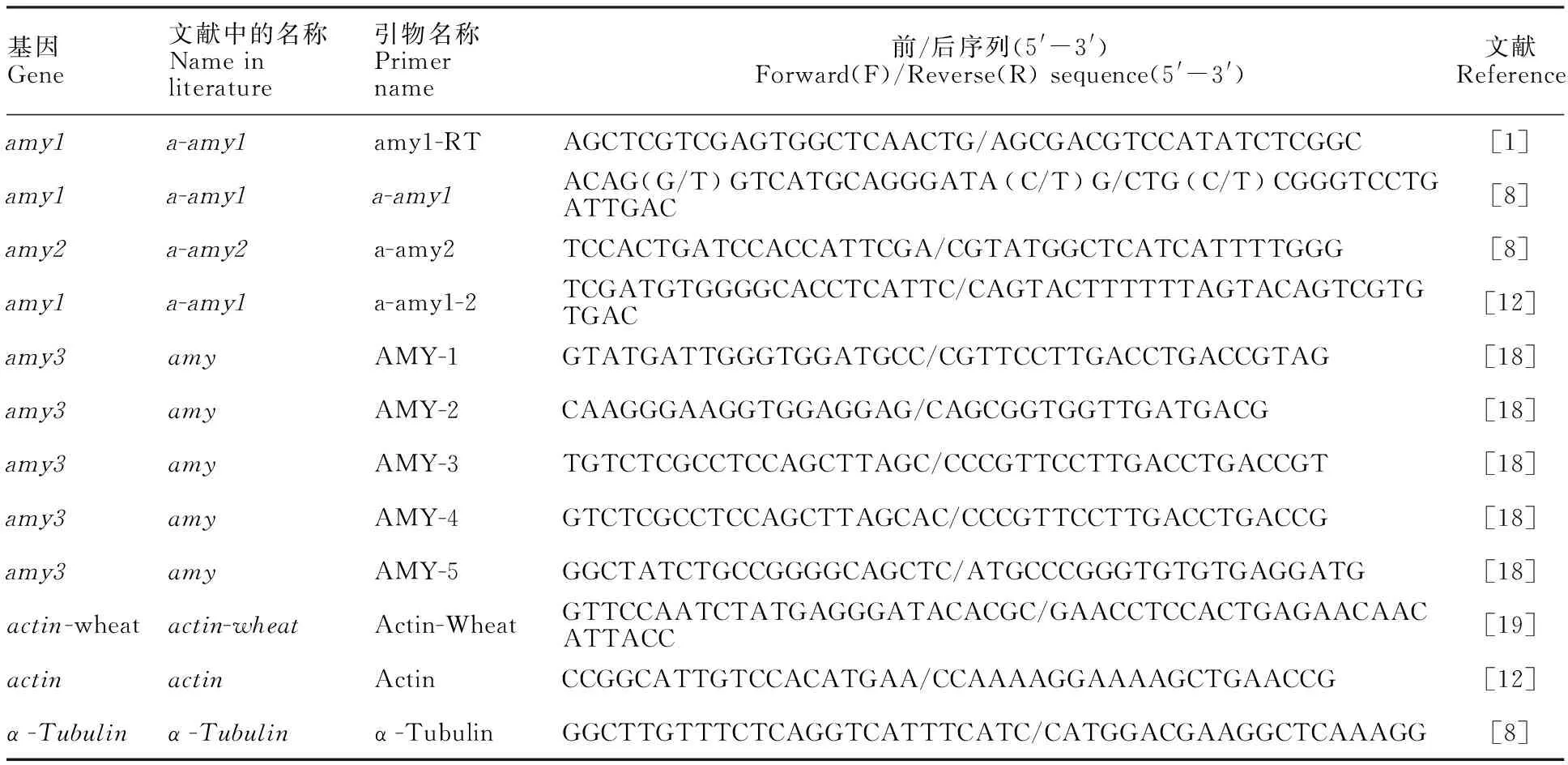
表1 用于研究小麦α-淀粉酶基因表达量的引物和序列Table 1 Primers and their sequences used for expression analysis of a-amylase gene in wheat
1.4.3 定量PCR扩增
反应采用宝生物工程(大连)有限公司的试剂盒[SYBR○RPremix Ex TaqTM(TIiRNaseH Plus)]。反应体系20 μL:SYBR○RPremixExTaq(TIiRNaseH Plus)(2×)10 μL,PCR Forward Primer(10 μmol·L-1) 0.4 μL,PCR Reverse Primer(10 μmol·L-1) 0.4 μL,ROX Reference DyeⅡ(50×)0.4 μL,DNA模板2 μL,ddH2O 6.8 μL。PCR扩增程序:95 ℃预变性30 s;95 ℃ 5 s,40个循环;60 ℃ 34 s。
1.5 数据处理
α -淀粉酶基因相对表达量2-△Ct和2-△△Ct值按文献[20]的方法计算。采用IBM SPSS statistics 19统计软件的单因素方差和双变量相关分析进行相关数据的差异显著性分析与检验。
2 结果与分析
2.1 种子生活力随贮藏温度和时间的变化
种子生活力指标(如发芽势和发芽率等)随种子贮藏温度的升高和贮藏时间的延长而降低,种子逐步死亡。但在不同贮藏温度下,种子生活力的下降速度明显不同(表2)。在LT1和LT2条件下,5项生活力指标虽然都有随贮藏时间的延长而逐渐降低的趋势,但在63、189、252和365 d 4个贮藏时间段间的变化均不明显(F=0.393~2.555,P=0.128~0.761)。在AT条件下,除发芽势在不同贮藏时段间的变化达到极显著差异(F=7.675,P=0.004<0.01)外,其他4项指标的变化均不明显(F=1.335~2.056,P=0.162~0.323)。但是,在HT条件下,发芽率在7、14、21、28、35、42、49、56、63和70 d 10个贮藏时段间的差异都达到了显著水平(F=2. 727,P=0.029<0.05),而另外4项指标则都达到了极显著水平(F=3.887~7.308,P=0.000~0.005<0.01)。由此说明,贮藏种子的温度越高,生活力指标下降越快,种子保持高生活力的贮藏时间也越短。
2.2 α-淀粉酶活性随种子贮藏温度和时间的变化
由图1可知,在相同贮藏时间内,除第1贮藏阶段(63 d)种子的α-淀粉酶活性在LT1、LT2和AT3处理间的差异不明显外(P>0.05),另外3个阶段(189、252和365 d)α-淀粉酶活性至少在2种处理间存在显著差异(P<0.05);除第4阶段(365 d)外,其他3个阶段的α-淀粉酶活性随种子贮藏温度的升高呈逐步上升的趋势。在相同的贮藏温度下,低温贮藏条件下种子的α-淀粉酶活性有随贮藏时间延长而逐渐升高的趋势;在AT条件下贮藏至第3阶段(252 d),或在LT1、LT2条件下贮藏至第4阶段(365 d)的种子,其α-淀粉酶活性较前几个贮藏时期有显著升高;而贮藏在HT条件下的种子α-淀粉酶活性随贮藏时间延长呈由高至低的显著下降,且在贮藏至42 d及以后趋于稳定。与在LT1 、LT2和AT条件下贮藏至第2阶段(189 d,2016年1月初至7月11日,此日为高温贮藏试验起始日)及第3阶段(252 d,2016年1月初至2016年9月12日,此日为高温贮藏试验结束日)的种子相比,在HT温度条件下贮藏7~70 d的种子,其α-淀粉酶活性大都出现了显著或极显著(P<0.01)地上升,尤其是贮藏7~28 d的种子,其α-淀粉酶活性与贮藏在另外3种温度条件下的第2、第3阶段的种子的α-淀粉酶活性的差值达到4.239~12.810 mg·g-1。

表2 不同贮藏温度和时间下临沧铁壳麦种子的生活力指标Table 2 Viability indices of Lincang hulled wheat seed stored at different temperature and time
LT1:低温1(-7.5±2.5 ℃);LT2:低温2(7.5±2.5 ℃);AT:室内温度;HT:高温(40±1 ℃)。下同。
LT1:Low temperature(-7.5±2.5 ℃); LT2:Low temperature 2(7.5±2.5 ℃); AT:Ambient temperature; HT:High temperature(40±1 ℃). The same in other tables.
2.3 α-淀粉酶基因相对表达量(2-△△Ct )随种子贮藏温度和时间的变化
以贮藏在LT1条件下种子的相对表达量为对照。在第1贮藏阶段,贮藏在LT2和AT条件下的种子发芽期 amy1基因的表达量只达到对照的43.8%和16.7%,极显著降低;在第2贮藏阶段(189 d),分别相当于对照的148.9%和299.0%,极显著地升高;但在第3阶段(252 d),又分别相当于对照的60.9%和110.4%,表现为极显著下降或不明显升高;在第4阶段(365 d),相当于对照的131.2%和95.8%,上升或下降幅度差异不明显。因此,与贮藏在LT1条件下的种子相比,贮藏在LT2和AT条件下种子的 amy1基因表现为贮藏开始时极显著下调表达、贮藏中期极显著上调表达、贮藏后期不明显上调或下调表达。但是, amy3基因的相对表达量,在4个贮藏阶段均表现为不明显地下降,相当于对照的53.5%~88.2%。由图2可知,若以第1贮藏阶段种子的相对表达量为对照,则贮藏在低温(LT1和LT2)下的种子,其发芽期 amy1基因的相对表达量随贮藏时间的延长而呈极显著下调表达,分别相当于对照的15.0%~26.2%和41.2%~70.5%。但是,在室温及高温贮藏条件下,随贮藏时间的增加表现为开始时极显著上调表达,然后再显著或不显著地下调表达,分别相当于对照的96.1%~372.8%和93%~238%。由图3可知,与 amy1基因的表达行为相反,在室温及低温(LT1和LT2)下贮藏的种子,其发芽期 amy3基因的相对表达量随贮藏时间的推移先呈不显著或极显著上调表达,然后再显著或不显著地下降,分别相当于各自对照(第1贮藏阶段的种子的相对表达量)的1.11%~104.2%、72.9%~190.6%和1.5%~161.7%。在HT条件下,则表现为不显著或显著下调表达,相当于对照表达量的53%~81%。
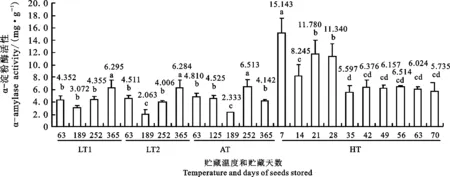
LT1:低温1(-7.5±2.5 ℃);LT2:低温2(7.5±2.5 ℃);AT:室内温度;HT:高温(40 ℃±1 ℃)。横坐标上的数字为储藏天数。在同一贮藏温度内,图注上不同字母表示在0.05水平上有显著差异。
LT1:Low temperature 1(-7.5±2.5 ℃);LT2:Low temperature 2(7.5±2.5 ℃);AT:Ambient temperature in Kunming;HT:High temperature(40 ℃±1 ℃). The digital on x-axis is days of seed stored. The different letters on the chart indicate significant differences at 0.05 levels in the same storage temperature.
图1临沧铁壳麦种子发芽期α-淀粉酶活性随贮藏种子的温度和时间的变化
Fig.1Changesofα-amylaseactivityatgerminationstageinLincanghulledwheatseedswiththeincreaseofstoragetemperatureandtime
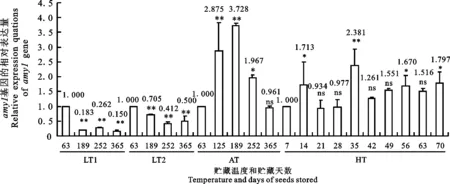
LT1:低温1(-7.5±2.5 ℃);LT2:低温2(7.5±2.5 ℃);AT:室内温度;HT:高温(40 ℃±1 ℃)。横坐标上的数字为储藏天数。*和**表示在同一贮藏温度内不同贮藏期种子的 amy1基因相对表达量与对照(数值为1.000)间的差异分别达到0.05和0.01的显著水平。图3同。
LT1:Low temperature 1(-7.5±2.5 ℃);LT2:Low temperature 2(7.5±2.5 ℃);AT:Ambient temperature in Kunming;HT:High temperature(40 ℃±1 ℃). The digital on x-axis is days of seed stored. * and ** showed that differences between relative expression quantitation(REQ) of amy1 gene during storage marked within same temperature and REQ of control(1.000) are significant at 0.05 and 0.01 levels, respectively.The same in figure 3.
图2amy1基因的相对表达量随贮藏种子的温度和时间的变化
Fig.2Changesofrelativeexpressionquantitationofamy1withtheincreaseofseedstoragetemperatureandtime
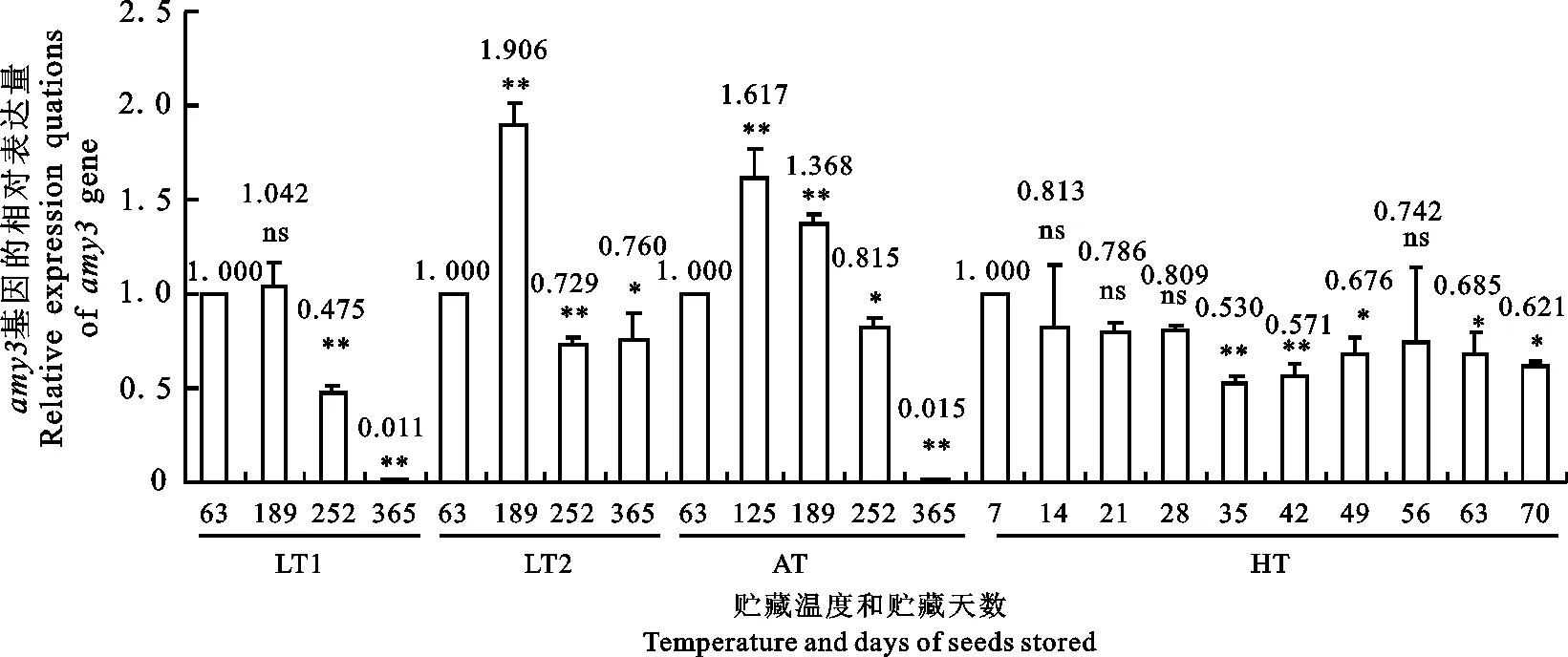
图3 amy3基因的相对表达量随贮藏种子的温度和时间的变化
与在LT1和LT2温度下贮藏189 d种子的相对表达量相比,贮藏在高温条件种子的 amy1基因表现为不显著、显著或极显著地上调表达,相当于对照的107.5%~274.1%和72.2%~184.1%。但与在AT条件下贮藏189 d的种子相比,则呈极显著、显著或不显著地下调表达,为对照的36.0%~91.7%。同样,与在LT1、LT2和AT温度下贮藏189 d的种子相比,贮藏在HT温度下的种子,其 amy3基因表现为不显著、显著或极显著下调表达,为对照的44.4%~84.6%、50.4%~96%和53.6%~102.1%。
2.4 a-淀粉酶活性及基因相对表达量(2-△Ct )与种子贮藏时间及生活力指标间的相关性
由表3可知,随着种子贮藏温度的提高,有显著相关性的观测性状或指标的数目也随之增多,但生活力指标间的显著相关性始终都是主要的。α-淀粉酶活性及基因相对表达量与种子的贮藏时间、生活力间的显著或极显著相关性,在不同的贮藏温度间表现不同。在低温条件下,无论是贮藏时间还是α-淀粉酶活性及其基因相对表达量与生活力指标间均无明显相关性,仅α-淀粉酶活性与 amy3基因的相对表达量间存在极显著(r=-0.769)或显著(r=-0.670)负相关,以及贮藏时间与 amy1(r= -0.823和r= -0.646)、 amy3(r=-0.889)基因的相对表达量间存在显著或极显著负相关。在室温和高温条件下,贮藏时间、α-淀粉酶活性及其基因相对表达量不仅与生活力指标间有显著相关关系,而且α-淀粉酶活性同其基因相对表达量间的相关性也发生了改变,由低温条件下与 amy3基因相对表达量呈极显著或显著负相关转变为与 amy3基因相对表达量呈极显著(r=0.570)正相关、与 amy1基因相对表达量呈显著(r=-0.543)或极显著(r=-0.568)负相关;另外,贮藏时间与生活力指标(r=-0.487~-0.559)、 amy3基因的相对表达量(r=-0.770和-0.436)及α-淀粉酶活性(r=-0.729)呈显著和极显著负相关。
另外,在室温条件下,仅发芽率与 amy3基因相对表达量(r= 0.543)呈显著相关性。而高温条件下,除发芽率与α-淀粉酶活性和 amy3基因相对表达量呈显著或极显著正相关外,其他4项生活力指标也均与这2个观测指标呈显著或极显著正相关。值得注意的是,无论在室温还是高温条件下,生活力指标都只与 amy3基因而不是 amy1基因的相对表达量有显著相关性。

表3 不同贮藏温度下相关系数达到显著或极显著水平的指标Table 3 Correlation coefficients reaching the significant level among observationindices of seeds stored at different storage temperature
括号内的数字为相关系数;*和**分别表示达到0.05和0.01的显著水平。
The number in brackets are correlation coefficients; * and ** mean significant at 0.05 and 0.01 levels, respectively.
3 讨 论
在昆明的气候条件下,密封贮藏在室温及低温(-7.5±2.5 ℃和7.5 ℃±2.5 ℃)种质库的临沧铁壳麦种子,发芽期α-淀粉酶活性有随种子贮藏温度升高和贮藏时间延长而逐步升高的趋势,与其他小麦种子随萌发时间的延长而升高[12,21]的结果一致。而贮藏在高温(40±1 ℃)条件下的种子,发芽期α-淀粉酶活性虽然随贮藏时间的延长显著下降,并在贮藏至42 d后趋于稳定,但仍明显地高于贮藏在低温条件下的种子,高1.242~13.080 mg·g-1。因此,高温贮藏处理明显提升了临沧铁壳麦种子发芽期的α-淀粉酶活性,与朱美荣[22]利用昼35 ℃和夜27 ℃处理小麦种子7 d获得的结果相似。
近年来的研究表明,α-淀粉酶基因的表达与转录,除受到脱落酸(ABA)、赤霉素(GA)、油菜素内酯(BR)和乙烯(ETH)等多种内源激素及ABA/GAs的调控[23-25]外,也明显与种子萌发过程中的温度有关[12]。本研究中,贮藏在高温条件下种子的 amy1基因表达量明显高于贮藏在低温(LT1和LT2)条件下189 d的种子,为LT1下的107.5%~274.1%和LT2下的72.2%~184.1%;而同样贮藏在高温条件下的种子,其 amy3基因表达量则仅分别相当于在LT1、LT2和AT温度条件下贮藏189 d种子的44.4%~84.6%、50.4%~96%和53.6%~102.1%。因此,温度对 amy1和 amy3基因表达量的影响可能是不同的。高温显著提高 amy1基因的表达量,而显著地降低 amy3基因的表达量。说明相同的种子贮藏温度能明显影响种子萌发过程中不同的α-淀粉酶基因的表达。但是,由于未筛选到用于研究 amy2基因相对表达量的PCR引物,因此,有关临沧铁壳麦或云南小麦亚种 amy2基因的相对表达量随种子贮藏温度、贮藏时间的变化,以及与生活力指标之间的相关性,有待进一步研究。
贮藏在低温条件下种子的α-淀粉酶活性与 amy3基因的相对表达量呈极显著、显著负相关,而贮藏在高温条件下种子的α-淀粉酶活性又与 amy3基因相对表达量呈极显著正相关的关系,说明 amy3基因在高温和低温条件下的表达机制可能不同。另外,周 飞[18]设计的5对引物扩增小麦品种川农24和川农27的cDNA,只有第1对引物(AMY-1)获得了1条约1 300 bp的清晰条带,未获得引物AMY-2的扩增条带,而在本研究选用的小麦临沧铁壳麦中,仅引物AMY-2(而非AMY-1)获得了清晰条带,并且其扩增曲线和熔解曲线与内参基因扩增引物获得的结果一致。所以,临沧铁壳麦种子发芽期的 amy3基因可能与川农24和川农27的有一定差异。
本研究中贮藏在低温条件下种子的生活力指标与贮藏时间、α-淀粉酶活性及其基因相对表达之间无明显相关性,而贮藏在高温条件种子的生活力指标均与贮藏时间、α-淀粉酶活性及其 amy3基因的相对表达量呈显著或极显著相关性,表明随着贮藏温度逐渐升高,种子生活力与贮藏时间、α-淀粉酶活性及其基因相对表达量间的关系也由不显著变为显著或极显著,由不紧密变为非常紧密,即高温提升种子生活力与贮藏时间、α-淀粉酶活性及基因表达量间的相关性。
参考文献:
[1]YANG J,LIU Y,PU Z,etal.Molecular characterization of high pia-amylase and its expression QTL analysis in synthetic wheat RILs [J].MolecularBreeding,2014,34(3):1075.
[2] KONDHARE K R,FARRELL A D,KETTLEWELL P S,etal.Pre-maturity α-amylase in wheat:The role of abscisic acid and gibberellins [J].JournalofCerealScience,2015,63:95.
[3]KONDHARE K R,KETTLEWELL P S,FARRELL A D,etal.Effects of exogenous abscisic acid and gibberellic acid on pre-maturity α-amylase formation in wheat grains [J].Euphytica,2012(188):51.
[4]LUNN G D,MAJOR B J,KETTLEWELL P S,etal.Mechanisms leading to excess α-amylase activity in wheat(TriticumaestivumL.) grain in the UK [J].JournalofCerealScience,2001(33):314.
[5]BARRERO J M,MRVA K,TALBOT M J,etal.Genetic,hormonal,and physiological analysis of late maturity α-amylase in wheat [J].PlantPhysiology,2013(161):1265.
[6]RAL J P,WHAN A,LARROQUE O,etal.Engineering high α-amylase levels in wheat grain lowers falling number but improves baking properties [J].PlantBiotechnologyJournal,2016,14(1):364.
[7]CHENG C,OLDACH K,MRVA K,etal.Analysis of high pI α-A-amy-1 gene family members expressed in late maturity a-amylase in wheat(TriticumaestivumL.) [J].MolecularBreeding,2014,33(3):519.
[8]DE LAETHAUWER S,DE RIEK J,STALS I,etal.α-amylase gene expression during kernel development in relation to pre-harvest sprouting in wheat and triticale [J].ActaPhysiologiaePlantarum,2013,35(10):2928.
[9] 肖世和,陈 孝,徐慧君,等.大麦α-淀粉酶抑制基因对小麦α-淀粉酶的抑制作用研究 [J].作物学报,1998,24(6):763.
XIAO S H,CHEN X,XU H J,etal.Studies on effect of α-amylase inhibitor gene from barley on the a-amylase activity in wheat [J].ActaAgronomicaSinica,1998,24(6):763.
[10] 朱美荣,张如标,王蓓蓓,等.小麦穗发芽生理及调控途径研究进展 [J].金陵科技学院学报,2010,26(2):50.
ZHU M R,ZHANG R B,WANG B B,etal.Wheat pre-harvest sprouting physiology and control approaches [J].JournalofJinlingInstituteofTechnology,2010,26(2):50.
[11]DELAETHAUWER S,DERIEK J,STALS I,etal.α-amylase gene expression during kernel development in relation to pre-harvest sprouting in wheat and triticale [J].ActaPhysiologiaePlantarum,2013,35(10):2928.
[12] 刘 美,张 凤,杨翠翠,等.小麦种子萌发早期淀粉降解关键酶活性及基因表达量研究 [J].山东农业科学,2014(9):39.
LIU M,ZHANG F,YANG C C,etal.Study on key starch degrading enzyme activity and related gene expression level during early germination stage of wheat seed [J].ShandongAgriculturalSciences,2014(9):39.
[13] 张海峰,卢荣禾.小麦穗发芽抗性机理与遗传研究 [J].作物学报,1993,19(6):528.
ZHANG H F,LU R H.Study on the mechanism of the resistance to pre-harvest sprouting and inheritance inwheat [J].ActaAgronomicaSinica,1993,19(6):528.
[14] 晏本菊.中国西南麦区普通小麦(TriticumaestivumL.)优质育种的生化遗传基础研究[D].雅安:四川农业大学,2004:56.
YAN B J.Study on biochemical and genetic basis of quality breeding in common wheat(TriticumaestivumL.) in Southwest China [D].Ya’an:Sichuan Agricultural University,2004:56
[15] 杨金华,于亚雄,程加省,等.云南铁壳麦穗发芽抗性及成因初步研究 [J].麦类作物学报,2011,31(4):747.
YANG J H,YU Y X,CHENG J S,etal.Study on the pre-harvest sprouting tolerance inTriticumaestivumssp.Yunnanenseking [J].JournalofTriticeaeCrops,2011,31(4):747.
[16]BARRERO J M,CAVANAGH C,VERBYLA K L,etal.Transcriptomic analysis of wheat near-isogenic lines identifies PM19-A1 and A2 as candidates for a major dormancy QTL [J].GenomeBiology,2015,16(1):14.
[17]ZHANG Y,MIAO X,XIA X,etal.Cloning of seed dormancy genes(TaSdr) associated with tolerance to pre-harvest sprouting in common wheat and development of a functional marker [J].TheoreticalandAppliedGenetics,2014,127(4):857.
[18] 周 飞.小麦种子发芽率的生化遗传机制的初步研究[D].雅安:四川农业大学,2011:21.
ZHOU F.The genetic and biochemical mechanism on seed germination of wheat [D].Ya’an:Sichuan Agricultural University,2011:21.
[19]NIU JS,ZHANG LN,HONG DF,etal.Cloning ,characterization and expression of wheat EDR1(enhanced disease resistance) gene [J].JournalofPlantPhysiologyandMolecularBiology,2005,31(5):478.
[20]LI C Y,ZHANG R Q,FU K Y,etal.Effects of high temperature on starch morphology and the expression of genes related to starch biosynthesis and degradation [J].JournalofCerealScience,2017,73:27.
[21] 万中原,王志欣,杨文思,等.温度和PEG处理对小麦种子萌发期间酶学特性的影响 [J].山东农业科学,2013,45(7):42.
WAN Z Y,WANG Z X,YANG W S,etal.Influences of temperature and peg treatment on enzymatic characteristics during wheat seed germination [J].ShandongAgriculturalSciences,2013,45(7):42.
[22] 朱美荣.贮藏时间和温度对小麦穗粒发芽率与α-淀粉酶活性的影响[D].扬州:扬州大学,2011:1.
ZHU M R.Effects of storage duration and temperature on spike germination,seed germination and the activity of a-amylase [D].Yangzhou:Yangzhou University,2011:1.
[23] 李振华,王建华.种子活力与萌发的生理与分子机制研究进展 [J].中国农业科学,2015(4):648.
LI Z H,WANG J H.Advances in research of physiological and molecular mechanism in seed vigor and germination [J].ScientiaAgriculturaSinica,2015(4):648.
[24] 赖晓辉,李 群.种子休眠与萌发分子机制研究进展 [J].种子,2014(5):54.
LAI X H,LI Q.Molecular mechanisms of seed dormancy and germination progress [J].Seed,2014(5):54.
[25] 刘春华,王 鹏,夏 超,等.种子休眠与萌发相关激素突变体研究进展 [J].作物杂志,2014(3):139.
LIU C H,WANG P,XIA C,etal.Overview of hormone mutants related on seed dormancy and germination [J].Crops,2014(3):139.
