黄淮麦区小麦抗赤霉病新种质的创制和筛选
2018-05-04周淼平姚金保张平平杨学明余桂红马鸿翔
周淼平,姚金保,张平平,张 鹏,杨学明,余桂红,马鸿翔
(江苏省农业科学院粮食作物研究所/江苏省农业生物学重点实验室,江苏南京 210014)
小麦赤霉病(Fusarium head blight,FHB)是发生在温暖湿润地区的世界性病害,主要由禾谷镰刀菌侵染小麦穗部引起。赤霉病造成小麦产量损失严重,一般流行年份可引起5%~10%的产量损失,大流行年份可造成部分田块绝收,而且病麦粒中残留的DON等毒素严重影响小麦的食用和饲用价值,危害食品安全[1-2]。我国长江中下游麦区和东北春麦区为该病害的主要流行区域,20世纪80年代以来,随着全球气候变暖、小麦抽穗至收获季节雨水增多以及秸秆还田和玉米-小麦连茬面积的增加,田间病原菌量增多,小麦赤霉病向黄淮麦区蔓延,并且病害流行日渐频繁,危害程度愈来愈严重,已成为威胁我国黄淮麦区小麦生产安全的常发性重要病害[2-4]。
多年的生产实践证明,培育和使用抗小麦赤霉病品种是预防该病害最经济和环保的手段。培育抗病品种需要抗性稳定的赤霉病抗源提供抗病基因,国内外科研人员经过多年研究,已经筛选到苏麦3号、望水白、Frontana等一批抗病种质材料[5],对苏麦3号、望水白、Ernie和Heyne等抗源的赤霉病抗性主效QTL进行了染色体和遗传连锁图定位[6],并根据精细定位结果克隆了苏麦3号的抗赤霉病主效基因 Fhb1[7]。这些研究成果为今后开展小麦抗赤霉病育种奠定了坚实基础。
国内针对小麦赤霉病的抗病育种始于20世纪70年代,经过数十年的不懈努力,我国长江中下游麦区小麦赤霉病危害已经得到显著缓解,该麦区小麦品种中累积了不少赤霉病抗病基因,培育和推广的小麦品种赤霉病抗性基本达到中感以上。与之相邻的黄淮麦区由于赤霉病危害面积小,育种亲本赤霉病抗病基因匮乏,目前育成和推广的品种绝大多数没有达到中感水平,提高品种以及育种亲本的赤霉病抗性已成为日益急迫的问题[2,4]。将长江中下游麦区小麦赤霉病抗病基因导入黄淮麦区小麦品种以及从黄淮麦区小麦品种中筛选赤霉病抗病新种质是解决这一急迫问题最便捷的两条途径。
本研究以黄淮麦区大面积种植小麦品种济麦22为受体,采用连续回交与分子标记辅助选择相结合的方法将苏麦3号赤霉病抗病主效QTL导入济麦22,培育赤霉病抗性提高且保持济麦22高产、广适优良农艺性状的种质材料;同时对黄淮麦区的品种(系)进行人工接种鉴定,筛选抗赤霉病新种质,以期为培育适合黄淮麦区种植的抗赤霉病小麦品种提供有益帮助。
1 材料与方法
1.1 供试材料
抗赤霉病新种质创制以济麦22为受体,以长江中下游麦区赤霉病重要抗源苏麦3号为抗病基因供体。抗赤霉病新种质筛选共选用564份材料,包括黄淮麦区审定品种85份、国家区域试验黄淮南片区试和预试材料229份、江苏省淮北区域试验区试和预试材料215份以及本研究室育成高代品系35份,抗病性鉴定采用苏麦3号(抗赤霉病)、宁麦13(中抗赤霉病)和安农8455(感赤霉病)作为对照,所有小麦材料均由江苏省农业科学院粮食作物研究所麦类作物研究室保存。抗病性鉴定所用禾谷镰刀菌菌株F0609由江苏省农业科学院植物保护研究所陈怀谷研究员提供。
1.2 抗赤霉病新种质材料的创制
以济麦22为母本与苏麦3号杂交,后代连续与母本济麦22回交,每代均采用与苏麦3号3B染色体上抗赤霉病主效QTL紧密连锁的分子标记Xgwm533和Xgwm493[8]对回交后代进行跟踪筛选,直至BC4,套袋自交,BC4F2后代挑选分子标记Xgwm533和Xgwm493均为纯合的植株,检测 Fhb1基因是否存在,考查其后代农艺性状。杂交与回交的每个世代均对抗赤霉病主效QTL分离后代植株和亲本进行赤霉病抗性鉴定,抗病性鉴定期间弥雾保湿。
1.3 抗赤霉病分子标记和 Fhb1基因的检测
小麦DNA的提取采用叶片作为样品,冷冻干燥后参照Karroten植物基因组DNA提取试剂盒操作手册进行。Xgwm533和Xgwm493分子标记的PCR反应体系:总体积为20 μL,含1× buffer,1.5 mmol·L-1MgCl2,0.2 mmol·L-1dNTPS,0.5 μmol·L-1各类引物,50 ng 模板DNA,1U Tag DNA聚合酶(TaKaRa)。采用touch-down程序进行PCR扩增:94 ℃预变性3 min;94 ℃变性40 s,62~55 ℃复性45 s,每个循环降低1 ℃,72 ℃延伸30 s,8个循环;然后94 ℃变性40 s,55 ℃复性45 s,72 ℃延伸30 s,30个循环;最后72 ℃延伸5 min。扩增产物采用8%非变性聚丙烯酰胺凝胶电泳银染观察或采用3%琼脂糖凝胶电泳溴乙锭染色观察。 Fhb1基因的检测以文献[7]报道的PFT(pore-forming toxin-like)基因序列(GenBank:KX907434.1)为模板,采用Primer 3 Plus(http://www.primer3plus.com/)软件设计引物(序列见表1),PCR反应体系与分子标记检测相同,PCR反应程序:94 ℃预变性5 min;94 ℃变性45 s,55 ℃复性45 s,72 ℃延伸30 s,35个循环;最后72 ℃延伸5 min。扩增产物采用1.5%琼脂糖凝胶电泳分离。
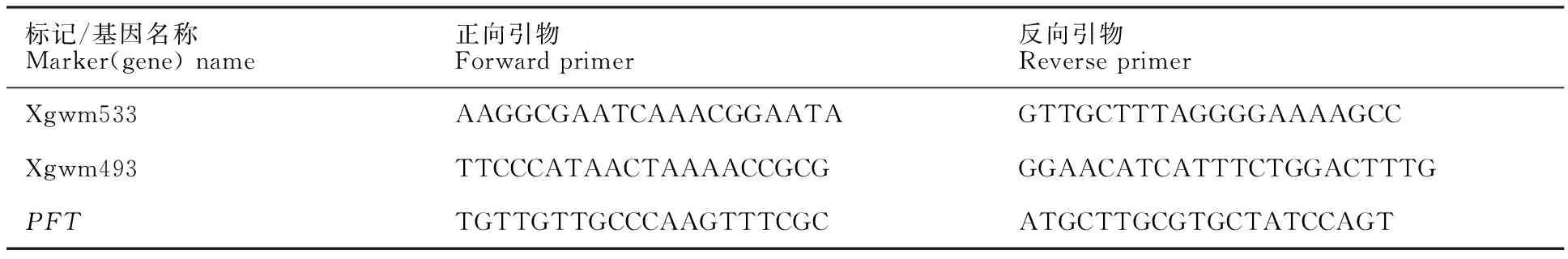
表1 分子标记和 Fhb1基因检测引物Table 1 Primers of molecular markers and Fhb1 gene
1.4 黄淮麦区小麦品种(系)赤霉病抗性鉴定和筛选
小麦赤霉病抗性鉴定和筛选于2014-2016年在江苏省农业科学院本部试验地实施,采用单花滴注的方法进行,调整禾谷镰刀菌孢子液浓度为50 000 个·mL-1,于小麦始花期傍晚接种,选取中上部刚开花小穗,滴加10 μL孢子液,21 d后调查病小穗率,病小穗率=(发病小穗数/总小穗数)×100%。每个品种(系)重复2次,每重复调查10穗。每年病小穗率低于25%的品种(系),下一年继续进行赤霉病抗性鉴定。
2 结果与分析
2.1 苏麦3号抗赤霉病主效QTL向济麦22导入的结果
苏麦3号为春性红皮小麦,其株高和株型均不适合用于黄淮麦区杂交配组,将其抗赤霉病主效QTL导入黄淮麦区主推品种,培育抗赤霉病近等基因系,再进行杂交配组将达到事半功倍的效果。本研究采用济麦22为受体,通过连续回交与分子标记辅助选择相结合的方法将苏麦3号赤霉病抗性主效QTL导入济麦22。由图1可见,由于苏麦3号抗赤霉病主效QTL的导入,杂交F1后代的赤霉病病小穗数较受体亲本有较大幅度减少。统计分析结果表明,从F1到BC4,含有苏麦3号抗赤霉病主效QTL的济麦22衍生系平均病小穗率降低了51.2%,随着回交次数的增加,济麦22的背景不断渗入,回交后代中来源于苏麦3号的微效抗病基因逐渐丢失,其赤霉病抗性也逐渐降低,后代平均病小穗率的减少率由F1的55.3%降低到BC4的31.9%,而从回交后代分离的不含苏麦3号抗赤霉病主效QTL的济麦22衍生系的赤霉病抗性与受体亲本相比,差异不显著,表明主效QTL的抗病作用非常明显(表2)。

1:济麦22;2:苏麦3号;3:F1。
1:Jimai 22; 2:Sumai 3; 3:F1.
图1亲本及F1的赤霉病抗性表现
Fig.1FHBresistanceofparentsandF1progeny
对BC4回交后代分子标记检测呈阳性的植株进行套袋自交,BC4F2采用与苏麦3号赤霉病抗病主效QTL紧密连锁的两侧分子标记Xgwm533和Xgwm493以及报道的 Fhb1候选基因PFT的引物进行PCR扩增检测(图2),筛选获得赤霉病抗病基因纯合的植株,继续繁殖并进行农艺性状的筛选。已经获得十多个赤霉病抗性明显提高的品系,但也发现多数品系的株高较受体亲本济麦22有所增加,表3选列了4个与济麦22株高相仿、株型一致的品系,这些品系的穗长与济麦22相仿或稍有增长,每穗粒数、千粒重和籽粒蛋白质含量变化较大,这些品系将为今后黄淮麦区小麦赤霉病抗性的改良提供帮助。
2.2 黄淮麦区抗赤霉病新种质筛选结果
对本研究室保存的黄淮麦区审定品种、国家区域试验黄淮南片区试和预试材料、江苏省淮北区域试验区试和预试材料以及本研究室育成的高代品系采用人工单花滴注的方法进行赤霉病抗性鉴定,2014年鉴定416份,2015年鉴定148份,2016年继续对平均病小穗率小于25%的材料进行抗性鉴定。由于黄淮麦区品种(系)多不含抗赤霉病基因,在鉴定期间没有采取弥雾保湿措施,自然环境下部分品种的病小穗率仍然高达93.5%。
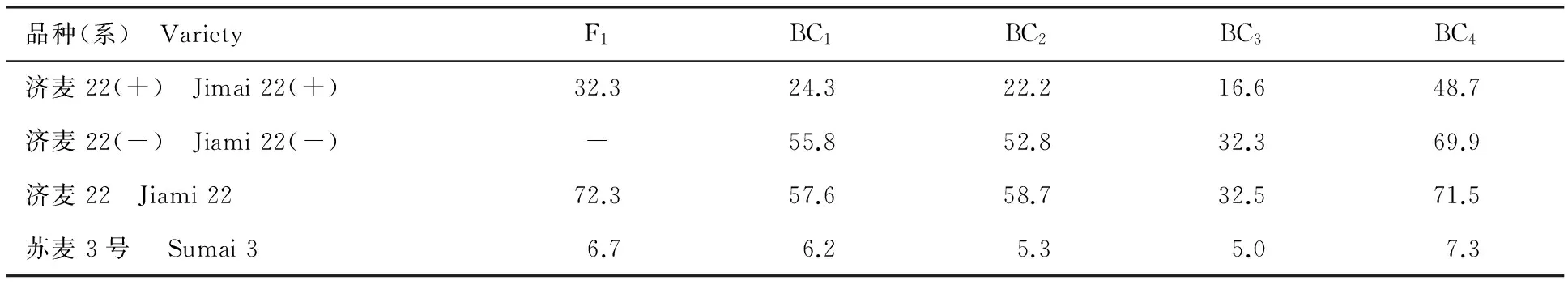
表2 F1及回交不同世代的赤霉病平均病小穗率Table 2 The FHB resistance of lines in F1 and different backcrossing generation (Average percentage of scabbed spikelets) %
+:含有苏麦3号抗赤霉病主效QTL;-:不含苏麦3号抗赤霉病主效QTL。
+:with the major QTL for FHB resistance of Sumai 3; -:without the major QTL for FHB resistance of Sumai 3.

A:Xgwm533;B:Xgwm493;C:PFT。1~15:回交后代;16:苏麦3号;17:济麦22;M:Marker。
A:Xgwm533;B:Xgwm493;C:PFT.1-15:Lines of backcrossing; 16:Sumai 3; 17:Jimai 22; M:Marker.
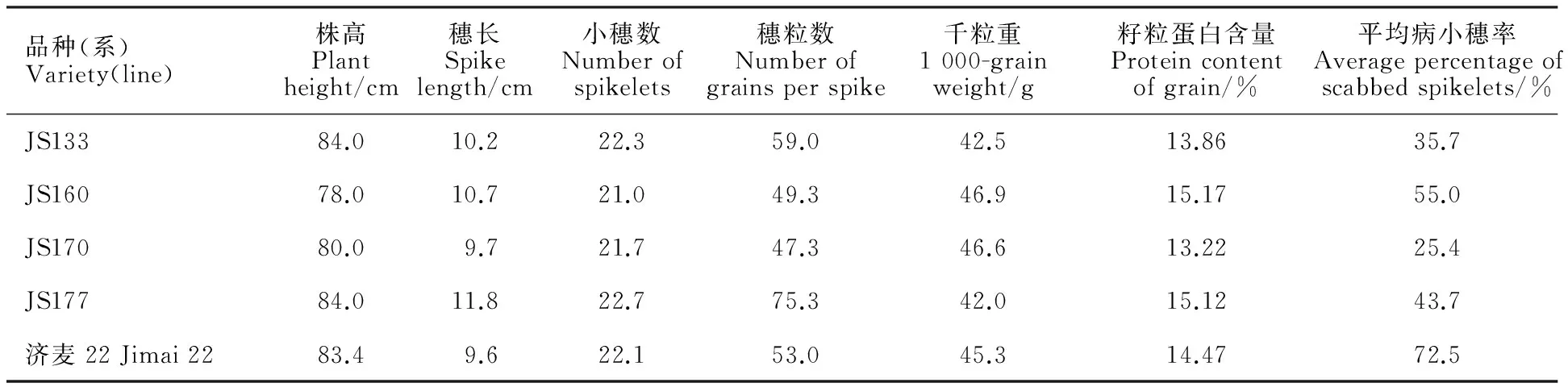
图2 部分BC4F2植株的分子标记辅助选择
综合连续3年鉴定的结果以及对照苏麦3号(抗赤霉病)、宁麦13(中抗赤霉病)和安农8455(感赤霉病)等对照品种的赤霉病发病情况,共筛选到赤霉病抗性中感以上的小麦品种(系)18份,其赤霉病抗性鉴定结果见表4。
为了探寻这些种质材料是否与赤霉病抗源苏麦3号拥有相同的抗病主效QTL,分别采用分子标记Xgwm533和Xgwm493对供试种质材料进行检测,发现南农13Y106与苏麦3号的Xgwm533标记带型相同;淮麦30、百农898、信资10-804、山农12号、众麦8号、南农13Y106与苏麦3号的Xgwm493标记带型相同。采用苏麦3号赤霉病抗病主效QTL重要候选基因PFT引物分析供试种质材料,发现淮麦30、百农898、信资10-804、众麦8号、南农13Y106、济扬06037、百农201、宛麦23和济扬81205含有PFT基因,推测其可能与苏麦3号拥有相同的赤霉病抗病主效基因。淮核12013、皖麦27、豫教6号、山农12、邯郸6172、JX109、丰麦518、农丰146和FY-1等则可能含有与苏麦3号不同的赤霉病抗病主效基因(图3)。
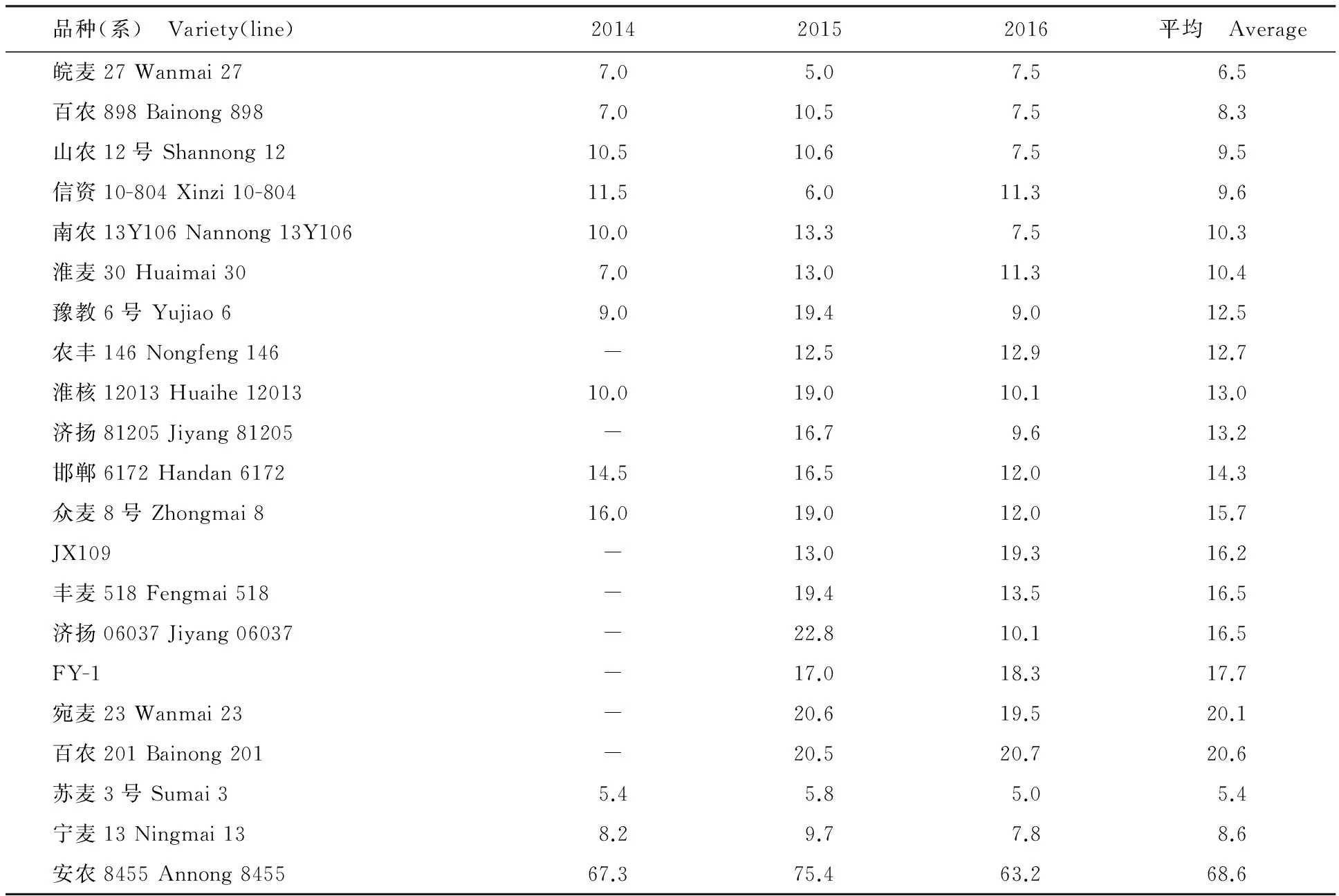
表4 赤霉病抗性稳定的小麦品种(系)的平均病小穗率Table 4 Average percentage of scabbed spikelets of varieties with stable FHB resistance %
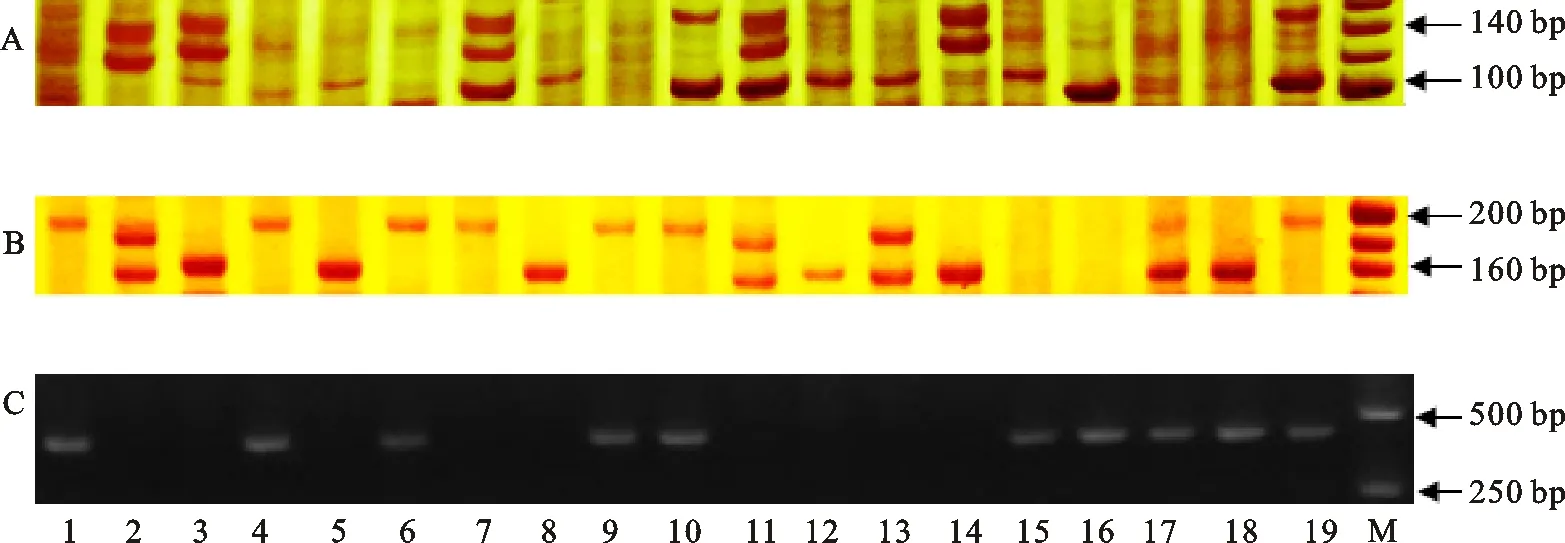
A:Xgwm533;B:Xgwm493;C:PFT。1:淮麦30;2:淮核12013;3:皖麦27;4:百农898;5:豫教6号;6:信资10-804;7:山农12号;8:邯郸6172;9:众麦8号;10:南农13Y106;11:JX109;12:丰麦518;13:农丰146;14:FY-1;15:济扬06037;16:百农201;17:宛麦23;18:济扬81205;19:苏麦3号;M:Marker。
A:Xgwm533;B:Xgwm493;C:PFT.1:Huaimai 30; 2:Huaihe 12013; 3:Wanmai 27; 4:Bainong 898; 5:Yujiao 6; 6:Xinzi 10-804; 7:shannong 12; 8:Handan 6172; 9:Zongmai 8; 10:Nannong 13Y106; 11:JX109; 12:Fengmai 518; 13:Nongfeng 146; 14:FY-1; 15:Jiyang 06037; 16:Bainong 201; 17:Wanmai 23; 18:Jiyang 81205; 19:Sumai 3; M:Marker.
图3抗病种质分子标记和Fhb1基因检测结果
Fig.3IdentificationofgermplasmresistancetoFHBusingmolecularmarkersandFhb1gene
3 讨 论
培育和推广抗赤霉病小麦品种是减少小麦赤霉病危害最有效的措施。经过多年努力,长江中下游麦区赤霉病危害有所缓解,但黄淮麦区抗病品种依然匮乏。据统计,2014-2016年长江中下游麦区进入国家区试生产试验的13个品种中,4个中抗赤霉病,其余均达中感;而同期进入黄淮南片国家区试生产试验的62个品种中,只有2个中感,其余均为高感[9-11]。直接采用长江中下游麦区小麦品种作为赤霉病抗源用于黄淮麦区小麦品种改良,由于两者在生态类型、株型、株高和籽粒颜色等方面差异较大,杂交后代分离严重,选育赤霉病抗性提高且聚合诸多适合黄淮麦区的优良农艺性状的品种较为困难,如将抗赤霉病基因先导入黄淮麦区大面积推广小麦品种,再进行杂交配组和选育,则相对容易。本研究采用分子标记辅助选择与常规杂交相结合的方法,将苏麦3号的抗病主效QTL导入到济麦22中,获得生育期、株高、株型、籽粒颜色等性状与济麦22相仿,且赤霉病抗性显著提高的半冬性小麦品系,这些品系可直接用于黄淮麦区育种的杂交配组,提高小麦赤霉病抗性,本课题组也将进一步对其产量进行评估,以期筛选出赤霉病抗性显著提高且同时拥有济麦22丰产性的小麦新品种(系)。
从黄淮麦区小麦品种(系)中筛选小麦赤霉病抗病新种质以及挖掘抗赤霉病新基因也是加快黄淮麦区抗赤霉病品种培育进程的重要途径,目前这方面的研究只有零星报道,黄 杰等[4]对参加2014-2015年河南省水地组小麦区试53个品种(系)的赤霉病抗性进行了分析,发现只有濮麦8026中抗赤霉病,囤丰809和金麦205达到中感,其余均为高感赤霉病。张玲丽等[3]研究表明,西农979具有与苏麦3号相同的 Fhb1基因,该品种在大田对赤霉病的抗性达到中感至中抗水平。为了挖掘新的赤霉病抗病基因,吕 超等[12]采用偃展1号×内乡188重组自交系群体,在2D、4B、4D、5B、5D等染色体上均发现了抗赤霉病QTL,表型解释率在2.27%~12.87%。以上研究表明,尽管黄淮麦区小麦赤霉病抗源匮乏,但部分小麦品种(系)也存在抗赤霉病基因,本研究对564份黄淮麦区小麦品种(系)的赤霉病抗性鉴定结果也证实了这一结论,共筛选到赤霉病中感以上材料18份,其中9份不含有苏麦3号赤霉病抗病主效基因,可能含有新的赤霉病抗性基因。
在苏麦3号抗赤霉病主效基因 Fhb1克隆之前,研究人员多采用Xgwm533和Xgwm493这两个标记对苏麦3号抗赤霉病主效QTL进行辅助选择,尽管两分子标记位于主效基因 Fhb1的两侧,但与该基因仍有不小遗传距离,辅助选择中常有主效基因丢失情况发生。本研究基于 Fhb1基因开发了新的分子标记,可直接对 Fhb1基因本身进行选择,无疑提高了选择效率。
长江中下游麦区的育种经验表明,选用综合性状及丰产性好且赤霉病轻的亲本配组,后代选择注重丰产和抗病兼顾,可以培育出抗赤霉病高产品种[2]。利用含有苏麦3号赤霉病抗病主效QTL的济麦22以及筛选获得的黄淮麦区抗赤霉病新种质,通过杂交以及分子标记辅助选择等手段,将抗赤霉病基因逐渐向黄淮麦区骨干亲本中转移和累积,再用赤霉病抗性逐步提高的骨干亲本进行配组,极有可能选育出适合黄淮麦区种植、高产抗赤霉病新品种。
参考文献:
[1] 陆维忠,程顺和,王裕中.小麦赤霉病研究[M].北京:科学出版社,2001:3.
LU W Z,CHENG S H,WANG Y Z.Studies on Fusarium head blight of wheat [M].Beijing:Science Press,2001:3.
[2] 程顺和,张 勇,别同德,等.中国小麦赤霉病的危害及抗性遗传改良[J].江苏农业学报,2012,28(5):938.
CHENG S H,ZHANG Y,BIE T D,etal.Damage of wheat Fusarium head blight(FHB) epidemics and genetic improvement of wheat for scab resistance in China [J].JiangsuJournalofAgriculturalScience,2012,28(5):938.
[3] 张玲丽,孙道杰,冯 毅,等.西农979抗赤霉病基因 Fhb1 的分子鉴定及其亲缘关系分析[J].麦类作物学报,2014,34(9):1199.
ZHANG L L,SUN D J,FENG Y,etal.Molecular identification of FHB resistance gene Fhb1 in Xinong 979 and its pedigree [J].JournalofTriticeaeCrops,2014,34(9):1199 .
[4] 黄 杰,乔冀良,张振永,等.河南省小麦品种对赤霉病的抗性分析[J].安徽农业科学,2017,45(8):31,52.
HUANG J,QIAO J L,ZHANG Z Y,etal.Resistance analysis of Henan wheat varieties against gibberellic disease [J].JournalofAnhuiAgriculturalScience,2017,45(8):31,52.
[5] 刘易科,佟汉文,朱展望,等.小麦赤霉病抗性改良研究进展[J].麦类作物学报,2016,36(1):51.
LIU Y K,TONG H W,ZHU Z W,etal.Review on improvement of Fusarium head blight resistance in wheat [J].JournalofTriticeaeCrops,2016,36(1):51.
[6] BUERSTMAYR H,BAN T,ANDERSON J A.QTL mapping and marker-assisted selection for Fusarium head blight resistance in wheat:a review [J].PlantBreeding,2009,128:1.
[7] RAWAT N,PUMPHREY O M,LIU S.Wheat Fhb1 encodes a chimeric lectin with agglutinin domains and a pore-forming toxin-like domain conferring resistance to Fusarium head blight [J].NatureGenetics,2016,48:1576.
[8] 周淼平,任丽娟,张 旭,等.3B 染色体短臂小麦赤霉病抗性主效QTL的分析[J].遗传学报,2003,30(6):571.
ZHOU M P,REN L J,ZHANG X,etal.Analysis of major QTL for Fusarium head blight resistance on the short arm of chromosome 3B in wheat [J].ActaGeneticaSinica,2003,30(6):571.
[9] 全国农业技术推广服务中心.中国冬小麦新品种动态:2013-2014年度国家冬小麦品种区域试验汇总报告[M].北京:中国农业科学技术出版社,2015:38,77.
The National Agro-Tech Extension and Service Center.New varieties of winter wheat in China:Summary report of National Winter Wheat Regional Trials in 2013-2014[M].Beijing:China Agricultural Science and Technology Press,2015:38,77.
[10] 农业部种子管理局,全国农业技术推广服务中心.2014-2015年度冬小麦国家区试品种报告[M].北京:中国农业科学技术出版社, 2016:34,87.
Seed Management Bureau of Ministry of Agriculture and the National Agro-Tech Extension and Service Center.Varieties report of National Winter Wheat Regional Trials in 2014-2015 [M].Beijing:China Agricultural Science and Technology Press,2016:34,87.
[11] 农业部种子管理局,全国农业技术推广服务中心.2015-2016年度冬小麦国家区试品种报告[M].北京:中国农业科学技术出版社, 2017:31,77.
Seed Management Bureau of Ministry of Agriculture and the National Agro-Tech Extension and Service Center.Varieties report of National Winter Wheat Regional Trials in 2015-2016 [M].Beijing:China Agricultural Science and Technology Press,2017:31,77.
[12] 吕 超,姚 琴,宋彦霞,等.偃展1号×内乡188群体抗小麦赤霉病QTL分析[J].麦类作物学报,2014,34(12):1633.
LÜ C,YAO Q,SONG Y X,etal.QTL analysis for Fusarium head blight(FHB) resistance in RIL population from Yanzhan 1×Neixiang 188 [J].JournalofTriticeaeCrops,2014,34(12):1633.
