MPTP诱导的食蟹猴偏侧帕金森病模型运动行为学的长期动态评价研究
2018-05-03罗斌斌胡亚松
罗斌斌 胡亚松 岳 峰,2 陈 彪,2*
(1.广西医科大学基础医学院转化医学研究中心 长寿与老年相关疾病教育部重点实验室,南宁 530000; 2.首都医科大学宣武医院神经生物学研究室,北京 100053)
帕金森病(Parkinson’s disease,PD)是一种常见于老年人的以肢体运动障碍为临床特征的神经变性疾病[1-3],全人群患病率大约在0.3%[4],伴随年龄的增加而发病率呈上升趋势[2, 5], 65岁以上人群患病率约是1~2%[3]。PD疾病发展表现出慢性进行性加重的特点[6],主要病因和病理机制是在衰老、遗传和环境因素共同作用下,中脑黑质致密部多巴胺能神经元进行性丢失引起黑质纹状体多巴胺的下降[7]。
20世纪80年代中期研究者[8-9]发现化合物1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)转变为毒性物质后可以透过血-脑脊液屏障,然后被多巴胺能神经元胞体摄取,聚集于线粒体后抑制呼吸链ATP合成,导致氧化应激损伤,进而引发多巴胺能神经细胞凋亡。MPTP是目前公认的可导致模拟人类PD症状的神经毒性的物质[10]。当前PD模型实验大多来自于啮齿类低等动物,高等动物模型较少[5-6, 11],非人灵长类动物具有许多与人类高度相似的生理学特征,MPTP诱导建立的猴帕金森病模型具有典型代表性[12],无论是临床症状的变化,还是病理和生物化学指标的改变都与人类原发 PD 十分相似,是进行 PD模型研究中的“金标准”[13]。MPTP诱导的模型包括肌肉注射诱导的全身模型和颈内动脉注射诱导的偏侧模型,前者运动症状明显持续,但因生活无法自理,容易死亡,无法开展长期实验,而后者可利用非受累侧肢体取食,生活质量影响不大,但同时,运动症状变化能否持久相关研究较少。本课题组利用由研究者判断的临床评分和24 h躯体自发运动总量监测两个指标评价颈内动脉注射MPTP诱导的偏侧PD模型长期运动症状动态变化。
1 材料与方法
1.1 研究对象
本次实验动物由广西南宁灵康赛诺科生物科技有限公司[以下简称灵康公司,SYXK(桂)2014-0004]提供,实验室获得国际实验动物评估和认可委员会(Association for Assessment and Accreditation of Laboratory Animal Care,AAALAC)认证。本研究实验方案经实验动物伦理委员会审核并批准实行(AAALAC:WD-0272009),本研究在灵康公司灵长类动物实验室进行,选取正常雄性食蟹猴(cynomolgus monkeys)作为本研究的实验对象。动物环境温度23~27 ℃,湿度40%~75%,12 h/12 h光暗交替(7点开灯,19点关灯)。动物早晚饲喂灵长类动物饲料[国家标准(GB)14924.8-2001],午餐提供水果蔬菜, 24 h为动物提供不限量的经反渗透过滤后的安全饮用水。
1.2 方法
1.2.1 主要仪器和试剂
躯体自发运动总量(physical activity monitoring,PAM)监测器(美国Mini Mitter公司),便携式录像机(日本Sony公司),MPTP(美国Sigma公司)。
1.2.2 MPTP诱导食蟹猴偏侧帕金森病模型的建立
5只雄性食蟹猴年龄(5.80±0.44)岁,体质量(5.90±0.86)kg,术前禁食12 h以上,常规麻醉,氯胺酮(0.1 mL /kg)肌注,术中持续异氟烷1%~3%(体积分数)吸入麻醉。将装有 60 mL 5%(质量分数)MPTP 溶液的注射器安装在MPTP注射泵上,以4 mL/min的速度开始于食蟹猴左侧颈总动脉末段注射 MPTP。MPTP 溶液注射(按照2 mg/kg体质质量)完毕后,逐层缝合颈阔肌、颈前筋膜、皮下组织及皮肤。
1.2.3 临床评分
将动物转移至录像单笼,分别于MPTP注射前(基线),注射后3、6个月及1、3、6年于清醒状态下进行行为录像1 h,通过结合Kulran(1991)非人灵长类动物帕金森病模型临床评分量表[14]对录像中表现出的临床症状进行双盲评分。评分内容包括:面部表情(0~3分)、静止性震颤(0~3分)、动作性或意向性震颤(0~3分)、姿势(0~2分)、步态(0~3分)、运动徐缓(全身)(0~4分)、平衡与协调(0~3分)、总体运动技能(上肢)(0~3分)、总体运动技能(下肢)(0~3分)、防御反应(0~2分)。最小分值为0分,即正常行为为0分,总分最高为29分,即最为严重。
1.2.4 躯体自发运动总量监测
躯体自发运动总量的监测主要包括:硬件设备中可以记录运动数据的实时活动PAM监测器,数据发送、接收的专用读取器ActiReader以及进行数据分析的Actical Software 3.0 软件。将PAM监测器佩戴于动物颈部,监测时间点为MPTP注射前,注射后3、6个月及1、6年。每次佩戴结束后取下PAM监测器,利用ActiReader进行数据读取,通过Actical Software 3.0 软件进行数据分析和整理。
1.3 统计学方法
2 结果
2.1 MPTP诱导的食蟹猴偏侧PD模型
结合Kulan 帕金森临床评分量表[14]来评判MPTP诱导的偏侧PD模型成功与否,造模前基线临床评分均为0分,造模后3个月内临床评分稳定在10 分以上可作为偏侧PD模型成功构建的指标。对5只食蟹猴进行行为观察,造模后2周开始出现精神萎靡、瞌睡、疲倦等急性期反应;4周开始出现PD临床症状,主要有运动缓慢、右侧肢体运动能力降低、屈曲身体以及攀爬能力下降,临床症状随时间不断加重;第5周临床评分>10分;3个月临床评分(14.65±8.41)最高,出现明显偏侧PD运动障碍表现,包括总体活动减少,面部表情僵硬(面具脸),运动徐缓,右上肢活动降低和右手震颤,右下肢运动减少,防御反应减弱,步态摇晃,身体平衡能力下降,以及不能进行攀爬,表明成功构建偏侧PD模型。
2.2 食蟹猴偏侧PD模型临床评分的长期动态评价
与造模后3个月临床评分(14.65±8.41)相比,造模后6个月(8.10±2.0)较基线仍明显增高,但与3个月高峰相期相比显著降低,造模后1年(7.15±1.48)、3年(4.65±1.01)、6年(4.90±1.94)均较3个月高峰期明显下降,但与造模后6个月的评分相比,差异无统计学意义(图1),成模半年后临床症状趋于平稳(5分左右),并维持至少6年。时间累积对临床评分的影响存在显著性(F=5.930,P<0.005)。
分别针对评分量表中的震颤(tremor)、防御反应(defense reaction)、平衡(balance)、姿势(posture)、步态(gait)、右上肢运动技能(right upper limb motor skills)、右下肢运动技能(right lower limb motor skills)、运动迟缓(bradykinesia)8个评分要素进行独立分析,成模后临床评分减低的先后顺序依次为:震颤>防御反应>平衡>姿势>步态>右下肢运动技能>右上肢运动技能>运动迟缓。这些症状均在3个月达到顶峰,随后改善,其中震颤6个月时基本消失,而右侧肢体的运动幅度和速度以及运动迟缓在造模后6年仍存在显著障碍,防御反应、平衡、姿势和步态改善较明显(图2)。
2.3 食蟹猴偏侧PD模型躯体自发运动总量的变化
造模后3个月24 h躯体自发运动总量(16 597.79±12 488.87)较造模前基线(50 084.20±30 170.89)明显降低(P=0.014)。造模后6个月24 h躯体自发运动总量(29 278.02±12 264.66)较3个月时有明显恢复(P=0.016),但仍显著低于基线。造模后1年至6年24 h躯体自发运动总量变化与基线相比差异无统计学意义(图3)。时间累积对24 h躯体自发运动总量的影响并不明显(F=2.850,P>0.05)。
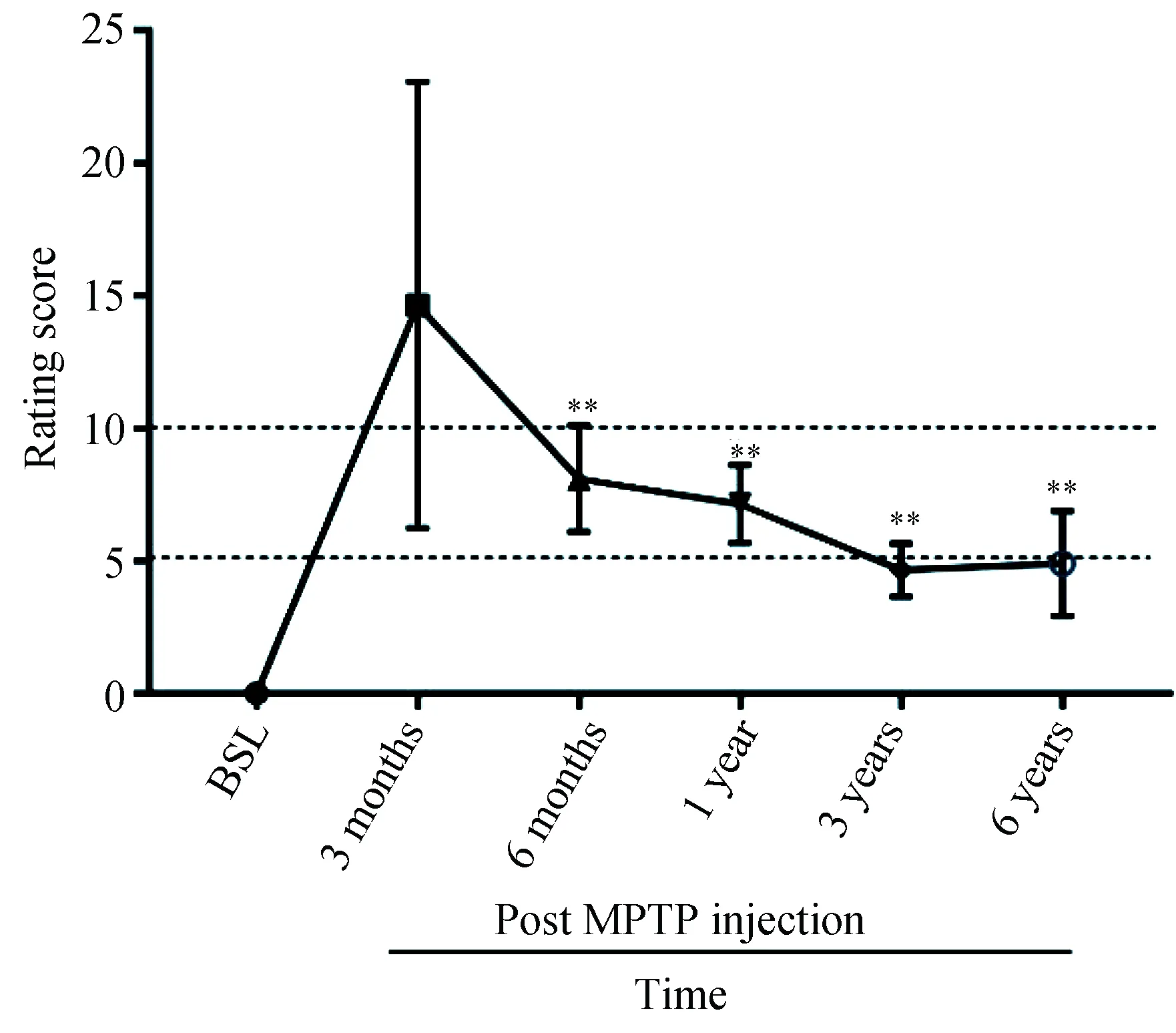
图1 食蟹猴偏侧PD模型造模前基线、造模后3、6个月及1、3、6年临床评分的比较Fig.1 Comparing the clinical scores before and after the modeling of the hemi-Parkinsonian’s model of cynomolgus monkeys at 3, 6 months and 1, 3, and 6 years after modeling
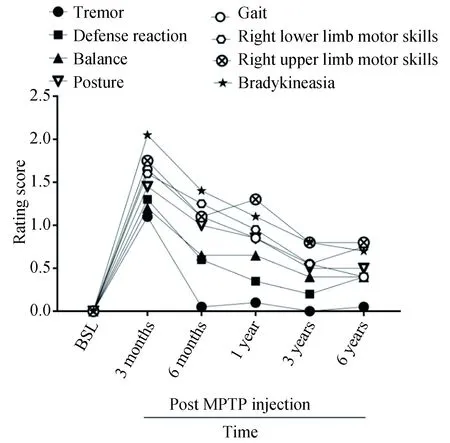
图2 食蟹猴偏侧PD模型造模前基线、造模后3、6个月及1、3、6年临床评分中各评分要素评分均值的变化Fig.2 Comparing the clinical scores before and after the modeling of the hemi-parkinsonian’s model of cynomolgusmonkeys at 3, 6 months and 1, 3, and 6 years after modeling

图3 食蟹猴偏侧PD模型造模前基线、造模后3、6个月及1、6年全天24 h躯体自发运动总量的变化Fig.3 Comparing the 24 h physical activity before and after the modeling of the hemi-parkinsonian’s model of cynomolgus monkeys at 3, 6 months and 1, 6 years after modeling
造模后3个月昼光(12 h)躯体自发运动总量 (14 814.19±12 707.49)较基线(45 743.90±28 587.57)下降明显(P=0.014)。造模后6个月昼光(12 h)躯体自发运动总量仍较基线明显降低(P=0.016),但造模后1年至6年昼光(12 h)躯体自发运动总量变化与基线相比差异无统计学意义(图4)。时间累积对昼光(12 h)躯体自发运动总量的影响并不明显(F=2.850,P>0.05)。

图4 食蟹猴偏侧PD模型造模前基线、造模后3、6个月及1、6年昼光和夜光躯体自发运动总量的比较Fig.4 Comparing the physical activity in day-12 h andnight-12 h before and after the modeling of the hemi-parkinsonian’s model of cynomolgus monkeys at 3 months, 6 months and 1, and 6 years after modeling
造模后3个月夜光(12 h)躯体自发运动总量(1 783.61±676.08)较基线(4 340.30±2 464.01)显著减少,差异有统计学意义(P=0.026)。造模后6个月夜光(12 h)躯体自发运动总量减少有明显恢复,但仍较术前基线减少,差异有统计学意义(P=0.028),造模后1年至6年夜光(12 h)躯体自发运动总量变化与基线相比差异无统计学意义(图4)。长时间的累积对夜光(12 h)躯体自发运动总量有着显著的影响(F=3.020,P<0.05)。
3 讨论
在MPTP诱导灵长类动物PD模型猴的研究中,除Domino等[15]对PD模型猴进行3年的药效研究和Emborg-Knott等[16]进行了6至8年的药效与行为观察,鲜有进行长期的运动行为学动态评价研究,尤其是偏侧模型。相比影像学研究[17-19]和病理学研究[20-21],本课题组首次结合临床评分和躯体自发运动总量的监测,来评价临床症状的发展变化,实现无创、经济的灵长类PD模型运动行为学的长期动态研究。
本研究制备的MPTP诱导食蟹猴偏侧PD模型注射后2周开始出现急性期非特异性全身反应,4周开始出现PD特异性运动症状,5周临床评分已大于10分,表明成功构建PD模型[22];3个月达到峰值,总分14左右,6个月分数降至8分左右,之后至6年后基本稳定在5分左右。从这些表现可以将该模型分为以下几个阶段:①急性期:MPTP注射至第4周,出现的全身症状反映了MPTP代谢物MPP+对外周器官和多巴胺神经元的损伤;②进展期:第4周至3个月,从开始出现运动症状到达到顶峰值,反映了黑质纹状体多巴胺神经元变性死亡和多巴胺递质的下降;③代偿恢复期:第3个月至1年,从运动症状达到顶峰值后下降达到稳定阶段(临床评分)或完全恢复(24 h躯体自发运动总量),反映了肢体或躯体逐渐适应了日常活动,源于动物体内存在自我补偿机制[16];④慢性期:1年到至少6年,躯体自发运动总量恢复正常,但受损对侧肢体随意活动仍然受到多巴胺神经元不可逆损伤的影响。
造模后3~6个月后最为明显的变化是动物的受损侧支配的上肢震颤得到了改善,其部分运动行为得到缓解,躯体自发运动基本恢复正常,表明动物体内的自身补偿[16],受损多巴胺能神经末梢得到代偿,受损侧纹状体支配的右侧上肢仅可偶尔表现出微弱取食的动作,这与模型稳定期动物右侧上肢运动技能严重缺失不同[23-24]。由于左侧纹状体严重不可逆受损,食蟹猴依然保持稳定的旋转行为,其支配的右侧上肢随意运动技能受限,以致动物倾向于使用左侧上肢进行精细运动,这也可能与偏侧性忽略病症[25]有关。6年后食蟹猴运动徐缓是其临床症状的主要表现,其中致病原因除多巴胺能神经元受到影响外,是否有路易小体及α-突触核蛋白的参与[20],则需要进一步研究。
造模后1年至6年间食蟹猴躯体自发运动总量与造模前基线数据差异无统计学意义,白天自发活动量改善最为明显,夜间自发活动量也有改善趋势。运动活动量为临床表现的一种量化方式,食蟹猴临床症状得到改善,6年后整体的活动量得以恢复并与基线无异。模型稳定期食蟹猴夜间运动活动量显著下降,可能与夜间运动功能减退[26]有关,夜间运动功能减退是夜间帕金森病的表现,可能需要各种神经基质和途径为其执行[27],但是缺乏临床病理的证明。有研究[28]显示身体机能、平衡控制、运动障碍与身体的活动量存在呈正相关。
与肌肉注射MPTP所致双侧肢体受累模型猴不同,偏侧模型6个月至1年之间的代偿恢复期是双侧模型没有的[29-30],此阶段不需要给予动物左旋多巴即可基本恢复正常自发活动。在此阶段动物可通过非受损侧肢体取食而维持基本正常日常活动,避免了较高的病死率且降低了饲养和照料成本;同时,偏侧模型可用于研究机体的代偿恢复机制。
本研究结果证实MPTP偏侧猴模型可导致不可逆的纹状体损害,引发持久的精细运动受损,可作为PD模型动物的长期动态和治疗评价研究,为神经细胞修复、细胞移植等提供重要的参考价值。
[1] Ponsford J P. Therapies for dopaminergic-induced dyskinesias in parkinson disease[J]. Ann Neurol, 2011, 70(4): 667.
[2] Zhang J, Stanton D M, Nguyen X V, et al. Intrapallidal lipopolysaccharide injection increases iron and ferritin levels in glia of the rat substantia nigra and induces locomotor deficits[J]. Neuroscience, 2005, 135(3): 829-838.
[3] Riedel O, Klotsche J, Spottke A, et al. Frequency of dementia, depression, and other neuropsychiatric symptoms in 1,449 outpatients with Parkinson’s disease[J]. J Neurol, 2010, 257(7): 1073-1082.
[4] de Lau L M, Breteler M M. Epidemiology of Parkinson’s disease[J]. Lancet Neurol, 2006, 5(6): 525-535.
[5] Choi D Y, Zhang J, Bing G. Aging enhances the neuroinflammatory response and alpha-synuclein nitration in rats[J]. Neurobiol Aging, 2010, 31(9): 1649-1653.
[6] 户乃丽, 刘玉军, 徐群渊,等. 黑质内炎症反应对恒河猴多巴胺能神经元的毒性作用[J]. 解剖学报, 2009, 40(5): 732-736.
[7] Zenzola A, Masi G, De Mari M, et al. Fatigue in Parkinson’s disease[J]. Neurol Sci, 2003, 24(3): 225-226.
[8] Zhang J R, Chen J, Yang Z J, et al. Rapid eye movement sleep behavior disorder symptoms correlate with domains of cognitive impairment in parkinson’s disease[J]. Chin Med J(Engl), 2016, 129(4): 379-385.
[9] Pessoa Rocha N, Reis H J, Vanden Berghe P, et al. Depression and cognitive impairment in parkinson’s disease: a role for inflammation and immunomodulation?[J]. Neuroimmunomodulation, 2014, 21(2-3): 88-94.
[10] Sateia M J. International classification of sleep disorders-third edition: highlights and modifications[J]. Chest, 2014, 146(5): 1387-1394.
[11] Jingzhong Z, Hui Y, Deyi D, et al. Long-term therapeutic effects on parkinsonian rats of intrastriatal co-grafts with genetically engineered fibroblasts expressing tyrosine hydroxylase and glial cell line-derived neurotrophic factor[J]. Int J Neurosci, 2005, 115(6): 769-779.
[12] Sulzer D, Surmeier D J. Neuronal vulnerability, pathogenesis, and parkinson’s disease[J]. Mov Disord, 2013, 28(1): 715-724.
[13] Lorigados L,Alvarez P, Pavón N, et al. NGF in experimental models of Parkinson disease[J]. Mol Chem Neuropathol, 1996, 28(1-3): 225-228.
[14] Kurlan R, Kim M H, Gash D M. Oral levodopa dose-response study in MPTP-induced hemiparkinsonian monkeys: assessment with a new rating scale for monkey parkinsonism[J]. Mov Disord, 1991, 6(2): 111-118.
[15] Domino E F, Ni L. Trihexyphenidyl potentiation of l -DOPA: reduced effectiveness three years later in MPTP-induced chronic hemiparkinsonian monkeys[J]. Exp Neurol, 1998, 152(2): 238-242.
[16] Emborg-Knott M E, Domino E F. MPTP-induced hemiparkinsonism in nonhuman primates 6-8 years after a single unilateral intracarotid dose[J]. Exp Neurol, 1998, 152(2): 214-220.
[17] Yagi S, Yoshikawa E, Futatsubashi M, et al. Progression from unilateral to bilateral parkinsonism in early Parkinson disease: implication of mesocortical dopamine dysfunction by PET[J]. J Nucl Med, 2010, 51(8): 1250-1257.
[18] Wood H. Parkinson disease: 18F-DTBZ PET tracks dopaminergic degeneration in patients with Parkinson disease[J]. Nat Rev Neurol, 2014, 10(6): 305.
[19] Ghaemi M, Raethjen J, Hilker R, et al. Monosymptomatic resting tremor and Parkinson’s disease: a multitracer positron emission tomographic study[J]. Mov Disord, 2002, 17(4): 782-788.
[20] Chen M, Wang T, Yue F, et al. Tea polyphenols alleviate motor impairments, dopaminergic neuronal injury, and cerebral alpha-synuclein aggregation in MPTP-intoxicated parkinsonian monkeys[J]. Neuroscience, 2015, 286:383-392.
[21] Hawkes C H, Del Tredici K, Braak H. Parkinson’s disease: a dual-hit hypothesis[J]. Neuropathol Appl Neurobiol, 2007, 33(6): 599-614.
[22] Yue F, Zeng S, Tang R, et al. MPTP induces systemic parkinsonism in middle-aged cynomolgus monkeys: clinical evolution and outcomes[J]. Neurosci Bull, 2017, 33(1): 17-27.
[23] Sonni I, Fazio P, Schain M, et al. Optimal acquisition time window and simplified quantification of dopamine transporter availability using 18F-FE-PE2I in ealthy controls and parkinson disease patients[J]. J Nucl Med, 2016, 57(10): 1529-1534.
[24] Emborg M E, Shin P, Roitberg B, et al. Systemic administration of the immunophilin ligand GPI 1046 in MPTP-treated monkeys[J]. Exp Neurol, 2001, 168(1): 171-182.
[25] Blini E, Romeo Z, Spironelli C, et al. Multi-tasking uncovers right spatial neglect and extinction in chronic left-hemisphere stroke patients[J]. Neuropsychologia, 2016, 92:147-157.
[26] Bhidayasiri R, Trenkwalder C. Getting a good night sleep? The importance of recognizing and treating nocturnal hypokinesia in Parkinson’s disease[J]. Parkinsonism Relat Disord, 2018[Epub ahead of print].
[27] Louter M, Maetzler W, Prinzen J, et al. Accelerometer-based quantitative analysis of axial nocturnal movements differentiates patients with Parkinson’s disease, but not high-risk individuals, from controls[J]. J Neurol Neurosurgery Psychiatry, 2015, 86(1): 32-37.
[28] Nero H, Benka Wallén M, Franzen E, et al. Objectively assessed physical activity and its association with balance, physical function and dyskinesia in parkinson’s disease[J]. J Parkinsons Dis, 2016, 6(4): 833-840.
[29] Jan C, Pessiglione M, Tremblay L, et al. Quantitative analysis of dopaminergic loss in relation to functional territories in MPTP-treated monkeys[J]. Eur J Neurosci, 2003, 18(7): 2082-2086.
[30] Zhang Z, Weeks R, Grondin R, et al. Similarities and differences in cognitive deficits and responsiveness to L-Dopa between aged and MPTP-treated cynomolgus monkeys tested on the same tasks[J]. J Gerontol Geriatr Res, 2014, 3:5.
