川芎嗪对大鼠肝星状细胞系HSC-T6自噬的影响
2018-05-03刘建芳
谢 鹏,薛 改,刘建芳
肝硬化是多种慢性肝病发展的晚期阶段,病理方面以肝脏弥漫性纤维化、再生结节和假小叶形成为特征[1]。在全球范围的年发病率为100/10万,发病高峰年龄在35~50岁,合并并发症时病死率高,严重威胁患者的生命健康[2]。肝纤维化具有一定的可逆性,可以施加部分手段进行干预,阻止其发展成肝硬化,同时防止肝纤维化也是防止肝癌的重要突破点。有研究发现细胞自噬在肝纤维化中出现增多,细胞自噬可以增强肝细胞活化和肝纤维化发生程度,且自噬可以通过降解脂滴为肝细胞活化提供能量[3]。有实验研究表明,抑制自噬可抑制肝细胞前胶原mRNA的表达及肝细胞株的增殖[4]。因此通过调节自噬水平可能成为防止肝纤维化的新靶点。最新研究发现,川芎嗪可降低血清Ⅲ型前胶原、透明质酸、层粘连蛋白水平,延缓肝纤维化形成,且能够抑制肝纤维化大鼠干细胞凋亡,进而抑制肝细胞激活,减少转化生长因子-β1(RGF-β1)的分泌[5]。有报道川芎嗪对抑制、减轻肝纤维化有一定疗效,但是川芎嗪对活化肝细胞株自噬作用是否有影响未见报道,因此本实验使用不同浓度的川芎嗪对活化肝细胞株HSC-T6进行干预,利用MDC染色法结合荧光显微镜观察肝细胞株HSC-T6中自噬溶酶体的形态改变,检测肝细胞株HSC-T6中自噬信号蛋白的表达,研究其对肝细胞株HL7702自噬的影响,为将来筛选肝纤维化的中药研究积累资料。
1 材料与方法
1.1细胞株与主要试剂 正常大鼠肝星状细胞系HSC-T6购自武汉大学细胞中心。细胞培养条件:含10%胎牛血清的RPMI 1640,37℃,5% CO2条件下培养。胎牛血清,RPMI 1640培养基均购自HyClone公司。MDC试剂盒购于碧云天生物有限公司。ATG5、beclin1、LC3Ⅱ兔单克隆抗体均购自Abcam(ab108327、ab207612、ab51520)。
1.2平板克隆实验 使用常规培养的肝星状细胞系HSC-T6经胰酶消化后,1200 r/min,3 min,弃去上清液。加入5 ml的无菌PBS溶液,轻轻吹散洗涤细胞沉淀并再次离心。反复洗涤3次后加入培养基,制备成单细胞悬液。测定细胞浓度并调整为1000个/ml,将单细胞悬液均匀的种植在无菌6孔板内,进行平板克隆实验。2周后观察平板克隆细胞形成情况。
1.3MDC染色 使用去离子水稀释Wash buffer,1000 r/min离心5 min收集细胞,使用Wash buffer洗涤细胞,介入适量的Wash buffer重悬细胞,计数并调节细胞浓度到1×106个/ml。取适量细胞悬液到新EP管中,加入MDC染色,轻轻混匀。室温避光染色,离心收集细胞,清洗细胞2次,弃上清。滴加于载玻片,加盖玻片,荧光显微镜下观察并拍照。
1.4蛋白免疫印迹法(Western blotting)检测自噬相关蛋白 在培养瓶中加入适量细胞裂解液,提取细胞蛋白,低温保存待用。配制15% SDS-PAGE,样品孔上样25 μl,于80 V恒压40 min,120 V恒压60 min,使用湿转法电转至PVDF膜,使用5%脱脂奶粉封闭2 h于摇床上,一抗(ATG5,beclin1,LC3Ⅱ,浓度1∶2000)孵化,4℃过夜;二抗室温孵育2 h;ECL发光。实验重复3次。

2 结果
2.1不同浓度川芎嗪对肝星状细胞系HSC-T6影响 不同浓度川芎嗪对肝星状细胞系HSC-T6中ATG5蛋白影响水平不同,25 ng/ml是川芎嗪作用于肝星状细胞系HSC-T6最佳浓度(图1)。结合以上结果,后续实验我们采取25 ng/ml浓度进行。
2.2川芎嗪对大鼠肝星状细胞系HSC-T6增殖作用的影响 对照组平板克隆实验形成的细胞球数目为179.2±7.4,川芎嗪组为42.6±2.9。川芎嗪组平板克隆实验形成的细胞球数目少于对照组,差异有统计学意义(P<0.05)。
2.3大鼠肝星状细胞系HSC-T6中自噬溶酶体的形态改变 相对对照组,川芎嗪组大鼠肝星状细胞系HSC-T6出现明显的点状聚集,亮度增加,自噬体降解数量明显增加。见图2。

图1不同浓度川芎嗪对大鼠肝星状细胞系HSC-T6自噬功能的影响

图2川芎嗪对大鼠肝星状细胞系HSC-T6自噬溶酶体的影响
2.4川芎嗪对自噬信号分子蛋白ATG5、beclin1、LC3Ⅱ表达的影响 加入25 ng/ml的川芎嗪后,大鼠肝星状细胞系HSC-T6 ATG5、beclin1及LC3Ⅱ表达水平为(18.16±1.36) %、(82.94±5.93)%及(76.54±9.19)%,对照组表达水平分别为(86.12±3.42)%、(22.72±2.86)%和(16.43±3.8)%。川芎嗪组大鼠肝星状细胞系HSC-T6 ATG5表达水平低于对照组,beclin1及LC3Ⅱ表达水平高于对照组(P<0.05)。见图3。
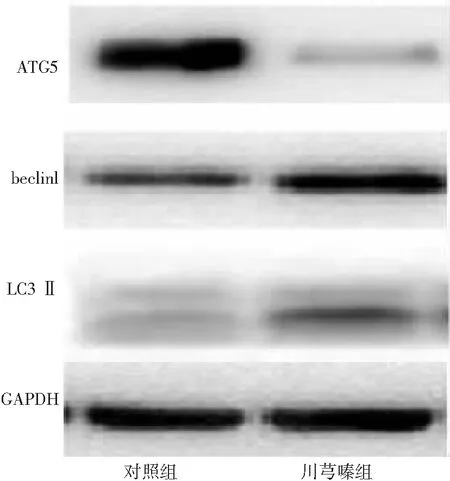
图32组大鼠肝星状细胞系HSC-T6中自噬蛋白的变化水平
3 讨论
肝纤维化是慢性肝脏疾病导致的过度损伤修复的过程[6]。在这个过程中,肝细胞外基质成分过多的沉积在肝内引起肝纤维化[7]。肝脏损伤后导致位于肝窦状隙内的肝细胞活化并分化为肌成纤维细胞,其细胞形态发生改变,细胞明显增殖并分泌大量细胞活化因子及细胞外基质,导致肝纤维化[8]。
自噬是通过自我清除体内无用的累积蛋白质聚集物和有缺陷的细胞器等,维持细胞内环境稳态[9]。在受到外界环境刺激,细胞通过提高自噬水平,将胞浆内组分分解为游离氨基酸、脂肪酸和核苷酸,维持细胞能量代谢[10]。刘曼等[11]报道自噬和肝星状细胞系HSC-T6活化有关。Salemi等[12]也发现在肝星状细胞系HSC-T6活化过程中,代表自噬溶酶体的红色斑点增加,说明自噬流量增加。乙型或丙型肝炎病毒利用自噬促进病毒复制[13]。在酒精性肝损害中,抑制自噬水平有助于清除沉积的无功能大分子蛋白[14]。根据不同疾病自噬作用,通过调节自噬水平有助于疾病转归及预防肝纤维化形成。
川芎嗪具有抗血小板、使血小板解聚的作用,对心脑血管供血不足引起的各种症状有很好的缓解作用[15]。孙伟大等[16]发现川芎嗪能抑制肝纤维化大鼠细胞凋亡,进而抑制肝细胞株激活,从而改善肝纤维化。本实验通过检测不同浓度川芎嗪对活化肝星状细胞系HSC-T6的作用,筛选出活化肝星状细胞系HSC-T6最佳浓度为25 ng/ml,然后通过MDC染色显示肝星状细胞系HSC-T6内自噬溶酶体呈现膨胀状态,有较多伪足,质膜相对不完整,表明该浓度川芎嗪可促进肝细胞自溶进程,加速自噬溶酶体破解。本研究结果显示,川芎嗪组平板克隆实验形成细胞球数目少于对照组,自噬体降解数量明显增加,ATG5表达水平低于对照组,beclin1及LC3Ⅱ表达水平高于对照组。提示川芎嗪可抑制肝星状细胞系HSC-T6增殖能力,加速自噬溶酶体降解过程,下调自噬蛋白表达水平。
综上所述,川芎嗪可以抑制肝细胞的增殖,还可影响其自噬溶酶体的形态变化,其可以干扰肝纤维化发展至肝硬化的进程,有可能对肝纤维化的治疗提供理论依据。
[参考文献]
[1] 吴志勇,陈炜.肝硬化门静脉高压症围术期处理策略[J].中华消化外科杂志,2016,15(1):661-664.
[2] 漆德芳,孟申.肝硬化[M].北京:北京科学技术出版社,2000:530.
[3] Chen Y, Henson E S, Xiao W,etal. Tyrosine kinase receptor EGFR regulates the switch in cancer cells between cell survival and cell death induced by autophagy in hypoxia[J].Autophagy, 2016,12(6):1029-1046.
[4] Joffre C, Codogno P, Fanto M,etal. STK38 at the crossroad between autophagy and apoptosis[J].Autophagy, 2016,12(3):594-595.
[5] 贾建国.丹参川穹嗪对冠心病心绞痛的治疗效果及对血浆内皮素与一氧化碳水平的影响[J].现代医药卫生,2016,32(10):1529-1530.
[6] Singh S, Venkatesh S K, Loomba R,etal. Magnetic resonance elastography for staging liver fibrosis in non- alcoholic fatty liver disease: a diagnostic accuracy systematic review and individual participant data pooled analysis[J].European radiology, 2016,26(5):1431-1440.
[7] 王美玲,陆伦根.肝纤维化治疗研究进展[J].实用肝脏病杂志,2013,16(4):369-371.
[8] 陈永鹏,汪艳,侯金林.肝纤维化/肝硬化的动态变化及其诊断进展[J].中华肝脏病杂志,2015,23(4):244-246.
[9] Mowers E E, Sharifi M N, Macleod K F. Novel insights into how autophagy regulates tumor cell motility[J].Autophagy, 2016,12(9):1679-1680.
[10] Levine B, Klionsky D J. Autophagy wins the 2016 Nobel Prize in Physiology or Medicine: Breakthroughs in baker's yeast fuel advances in biomedical research[J].Proc Natl Acad Sci U S A, 2017,114(2):201-205.
[11] 刘曼,何月,张吉翔.自噬抑制剂3-甲基腺嘌呤对肝星状细胞增殖活化的影响[J].细胞与分子免疫学杂志,2013,29(8):809-812,817.
[12] Salemi S, Yousefi S, Constantinescu M A,etal. Autophagy is required for self-renewal and differentiation of adult human stem cells[J].Cell Res, 2012,22(2):432-435.
[13] Rubinsztein D C, DiFiglia M, Heintz N,etal. Autophagy and its possible roles in nervous system diseases, damage and repair[J].Autophagy, 2005,1(1):11-22.
[14] Furuya N, Yu J, Byfield M,etal. The evolutionarily conserved domain of beclin 1 is required for VPS34 binding, autophagy and tumor suppressor function[J].Autophagy, 2005,1(1):46-52.
[15] 唐泽耀,王世龙,林原.川穹嗪在神经系统的药代动力学及临床药效学应用研究进展[J].中国临床药理学杂志,2010,26(7):535-539.
[16] 孙伟大,张亮,张施工,等.盐酸川穹嗪联合复方甘草酸苷注射液与多烯磷脂酰胆碱注射液治疗酒精性肝炎的疗效观察[J].临床合理用药,2012,5(24):67-68.
