土壤性质对真菌温度敏感性的影响
2018-05-03董炜灵尹华群刘学端宋阿琳范分良
董炜灵,尹华群*,刘学端,宋阿琳,范分良*
(1.中南大学资源加工与生物工程学院,湖南 长沙 410000;2.中国农业科学院农业资源与农业区划研究所/农业部植物营养与肥料重点实验室,北京 100081)
近年来,全球气候变化在改变生态系统的结构和功能方面已经发挥了越来越重要的作用。由于土壤微生物群落介导了绝大多数土壤功能过程,因而气候变化所导致的温度上升会通过影响微生物群落结构和活性进而间接影响土壤功能[1-2],其中包括土壤营养物质的流动和碳氮等元素的生物地球化学循环[3-5]。然而,鉴于土壤微生物群落高度复杂的多样性,目前人们还难以了解温度升高是如何影响土壤微生物群落的结构和功能以及其对土壤生态系统的反馈[6]。相比于植物和动物对于温度变化的响应,微生物在这方面的研究相对要少一些,而真菌比细菌则更少。微生物中真菌更偏向于降解那些以难降解碳形式居多的有机碳化合物[7]。微生物群落丰度在温度转变下所发生的变化反映出其温度敏感性,研究真菌群落的温度敏感性有助于了解土壤中难降解碳的降解情况和趋势。
另一方面,人类活动例如牧场和农田的建立,或者人工造林都会对土壤性质产生不同程度的影响[8]。而土壤性质的改变可能关联到土壤微生物的温度敏感性。然而,对于改变土壤性质对土壤微生物温度敏感性产生影响的相关研究还很少。本研究以湖南省祁阳县两种不同性质的红壤为研究对象,利用伽马射线灭菌和土壤互相接种的方式探讨改变土壤性质对土壤真菌温度敏感性的影响,旨在为全球气候变暖情况下不同土壤温度敏感性相关研究提供科学依据。
1 材料与方法
1.1 供试土壤
供试土壤取自湖南省祁阳县中国农业科学院试验站(26°45′12″ N,111°52′32″ E),成土母质为第四纪红土,年平均气温18℃,年降水量1 250 mm。其中自然土壤取自长期定位施肥试验田附近,农田土壤取自长期定位施肥试验田。供试土壤的主要化学性质见表1。

表1 供试土壤的主要化学性质
1.2 试验设计
以往研究表明,尽管伽马射线灭菌可能提高土壤铵态氮浓度,但其对土壤性质的总体影响比高温高压灭菌等其它灭菌方法的影响要小[9],故本研究利用伽马射线将两种性质的土壤(自然土和农田土)灭菌,灭菌剂量为40 kGy。然后分别装袋,每袋土为1.4 kg。后将100 g未灭菌的土壤(自然土和农田土)分别装入已灭过菌的不同性质土壤(自然土和农田土)中。其中,灭菌土壤提供特定的土壤性质(一种是未施肥处理性质的土壤,另一种是经过长期施肥处理性质的土壤),而未灭菌土壤提供两种土壤特定的微生物。因此,本试验分为4个处理:(1)未灭菌自然菌+灭菌自然土,(2)未灭菌自然菌+灭菌农田土,(3)未灭菌农田菌+灭菌农田土,(4)未灭菌农田菌+灭菌自然土。本试验主要研究:(1)自然土壤微生物在自然和农田两种土壤性质下温度敏感性对比;(2)农田土壤微生物在农田和自然两种土壤性质下温度敏感性对比。将土壤混匀后用无菌滤膜密封,以防微生物污染,但可以流通空气,然后放于20℃预培养一个月。
预培养结束后,将30 g土壤分装于125 mL血清瓶中,分别于15和25℃正式培养20 d。分别在培养的第2、5、10、15 d打开盖子,让瓶内气体与室内环境气体换气5 min。20 d后,破坏性取样,把土壤存放于-80℃冰箱。
1.3 测试方法
1.3.1 土壤DNA的提取
采用DNA提取试剂盒FastDNA spin kit for soil(MP Biomedicals),按照说明书的步骤操作。
1.3.2 定量PCR扩增
扩增真菌18S rDNA的引物为真菌通用引物FF390和FR1,它们的序列为:
FF390:5′-CGATAACGAACGAGACCT-3′和FR1:5′-AICCATTCAATCGGTAIT-3′
反应体系见表2。
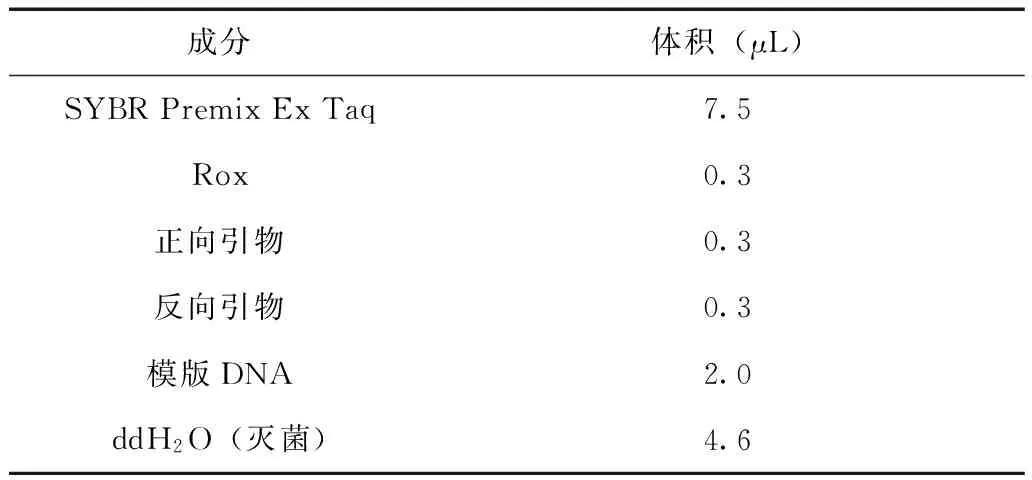
表2 总体积15 μL的定量PCR扩增反应体系
PCR反应程序:95℃预变性3 min;95℃解链10 s,52℃退火30 s;72℃延伸45 s;40个循环;72℃延伸10 min。
1.3.3 普通PCR
扩增真菌ITS DNA采用两轮扩增法,第一轮引物为真菌通用引物ITS1F和ITS4,第二轮引物为真菌通用引物ITS4和带有barcode的引物ITS3,它们的序列为:
ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′
ITS4:5′-TCCTCCGCTTATTGATATGC -3′
ITS3:5′-GCATCGATGAAGAACGCAGC-3′
反应体系见表3。
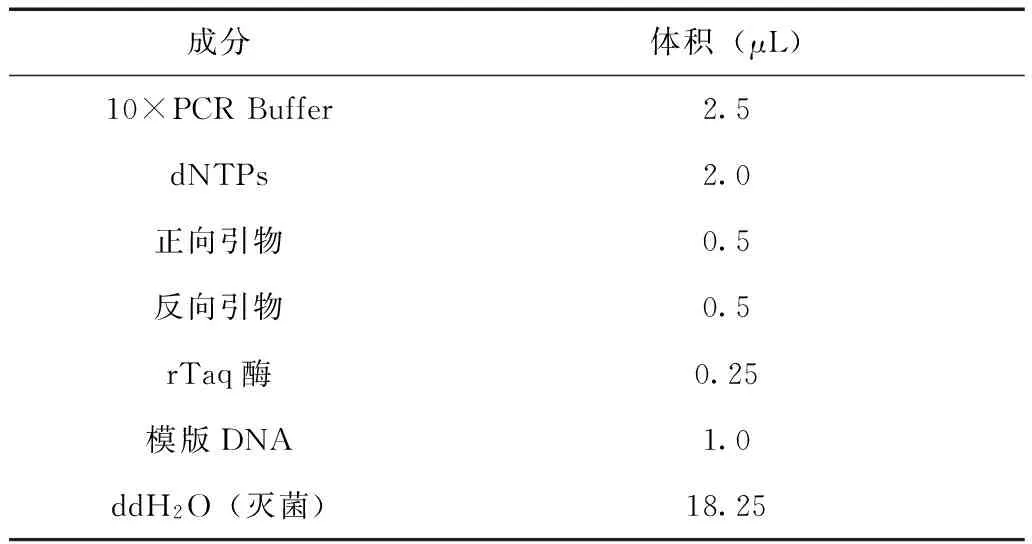
表3 总体积25 μL的普通PCR扩增反应体系
第一轮PCR反应程序:94℃预变性5 min;94℃解链45 s,50℃退火30 s;72℃延伸1.5 min;30个循环;72℃延伸10 min。
第二轮PCR反应程序:94℃预变性5 min;94℃解链45 s,50℃退火30 s;72℃延伸1.5 min;30个循环;72℃延伸10 min。
PCR产物跑1%琼脂糖凝胶电泳。
1.3.4 PCR扩增产物切胶纯化和回收
PCR扩增产物的纯化和回收,使用天根DNA切胶纯化试剂盒,按照说明书的步骤操作。
1.3.5 高通量测序
采用Illumina第二代测序技术平台。
1.4 分析工具与方法
1.4.1 分析工具
高通量序列用USEARCH软件包分析,首先去除质量数低于20的序列,然后去除与引物不一致的序列;所得到的高质量序列统一保留250 bp,用UPARSE进行聚类,相似度大于97%的序列定义为一个分类操作单元(OTU);嵌合体用UCHIME去除;采用Excel 2010与SPSS 20软件进行数据统计分析,采用单因素ANOVO进行方差分析不同时间点微生物相对丰度的差异(P<0.05)。
1.4.2 分析方法
温度敏感真菌的分析:寻找受温度影响较大的真菌个体,以OTU为单位的相对丰度变化为依据,引入“温度响应”的概念[9]。温度响应=25℃真菌相对丰度-15℃真菌相对丰度。在两个温度下真菌相对丰度都为0的OTU不参与统计。在相对丰度有显著性差异(P<0.05)的前提下,温度响应值为正值的称为热响应真菌,负值的称为冷响应真菌,统称为温度敏感真菌。选出这些热响应或冷响应的OTU后再按照“目”分类水平归类。另一方面,把所有真菌按照“目”分类水平归类后比较哪些菌目受到温度变化影响较大,菌目名后缀为_In_se表示分类未确定,表征公式为:相对丰度变化=log10[(25℃相对丰度-15℃相对丰度)/15℃相对丰度×100]。只取相对丰度大于0.05%的菌目参与比较。正值表示相对丰度随温度上升而增加,负值表示相对丰度随温度上升而减少。
2 结果与分析
2.1 土壤性质对真菌群落总丰度温度敏感性的影响
从图1结果可看出,真菌群落总丰度的变化范围为3.35×107~1.99×108个·g-1土。在自然土壤中,自然土壤的真菌升温后总丰度降低了13.48%;在改变为农田土壤后,自然土壤的真菌升温后总丰度降低了3.57%。在农田土壤中,农田土壤的真菌升温后总丰度增加了15.66%;在改变为自然土壤后,农田土壤的真菌升温后总丰度降低了22.66%。但以上真菌丰度随温度变化的差异都不显著。总体来说,不论是在自然土壤中,还是农田土壤中,真菌群落总丰度都没有随温度升高发生显著性变化。
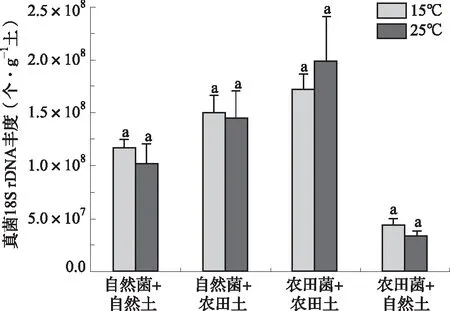
图1 土壤性质对真菌群落总丰度温度敏感性的影响
2.2 土壤性质对温度敏感真菌目个数的影响
从图2结果可看出,在土壤性质由自然土壤改变为农田土壤后,来自自然土壤的真菌中温度敏感真菌目个数由11减少为10,其中冷响应真菌目的数目不变,热响应真菌目的个数由2减少为1。另外,在土壤性质由农田土壤改变为自然土壤后,来自农田土壤的真菌中温度敏感真菌目个数由7增加到11,其中热响应真菌目的数目不变,冷响应真菌目的个数由5增加到9。

图2 土壤性质对温度敏感真菌目个数的影响
2.3 土壤性质对温度敏感真菌累积相对丰度的影响
从图3结果可看出,在培养温度从15℃升高到25℃后,自然土壤的真菌在自然土壤中冷响应和热响应真菌累积相对丰度之和从2.22%减少为1.35%,其中热响应真菌累积相对丰度从0.09%增加到0.48%,冷响应真菌累积相对丰度从2.12%减少为0.88%。土壤性质改为农田土壤后,自然土壤的真菌中冷响应和热响应真菌累积相对丰度之和从1.25%减少为0.56%,其中热响应真菌累积相对丰度从0.001%增加到0.03%,冷响应真菌累积相对丰度从1.25%减少为0.53%。在培养温度从15℃升高到25℃后,农田土壤的真菌在农田土壤中冷响应和热响应真菌累积相对丰度之和从13.66%增加到19.03%,其中热响应真菌累积相对丰度从13.54%增加到18.99%,冷响应真菌累积相对丰度从0.12%减少为0.04%。土壤性质改为自然土壤后,农田土壤的真菌中冷响应和热响应真菌累积相对丰度之和从6.01%减少为2.51%,其中热响应真菌累积相对丰度从0.01%增加到0.11%,冷响应真菌累积相对丰度从6.00%减少为2.40%。
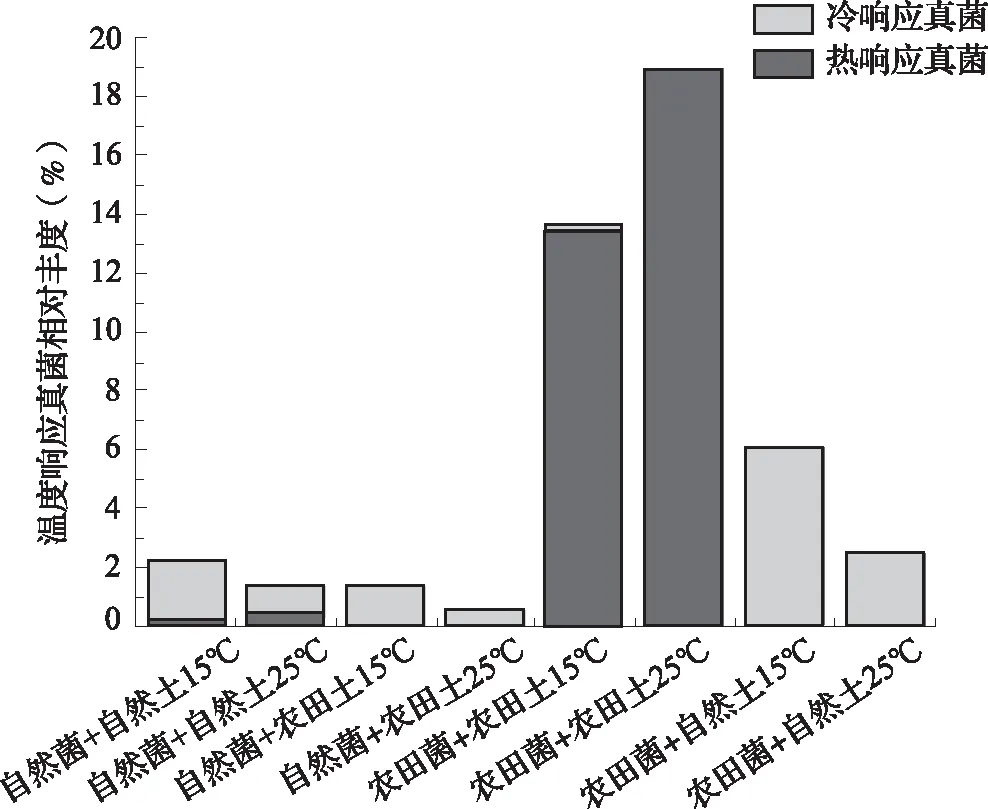
图3 土壤性质对温度敏感真菌累积相对丰度的影响
2.4 土壤性质对冷、热响应真菌群落组成的影响
图4表示的是冷、热响应真菌群落内部相对丰度组成。15℃下,在自然土壤环境下,来自自然土壤的真菌中热响应真菌有Capnodiales、Chaetothyriales,内部群落丰度组成分别为1.06%、98.94%;土壤环境改为农田土壤后,热响应真菌有Eurotiales,内部群落丰度组成为100%。另外,来自农田土壤的真菌在农田土壤环境下热响应真菌有Capnodiales、Sordariales,内部群落丰度组成分别为99.96%、0.04%;土壤环境改为自然土壤后,热响应真菌有Chaetothyriales、Hypocreales,内部群落丰度组成分别为91.67%、8.33%。25℃下,改变土壤性质对热响应真菌相对丰度的影响类似于15℃。

图4 土壤性质对热、冷响应真菌群落组成的影响
从图4结果可看出,15℃下,在自然土壤环境下,来自自然土壤的真菌中冷响应真菌有Agaricales、Chaetosphaeriales、Eurotiales、Hypocreales、Mortierellales、Pezizales、Pleosporales、Sordariales、Tremellales,内部群落丰度组成分别为0.44%、37.79%、4.09%、6.26%、3.95%、1.68%、6.07%、34.73%、4.98%;土壤环境改为农田土壤后,冷响应真菌有Agaricales、Capnodiales、Chaetothyriales、Corticiales、Eurotiales、Hypocreales、Pleosporales、Sordariales、Spizellomycetales,内部群落丰度组成分别为6.96%、54.58%、3.61%、0.50%、0.59%、30.02%、0.34%、1.43%、2.01%。另外,来自农田土壤的真菌在农田土壤环境下冷响应真菌有Chaetothyriales、Eurotiales、Helotiales、Microascales、Pezizales,内部群落丰度组成分别为58.97%、12.82%、8.55%、8.55%、11.11% ;土壤环境改为自然土壤后,冷响应真菌有Botryosphaeriales、Capnodiales、Chaetosphaeriales、Eurotiales、Pezizales、Pleosporales、Sordariales、Trechisporales、Verrucariales,内部群落丰度组成分别为2.24%、60.60%、5.83%、0.44%、3.20%、8.82%、9.29%、6.76%、2.83%。25℃下,改变土壤性质对冷响应真菌相对丰度的影响类似于15℃。
2.5 土壤性质对土壤真菌的温度响应程度的影响
如图5所示,把土壤中所有真菌在目水平下分类后再比较相对丰度变化,以log10(相对丰度变化率%)来表征。在自然土壤环境下,来自自然土壤的真菌中因升温相对丰度有显著性减少的菌目有Eurotiales、Hypocreales、Sordariales,分别减少1.02、1.66、1.33;土壤环境改为农田土壤后,因升温相对丰度有显著性减少的菌目有Capnodiales、Pezizomycotina_In_se,分别减少1.50、1.78。来自农田土壤的真菌在农田土壤环境下因升温相对丰度有显著性减少的菌目有Chaetosphaeriales、Pezizales、Pyrenulales,分别减少1.49、1.45、1.80;相对丰度有显著性增加的菌目有Capnodiales,增加1.51;土壤环境改为自然土壤后,因升温相对丰度有显著性减少的菌目有Capnodiales、Chaetosphaeriales、Pezizomycotina_In_se,分别减少1.55、1.90、1.41;相对丰度有显著性增加的菌目有Pleosporales,增加1.24。

图5 土壤性质对土壤真菌的温度响应程度的影响[目水平下,log10(相对丰度变化率%)]
3 结论与讨论
本文探讨了改变土壤性质对土壤真菌温度敏感性的影响。本试验研究结果表明,虽然农田土壤真菌总丰度受土壤性质的影响大于自然土壤真菌,但改变土壤性质对自然和农田土壤真菌总丰度温度敏感性均没有产生显著性的影响,因此,本研究进一步要从群落结构的角度进行深入的分析。
有研究表明,在对具有温度敏感真菌分类时,在目水平上的分类最为灵敏,因此本试验也采用目水平上的分类[10]。本研究鉴定了对于温度具有敏感性的真菌,并依据其相对丰度变化与温度变化的正负关系将其分为热响应真菌和冷响应真菌。结果表明,无论是自然土壤或农田土壤的真菌,一旦改变其所在的土壤性质就会改变温度敏感真菌的个数。改变土壤性质主要减少自然土壤真菌中的热响应真菌的个数,增加农田土壤真菌中的冷响应真菌的个数。有研究表明,升温会增加土壤真菌的多样性,但是施肥处理则会降低真菌的多样性,这就可能导致自然土壤真菌在改变土壤性质为农田土壤后温度敏感真菌个数的减少,而农田土壤真菌在改变土壤性质为自然土壤后温度敏感真菌个数增加[11]。改变土壤性质分别减少了自然土壤真菌中热响应和冷响应真菌的累积相对丰度,增加了农田土壤中冷响应真菌的累积相对丰度,而热响应真菌的累积相对丰度降低。
以往研究表明,温度的升高会导致真菌整体群落组成的改变[12-14]。本研究进一步证实,改变土壤性质使这些温度敏感真菌的群落组成发生了改变。土壤性质改变后,自然土壤真菌的热响应真菌由Capnodiales、Chaetothyriales变为Eurotiales;冷响应真菌由Agaricales、Chaetosphaeriales、Eurotiales、Hypocreales、Mortierellales、Pezizales、Pleosporales、Sordariales、Tremellales变为Agaricales、Capnodiales、Chaetothyriales、Corticiales、Eurotiales、Hypocreales、Pleosporales、Sordariales、Spizellomycetales。改变土壤性质后,农田土壤真菌的热响应真菌由Capnodiales、Sordariales变为Chaetothyriales、Hypocreales;冷响应真菌由Chaetothyriales、Eurotiales、Helotiales、Microascales、Pezizales变为Botryosphaeriales、Capnodiales、Chaetosphaeriales、Eurotiales、Pezizales、Pleosporales、Sordariales、Trechisporales、Verrucariales。然而,与其他研究者的结果对比来看,本试验中温度敏感真菌占真菌总体的比例还是小了许多[15],原因可能是其他研究者的培养时间长于本试验的培养时间。如果延长培养时间,土壤真菌种群还会改变,因为真菌群落对升温具有一定的抗性,因此需要更长的时间才能体现出温度所带来的影响,从而更好地研究土壤性质改变对真菌温度敏感性的影响[16]。
不同微生物往往因为遗传背景不同,在生态系统中发挥的功能也具有较大差异[17]。有研究表明,在本研究中发现的受土壤性质影响的温度敏感真菌的功能可能存在差异。如Capnodiales是一种拮抗菌,可以增强植物的抗病性[18];Chaetothyriales与磷代谢相关[19];Eurotiales、Chaetosphaeriales、Corticiales都是降解纤维素的真菌[20-22];Mortierellales是一种腐生菌,善于降解有机质[23];Pezizales是菌根共生菌,会促进植物生长[24];Spizellomycetales在土壤氮循环方面发挥作用[25]。因此,根据改变土壤性质造成的自然土壤温度敏感真菌群落的变化,推测热响应真菌功能由植物保护、磷代谢功能变为纤维素降解功能;冷响应真菌功能由有机质降解、促进植物生长功能变为植物保护、磷代谢、氮代谢功能。此外,Sordariales具有反硝化功能[26];Hypocreales与磷循环相关[27];Helotiales与氮循环相关[28];Botryosphaeriales是一种内生菌,也是植物的病原菌[29]。因此,根据改变土壤性质造成的农田土壤温度敏感真菌群落的变化,推测热响应真菌功能由植物保护、反硝化功能变为磷代谢功能;冷响应真菌功能由磷代谢、氮代谢功能变为植物病害、纤维素降解、反硝化功能。
本实验探索了改变红壤性质对真菌温度敏感性的影响,发现:(1)改变土壤性质会改变温度敏感真菌目分类水平上的数量;(2)改变土壤性质会改变温度敏感真菌的种类和相对丰度。虽然本研究没有研究真菌所对应的功能,但根据以往关于微生物功能具有遗传特异性的研究结果[17],可以推测,改变土壤性质可能对真菌功能的温度敏感性产生深远影响。
参考文献:
[1] Nannipieri P,Ascher J,Ceccherini M T,et al.Microbial diversity and soil functions[J].European Journal of Soil Science,2003,54(4):655-670.
[2] Grimm N B,Chapin F S,Bierwagen B,et al.The impacts of climate change on ecosystem structure and function[J].Frontiers in Ecology and the Environment,2013,11(9):474-482.
[3] Butler S M,Melillo J M,Johnson J E,et al.Soil warming alters nitrogen cycling in a New England forest:implications for ecosystem function and structure[J].Oecologia,2012,168(3):819-828.
[4] Li J,Wang G,Allison S D,et al.Soil carbon sensitivity to temperature and carbon use efficiency compared across microbial-ecosystem models of varying complexity[J].Biogeochemistry,2014,119(1-3):67-84.
[5] Van Der Heijden M G,Bardgett R D,Van Straalen N M.The unseen majority:soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems[J].Ecology Letters,2008,11(3):296-310.
[6] Amend A S,Martiny A C,Allison S D,et al.Microbial response to simulated global change is phylogenetically conserved and linked with functional potential[J].ISME Journal,2016,10(1):109-118.
[7] Clemmensen K E,Michelsen A,Jonasson S,et al.Increased ectomycorrhizal fungal abundance after long-term fertilization and warming of two arctic tundra ecosystems[J].New Phytologist,2006,171(2):391-404.
[8] Quichimbo P,Tenorio G,Borja P, et al.Effects about the physical and chemical soil properties by the vegetal coverage and land use chance:Páramo of Quimsacocha at the southern Ecuador[J].Suelos Ecuatoriales,2012,42(2):138-153.
[9] McNamara N P,Black H I J,Beresford N A,et al.Effects of acute gamma irradiation on chemical,physical and biological properties of soils[J].Applied Soil Ecology,2003,24(2):117-132.
[10] Treseder K K,Marusenko Y,Romero-Olivares A L,et al.Experimental warming alters potential function of the fungal community in boreal forest[J].Global Change Biology,2016,22(10):3395-3404.
[11] Deslippe J R,Hartmann M,Mohn W W,et al.Long-term experimental manipulation of climate alters the ectomycorrhizal community of Betula nana in Arctic tundra[J].Global Change Biology,2011,17(4):1625-1636.
[12] Moore J C,Mccann K,Setälä H,et al.Top-down is bottom-up:does predation in the rhizosphere regulate aboveground dynamics?[J].Ecology,2003,84(4):846-857.
[13] Paterson E,Osler G,Dawson L A,et al.Labile and recalcitrant plant fractions are utilised by distinct microbial communities in soil:Independent of the presence of roots and mycorrhizal fungi[J].Soil Biology and Biochemistry,2008,40(5):1103-1113.
[14] Ferlian O,Cesarz S,Marhan S,et al.Carbon food resources of earthworms of different ecological groups as indicated by13C compound-specific stable isotope analysis[J].Soil Biology and Biochemistry,2014,77:22-30.
[15] Allison S D,Treseder K K.Warming and drying suppress microbial activity and carbon cycling in boreal forest soils[J].Global Change Biology,2008,14(12):2898-2909.
[16] Xiong J,Chu H,Sun H,et al.Divergent responses of soil fungi functional groups to short-term warming[J].Microbial Ecology,2014,68(4):708-715.
[17] Martiny A C,Treseder T,Pusch G.Phylogenetic conservatism of functional traits in microorganisms[J].ISME Journal,2013,7(4):830-838.
[18] Tagawa M,Tamaki H,Manome A,et al.Isolation and characterization of antagonistic fungi against potato scab pathogens from potato field soils[J].Fems Microbiology Letters,2010,305(2):136-142.
[19] El-Elimat T,Figueroa M,Raja H A,et al.Benzoquinones and terphenyl compounds as phosphodiesterase-4B inhibitors from a fungus of the order Chaetothyriales(MSX 47445)[J].Journal of Natural Products,2013,76(3):382-387.
[20] Fan F,Li Z,Wakelin S A,et al.Mineral fertilizer alters cellulolytic community structure and suppresses soil cellobiohydrolase activity in a long-term fertilization experiment[J].Soil Biology and Biochemistry,2012,55(6):70-77.
[21] Atkinson T J,Miller A N,Huhndorf S M,et al.Unusual new Chaetosphaeria species from New Zealand:intrafamilial diversity and elucidations of the Chaetosphaeriaceae-Lasiosphaeriaceae relationship(Sordariomycetes,Ascomycotina)[J].New Zealand Journal of Botany,2007,45(4):685-706.
[22] Lawrey J D,Diederich P,Sikaroodi M,et al.Remarkable nutritional diversity of basidiomycetes in the Corticiales,including a new foliicolous species of Marchandiomyces(anamorphic Basidiomycota,Corticiaceae)from Australia[J].American Journal of Botany,2008,95(7):816-823.
[23] Wagner L,Stielow B,Hoffmann K,et al.A comprehensive molecular phylogeny of the Mortierellales(Mortierellomycotina)based on nuclear ribosomal DNA[J].Persoonia,2013,30(3):77-93.
[24] Hansen K,Perry B A,Dranginis A W,et al.A phylogeny of the highly diverse cup-fungus family Pyronemataceae(Pezizomycetes,Ascomycota)clarifies relationships and evolution of selected life history traits[J].Molecular Phylogenetics and Evolution,2013,67(2):311-335.
[25] Lozupone C A,Klein D A.Molecular and cultural assessment of chytrid and Spizellomyces populations in grassland soils[J].Mycologia,2002,94(3):411-420.
[26] Wei W,Isobe K,Shiratori Y,et al.Development of PCR primers targeting fungal nirK to study fungal denitrification in the environment[J].Soil Biology and Biochemistry,2015,81(4):282-286.
[27] Bunemann E K,Smernik R J,Doolette A L,et al.Forms of phosphorus in bacteria and fungi isolated from two Australian soils[J].Soil Biology and Biochemistry,2008,40(7):1908-1915.
[28] Walker J F,Aldrich-Wolfe L,Riffel A,et al.Diverse Helotiales associated with the roots of three species of Arctic Ericaceae provide no evidence for host specificity[J].New Phytologist,2011,191(2):515-527.
[29] Yang T,Groenewald J Z,Cheewangkoon R,et al.Families,genera,and species ofBotryosphaeriales[J].Fungal Biology,2017,121:(4)322-346.
