醒脑静注射液联合还原型谷胱甘肽对肝性脑病病人IL-6和IL-18表达的影响
2018-04-27闫建汶
闫建汶
肝性脑病是临床中较为常见的以代谢紊乱为基础,并由门静脉-体循环异常或肝功能障碍诱发的神经精神异常综合征[1]。有研究指出,氨中毒是导致肝性脑病发病的主要因素,肝功能异常病人体内血氨水平处于异常状态,有研究指出,肝性脑病的病变程度与血氨水平存在一定关系[2-3]。近年来有学者提出,炎症反应可有效调节氨对星形细胞的生理及病理活性,炎性因子有可能参与调控肝性脑病的发生与发展[4]。醒脑静注射液及还原型谷胱甘肽是临床中治疗肝性脑病的最为有效的方法之一[5]。但两者联合使用对病人血清炎性细胞因子的影响鲜有报道,现分析我院2014年3月—2016年3月收治的40例肝性脑病病人临床资料,分析醒脑静注射液联合还原型谷胱甘肽在治疗肝性脑病时,对病人白介素-6(IL-6)及白介素-8(IL-18)的影响,为临床推广应用提供依据。
1 资料与方法
1.1 临床资料 选取我院2014年3月—2016年3月收治的肝性脑病病人80例作为研究对象,将所有病人依照入院顺序编号,采用随机信封法分为观察组和对照组,每组40例。观察组中男性22例,女性18例;年龄32岁~75岁(56.86岁±10.21岁);26例为乙型肝炎肝硬化,2例为隐源性肝硬化,1例为原发性胆汁性肝硬化,11例为酒精性肝硬化;18例为临床Ⅰ期,12例为临床Ⅱ期,6例为临床Ⅲ期,4例为临床Ⅳ期[6]。对照组中男性25例,女性15例;年龄35岁~73岁(55.62岁±9.48岁);26例为乙型肝炎肝硬化,1例为隐源性肝硬化,3例为原发性胆汁性肝硬化,10例为酒精性肝硬化;21例病人为临床Ⅰ期,10例为临床Ⅱ期,5例为临床Ⅲ期,4例为临床Ⅳ期。两组性别、年龄、病因及临床分期差异无统计学意义(P>0.05),分组合理,具有可比性。所有病人均对本研究知情,并签署知情同意书。本研究经我院伦理委员会批准。
1.2 纳入标准 临床症状符合《临床肝胆系病学(新版)》肝性脑病标准[6];临床分期明确,且处于Ⅰ期~Ⅳ期;均为慢性肝炎肝硬化诱发的肝性脑病。
1.3 排除标准 近期出现酒精中毒或服用镇静剂;并发肾功能异常、糖尿病及心肺疾病;心理及精神异常;临床资料缺失,或主动申请退出本研究。
1.4 治疗方法 对照组在入组后即进行补充白蛋白、去除诱因、限制蛋白摄入、维持电解质平衡等基本对症治疗。调整饮食结构,维持负氮平衡,充分补充蛋白质;纠正酸碱平衡和电解质平衡,并定期进行血气分析和血清电解质分析,及时进行纠正。使用乳梨醇、乳果糖进行干预,避免肠道氨吸收和生成。观察组在对照组治疗基础上加用醒脑静注射液联合还原型谷胱甘肽进行干预,250 mL葡萄糖注射液联合20 mL醒脑静注射液(无锡济民可信山禾药业股份有限公司,批号:Z32020563),250 mL生理盐水联合0.6 g还原型谷胱甘肽(山东绿叶制药有限公司,批号:H20030002)静注,每天1次,以10 d为1个疗程,共干预治疗2个疗程。
1.5 观察指标 在病人入院第一天及治疗第11天、治疗第21天时检测血清中IL-6和IL-18水平,并在治疗结束一周后对病人进行随访,观察临床疗效。
1.5.1 IL-6及IL-18检测方法 在入院第一天、治疗第11天及治疗第21天时采集病人空腹静脉血5 mL,静置5 min,3 000 r/min离心5 min收集血清,使用酶联免疫吸附试剂盒检测血清中IL-6及IL-18水平,严格依照说明书进行操作。本组研究使用试剂盒均购自美国Rapidbio公司。
1.5.2 疗效评价标准[7]在病人结束治疗1周后,观察治疗临床疗效。显效:临床体征及症状改善显著,意识清醒,天门冬酸氨基转移酶(ALT)、丙氨酸氨基转移酶(AST)及总胆红素(TBiL)水平降低50%以上;有效:临床体征及症状有一定程度改善,意识有一定程度改变,但未完全清醒,ALT、AST及TBiL水平降低30%~50%;无效:临床体征及症状无改善,ALT、AST及TBiL水平无明显改善。
2 结 果
2.1 血清中IL-6水平检测结果 治疗前两组血清中IL-6水平比较无统计学意义(P>0.05),治疗11 d及治疗21 d时,观察组血清中IL-6水平显著低于对照组(P<0.05)。详见表1。
表1 两组血清中IL-6水平检测结果(±s) pg/mL
2.2 血清中IL-18水平检测结果 治疗前两组IL-18水平比较无统计学意义(P>0.05),治疗11 d及治疗21 d时,观察组血清中IL-18水平均明显低于对照组,且差异有统计学意义(P<0.05)。详见表2。
表2 两组血清中IL-18水平检测结果(±s) pg/mL
2.3 两组病人临床疗效 观察组显效率明显高于对照组(P<0.05),有效率对照组显著高于观察组(P<0.05)。详见表3。
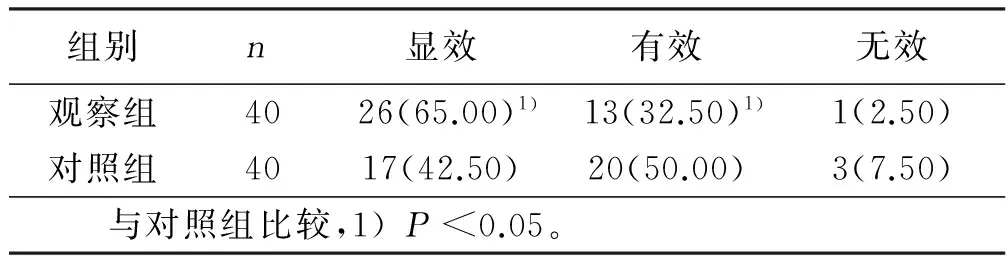
表3 两组临床疗效结果 例(%)
3 讨 论
肝性脑病是临床中常见的肝硬化常见并发症,也是病人死亡主要诱因之一。传统中医理论认为,肝性脑病多属于“闭症”“厥证”范畴,肝脏受湿热疫毒侵袭影响出现肝失调达,最终导致肝性脑病的发生[6]。合理有效的治疗方案可有效提高肝性脑病病人的生存质量,降低临床病死率[7]。醒脑静注射液是遵照传统中医理论开发的中成药,由郁金、麝香、栀子、冰片4味药组成,具有凉血解毒、清热泻火、开窍醒脑的功效[8]。在临床中主要用于治疗神昏谵语、高热烦躁、舌绛脉数为主的肝昏迷及乙型脑炎等[9]。还原型谷胱甘肽是人细胞质合成的生物活性肽之一,由半胱氨酸、谷氨酸及甘氨酸构成,在人体内诸多器官及脏器内广泛分布,对维持生理正常功能具有十分重要的作用[10]。
有研究表明,醒脑静注射液可降低病人的血脑屏障通透性,使药物有效成分通过血脑屏障直接作用于脑部中枢神经,保护大脑基本功能,调节中枢神经,改善脑部微循环[11]。有研究表明,醒脑静注射液联合还原型谷胱甘肽在治疗肝性脑病时具有较好的临床疗效,其可通过调节中枢神经系统、保护脑部功能、减轻脑水肿、抑制细胞病理学凋亡、改善脑循环等途径实现治疗肝性脑病的作用[12]。本研究结果显示,醒脑静注射液联合还原型谷胱甘肽治疗肝性脑病病人临床疗效显著提高,与王丽等[13]研究结果相似。分析认为,醒脑静注射液联合还原型谷胱甘肽对肝性脑病病人进行治疗时可起到协同作用,在保护病人脑部功能的同时,还可有效对病因进行干预,因而其临床疗效显著提高。
近年来,有研究表明,炎性细胞因子在肝性脑病的发生及发展过程中扮演着十分重要的角色[14]。肝性脑病病人血清中IL-6及IL-18水平异常高于健康人,且肝性脑病病人血清中IL-6及IL-18水平与病程呈正性相关[15]。本组结果提示,两组病人IL-6及IL-18水平均明显降低,且治疗后观察组病人IL-6及IL-18下降水平显著高于对照组。在对肝性脑病病人进行治疗时,采用醒脑静注射液联合还原型谷胱甘肽干预可有效降低血清中炎性细胞因子水平,改善微循环,有利于改善血氨水平,提高临床疗效。醒脑静注射液联合还原型谷胱甘肽干预后可有效调节免疫功能,降低炎性因子的表达与激活;此外,可控制血氨水平,调节氮代谢,维持脑部及肝部微环境稳定性,降低星形细胞及内皮细胞的激活,控制相关炎症因子前提表达,减缓病人炎症反应的发生和损伤。
采用醒脑静注射液联合还原型谷胱甘肽进行治疗肝性脑病可有效提高临床疗效,降低血清中IL-6及IL-18水平。但本组研究临床样本数较少,还有待于扩大临床样本量深入研究。
参考文献:
[1] 中华医学会消化病学分会,中华医学会肝病学分会.中国肝性脑病诊治共识意见(2013年,重庆)[J].中华肝脏病杂志,2013,21(9):641-651.
[2] 陈东风,孙文静.肝性脑病发病机制的研究进展[J].中华肝脏病杂志,2014,22(2):84-85.
[3] 张绪清.肝性脑病的预防与治疗进展[J].实用肝脏病杂志,2014,17(2):121-124.
[4] 郑常龙,杨小安,邹勇,等.肝性脑病病人血清中IL-6和IL-18的表达及意义[J].中华实验和临床病毒学杂志,2014,28(5):333-335.
[5] 钟毅欣,赵建农.静息态脑功能网络分析方法及在肝性脑病的研究进展[J].国际医学放射学杂志,2015,38(6):516-519.
[6] 巫协宁,曾民德,邱德凯.临床肝胆系病学[M].上海:上海科学技术文献出版社,2002:1-5.
[7] 贾继东,胡中杰.肝性脑病的诊断和治疗[J].现代消化及介入诊疗,2005,10(2):91-95.
[8] 火雷鸣.醒脑静对脑出血患者脑损害的保护作用[J].中国老年学杂志,2015,35(2):514-515.
[9] 姚书燕,刘海花,韩文颖,等.醒脑静联合肌氨肽苷治疗缺血性脑卒中的临床疗效研究[J].实用心脑肺血管病杂志,2016,24(2):87-90.
[10] 罗润嫦,欧列斌,赖永娥,等.醒脑静注射液治疗急性脑出血疗效观察及对患者血浆纤维蛋白原和D-二聚体水平的影响[J].中国药师,2015,18(9):1542-1544.
[11] 张继翱.醒脑静注射液在临床急症中的应用进展[J].现代中西医结合杂志,2013,22(17):1937-1938.
[12] 俞济民.经鼻正压通气联合醒脑静治疗肺性脑病的临床研究[J].医学综述,2014,20(9):1723-1725.
[13] 王丽,唐冬云,阮玉泉,等.醒脑静辅助卡马西平治疗脑卒中后继发性癫痫的临床疗效及安全性评价[J].医学综述,2015,21(17):3243-3245.
[14] Coltart I,Tranah TH,Shawcross DL,et al.Inflammation and hepatic encephalopathy (review)[J].Archives of Biochemistry and Biophysics,2013,536(2):189-196.
[15] Tranah TH,Vijay GK,Ryan JM,et al.Systemic inflammation and ammonia in hepatic encephalopathy[J].Metabolic Brain Disease,2013,28(1):1-5.
