JAK2/STAT3通路对大鼠脑出血周围组织VEGF165等的保护作用
2018-04-27袁志俊何晓英李娇红李小刚
袁志俊,何晓英,李娇红,李小刚
蛋白酪氨酸激酶2/信号转导和转录激活因子3 (janus kinase 2-signal transducer and activator of transcription 3,JAK2/STAT3)通路是细胞内信号通路,它介导了多种因子的信号传导,如干扰素(IFN)白介素-2、表皮性生长因子(EGF)、血小板衍生因子(PDGF)、G-CSF、血管内皮生长因子(VEGF)等的共同通路,在血管生成、细胞增殖分化、凋亡以及免疫调节等过程中发挥着重要作用。研究表明,JAK2/STAT3通路激活与脑损伤密切相关,它参与脑出血、脑缺血、蛛网膜下隙出血等的调控[1-2]。α-氰基-(3,4-羟基)N-苄苯乙烯胺[Alpha cyano-(3-hydroxy)] N-styrene benzyl amine,AG-490)是JAK2/STAT3信号通路的特异性拮抗剂,结构类似酪氨酸,可以和受体酪氨酸激酶竞争结合位置,抑制应激反应时STAT3的磷酸化,从而降低STAT3的活性[3]。VEGF又称血管通透因子(VPF),是胎儿和成人血管发生和血管生成过程中重要的调控因子。VEGF是特异性作用于内皮细胞的糖基化细胞有丝分裂素,在增强血管的渗透性、诱导血管发生和血管生成及内皮细胞生长、促进细胞迁移、抑制细胞凋亡等方面发挥作用。由于mRNA不同的剪切方式,产生了VEGF121、VEGF145、VEGF165、VEGF183、VEGF189和VEGF206等6种蛋白形式。其中VEGF165是人类组织中VEGF主要的基因产物,也是VEGF家族中最重要的血管生成调节因子。李耀汝等[4]研究表明, JAK2/STAT3信号通道可能参与介导脑缺血小鼠VEGF的表达。Dong等[5]研究表明:AG-490可抑制STAT3的磷酸化,进而减少VEGF mRNA的表达,导致VEGF蛋白的表达减少,抑制脑卒中诱导的血管生成。本实验使用AG-490干预,检测血肿周围VEGF165及磷酸化JAK2(P-JAK2)、磷酸化STAT3(P-STAT3)的表达变化,旨在探讨JAK2/STAT3途径在脑出血后血管生成的作用,为明确脑出血后的血管变化情况及机制提供治疗指导。
1 材料与方法
1.1 实验动物 健康SD大鼠75只,体质量200 g~320 g,鼠龄(3~4)个月,由西南医科大学实验动物中心提供。将实验动物随机分为假手术组、脑出血组和AG-490干预组,各组25只。按造模成功后时间将各组大鼠再分为6 h、24 h、48 h、72 h、7 d共5个亚组,每亚组5只。1.2 实验试剂与仪器 VEGF165抗体、P-JAK2和P-STAT3单克隆抗体、AG-490、SDS-PAGE凝胶、5%牛血清白蛋白、SABC免疫组化染色试剂盒、DAB显色试剂盒购自巴傲得生物科技有限公司。鼠脑立体定向仪(由西南医科大学中心实验室提供),50 μL微量注射仪购自世界精密仪器商贸(上海)有限公司,其他仪器包括Olympus光学显微镜、光学显微镜照相系统、Image-J图像分析系统等。
1.3 实验方法
1.3.1 脑出血模型制备 采用改良的二次注入法建立脑出血模型[6]。以尾动脉为供血动脉,有一定创伤,但不影响大鼠肢体的功能,行为学评分更准确,成功率高。术毕根据Longa等[7]5级评定方法进行神经功能缺损评分,1分~3分为脑出血造模成功。AG-490组大鼠于造模成功后立即给予腹腔注射AG-490(0.15 mg/kg),共3 d。假手术组大鼠按相同方案注入等量生理盐水。
1.3.2 神经功能缺损评分(NSS) 采用Garcia等[8]NSS评分标准,包括运动、感觉、平衡测试、反射消失或不正常运动、行走。18 分为正常,13分~17分为轻度损害,7分~12 分为中度损害,1分~6分为重度损害。
1.3.3 免疫组化 采用免疫组织化学法检测VEGF165蛋白的表达。选择5个不重叠的血肿区域采集图像,然后用Image-Pro-Plus5.0软件分析蛋白阳性表达的累积光密度值,并计算平均值。
1.3.4 Western blotting检测 采用Western blotting检测P-JAK2和P-STAT3的表达,实验步骤严格按说明书进行。分析蛋白条带的相对密度。
2 结 果
2.1 各组NSS评分比较 各时间点脑出血组和AG-490组NSS评分均低于假手术组(P<0.05),AG-490组NSS评分高于脑出血组(P<0.05)。脑出血和AG-490组大鼠造模成功后48 h神经功能缺损最严重(P<0.05)。详见表1。
表1 各组大鼠造模成功后不同时间NSS评分比较(±s) 分
2.2 各组免疫组化情况 假手术组可见较少量VEGF165表达;脑出血组和AG-490组6 h血肿周围可见少量VEGF165表达,48 h达高峰(P<0.05),7 d仍有少量表达,各时间点表达均高于假手术组(P<0.05),AG-490组各时间点VEGF165表达均低于脑出血组(P<0.05)。详见表2、图1。
表2 各组大鼠造模成功后不同时间点VEGF165的表达(±s)
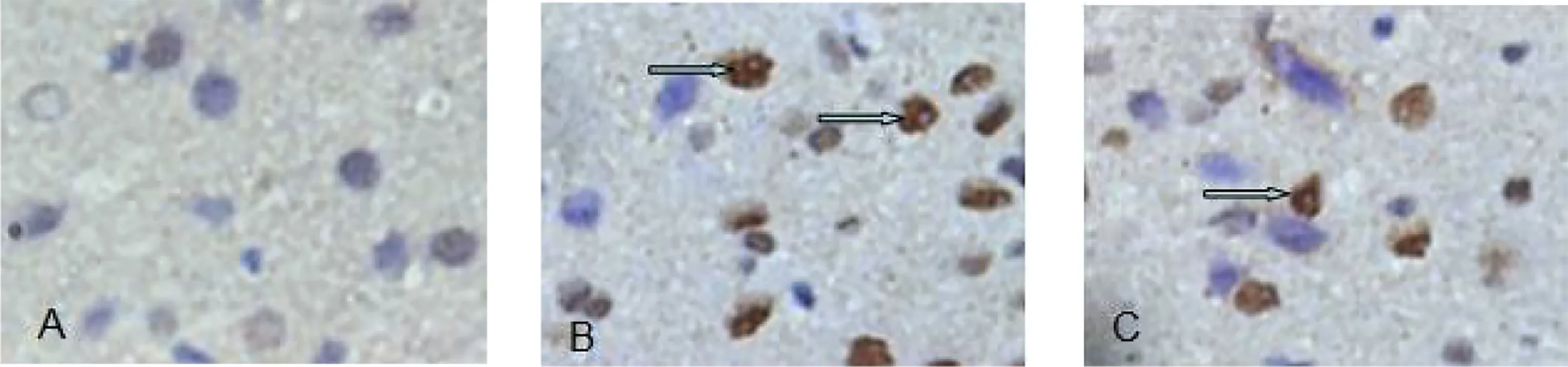
A为假手术组;B为脑出血组;C为AG-490组;箭头所示为VEGF165阳性细胞。
2.3 各组Western blotting检测 各组大鼠血肿周围组织P-JAK2和P-STAT3表达变化趋势与VEGF165变化一致。详见表3、表4和图2。
表3 各组大鼠造模成功后不同时间点P-JAK2表达的相对吸光度值比较 (±s)
表4 各组大鼠造模成功后不同时间点P-STAT3表达的相对吸光度值比较(±s)
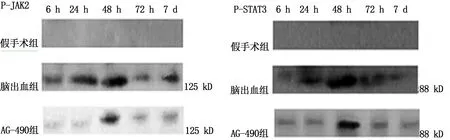
图2 各组大鼠血肿周围P-JAK2和P-STAT3表达
2.4 相关性分析 脑出血组大鼠NSS评分与VEGF163表达呈负相关(r=-0.511,P<0.05),VEGF163与P-JAK2、P-STAT3的表达呈正相关(r=0.562,P<0.05;r=0.479, P<0.05)。
3 讨 论
JAK2/STAT3信号传导是指细胞外的刺激激活信使物质,激活的信使识别并结合于胞膜的受体,同时诱导其在胞浆内形成JAK2结合位点并使JAK2发生磷酸化并暴露STAT3的锚定点,从而STAT3磷酸化而活化并移向胞核内,完成与目的基因的信号传导和表达调控[9-10]。因此,通过测定 P-JAK2和P-STAT3蛋白的表达,可以动态了解JAK2/STAT3信号通路的活化情况。AG-490可以选择性拮抗JAK2酪氨酸磷酸化,有效阻断其下游信号转导和转录因子STAT3的活化,最终阻断JAK2/STAT3信号通路[3]。AG-490能影响人的多项生命活动,如可显著缩小脑梗死面积,减少细胞凋亡,改善神经功能缺损;亦可抑制骨髓瘤淋巴细胞的增殖,诱导细胞凋亡等[11]。有实验结果显示[2]:大鼠脑出血后脑组织P-JAK2、P-STAT3表达增多,JAK2/STAT3通路激活,其可能参与脑损伤的过程;P-JAK2和P-STAT3在AG-490组表达较假手术组高,而较脑出血组低,表明AG-490能有效地阻断JAK2/STAT3信号通路。
VEGF发现于1989年,是一种能特异作用于血管内皮细胞的生长因子,是目前公认为作用最强、特异性最高的一种促血管生成因子。VEGF家族成员包括:VEGF-A、VEGF-B、胎盘生长因子(PIGF)、VEGF-C、VEGF-D、VEGF-E、VEGF-F和它们的受体VEGFR1、VEGFR2、VEGFR3及Neuropilins,VEGF受体特异性地分布于血管内皮等细胞,VEGF通过与其受体的结合而发挥促进血管新生和增强血管通透性的生理功能。在人类,VEGF-A占主导作用,其共有8种亚型,包括:VEGF121,VEGF145,VEGF148,VEGF165,VEGF165b,VEGF 183,VEGF 189和VEGF206,其中VEGF 121和VEGF 165是主要的分泌亚型[12-13]。VEGF165是由165个氨基酸组成的糖蛋白,是一种分泌性生长因子,广泛地存在于多种组织细胞中,不仅具有促进血管生成活性,而且其表达产物是可溶性的,表达后可从细胞中分泌出来,扩散性强,易到达靶细胞,能很好地发挥生物学活性[14]。李耀汝等[4]实验结果显示,JAK2/STAT3信号通路参与脑缺血后血管的生成等许多重要的生物学过程,而血管的生成有助于神经血管网络重塑,促进脑缺血后行为功能改善。本实验结果显示:AG-490组NSS评分较假手术组低,较脑出血组高,P-JAK2、P-STAT3、VEGF165的表达较假手术组高,而较脑出血组低,且P-JAK2、P-STAT3与VEGF165的表达呈正相关,表明在SD大鼠造模后腹腔注射通道阻断剂AG-490,可下调VEGF165在大鼠血肿周围的表达,阻断脑出血后的血管生成,进而产生神经保护作用,此作用可能由JAK2/STAT3参与介导。Dong等[5]研究梓醇对脑卒中后大鼠神经功能保护作用的机制时发现:AG-490可抑制STAT3的磷酸化,进而减少VEGF mRNA表达,导致VEGF蛋白表达减少,抑制脑卒中诱导血管生成,与本实验结果一致。
JAK2/STAT3信号通路可能通过上调VEGF165的表达,促进大鼠脑出血后血肿周围的血管生成,加快脑损伤后的修复,从而达到神经保护的作用,此研究可为进一步明确脑出血后血管生成在脑损伤后修复过程中的机制及治疗提供新的思路。
参考文献:
[1] Chen G,Zhang S,Shi J,et al.Effects of recombinant human erythropoietin(rhEPO) on JAK2/STAT3 pathway and endothelial apoptosis in the rabbit basilar artery after subarachnoid hemorrhage[J].Cytokine,2009,45(3):162-168.
[2] 袁志俊,李小刚,何晓英.JAK2/STAT3通路介导热休克蛋白70对脑出血的神经保护作用[J].中国神经免疫和神经病学杂志,2016,1(17):14-18.
[3] Nomura N,Nunes P,Bouley R,et al.High-throughput chemical screening identifies AG-490 as a stimulator of aquaporin 2 membrane expression and urine concentration[J].Am J Physiol Cell Physiol,2014,307(7):597-605.
[4] 李耀汝,张祥建.注射用丹参多酚酸通过JAK2/STAT3信号通路促进脑缺血小鼠血管生成及改善行为功能[D].石家庄:河北医科大学,2015.
[5] Dong W,Xian Y,Yuan W,et al.Atalpol stimulates VEGF production via the JAK2/STAT3 pathway to improve angiogenesis in rats’stroke model[J].J Ethnopharmacol,2016,7(16):303-307.
[6] 王敏忠,刘雪平,付庆喜,等.大鼠缓慢注射自体血脑出血模型的改良[J].中风与神经疾病杂志,2008,25 (3):330-332.
[7] Long EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[8] Garcia JH,Wagner S,Liu KF,et al.Neurological deficit and extent of neuronal necrosis attributable to middle cerebral artery occlusion in rat statistical validation[J].Stroke,1995,26(4):627-635.
[9] Lai SY,Johnson FM.Defining the role of the JAK-STAT pathway in head and neck and thoracic malignancies:implications for future therapeutic approaches[J].Drug Resist Updat,2010,13(3):67-78.
[10] 徐海发,蒋晶晶,马静萍.重组人粒细胞集落刺激因子对大鼠脑缺血再灌注损伤后p-JAK2及p-STAT3信号通路的影响[J].中国神经免疫学和神经病学杂志,2014,21(4):273-277.
[11] 张合鹏,杜爱玲,李磊,等.AG490对大鼠脑损伤后血-脑屏障通透性及白细胞介素6和肿瘤坏死因子α表达的影响[J].中国脑血管病杂志,2015,3(12):134-139.
[12] Bulysheva AA,Hargrave B,Burcus N,et al.Vascular endothelial growth factor-A gene electrotransfer promotes angiogenesis in a porcine model of cardiac ischemia[J].Gene Ther,2016,4(14):1023-1027.
[13] 张会玲,李世英,李峥,等.缺血预适应对局灶性脑缺血再灌注大鼠皮质区低氧诱导因子-1α和血管内皮生长因子表达的影响[J].医学研究生学报,2015,7(28):701-705.
[14] Zhao M,Xie WK,Bai YJ,et al.Expression of total vascular endothelial growth factor and the anti-angiogenic VEGF 165 bisoform in the vitreous of patients with retinopathy of prematurity[J].Chin Med J(Engl),2015,128(18):2505-2509.
