类风湿关节炎患者血清IL-34水平与骨质疏松的相关性
2018-04-27李会芳马慧娟
李会芳 马慧娟
1.冀中能源邢台矿业集团总医院内科;2.冀中能源邢台矿业集团总医院检验科,河北邢台 054000
类风湿性关节炎(RA)以侵蚀性、对称性多关节炎为主要临床特征,患者病理基础除滑膜炎、血管炎外,往往合并进行性关节软骨及骨质破坏[1]。因此,骨质疏松是RA患者最常见的并发症之一,且有报道指出,病程不足10个月的RA患者中,合并骨质疏松比例高达50%以上[2]。然而,当前临床对于RA及骨质疏松的发生机制尚无明确阐释,鉴于RA病理过程中剧烈的免疫炎症反应,多数学者认为,以白细胞介素-34(IL-34)为代表的细胞因子,可能参与了巨噬细胞分化与破骨细胞生成过程,进而影响骨质疏松的发生与发展[3]。为验证这一假设,此次研究选取152例RA患者及90名健康体检者进行了对照分析,现予报道。
1 资料与方法
1.1 一般资料
参照2010年版美国风湿病学会(ACR)/欧洲抗风湿病联盟(EULAR)[4]诊断标准确诊152例RA患者 纳入患者组;同时选取90名健康体检者,在征得其知情同意后纳入对照组。两组受试者均排除合并内分泌系统疾病、恶性肿瘤、血液系统疾病者以及长期服用免疫抑制剂、抗凝药物或影响骨代谢药物者。患者组男109例,女43例,年龄22~75岁,平均(47.38±11.57)岁;对照组男61名,女29名,年龄24~74岁,平均(46.95±10.32)岁。两组受试者年龄、性别比例比较,差异无统计学意义(P>0.05),具有可比性。此次研究已征得我院医学伦理委员会批准。
1.2 检测方法
使用Lunar DPX-IQ双能X线骨密度检测仪(美国GE公司),对两组受试者骨密度进行检测,检测部位包括腰椎L1~L4前后位以及股骨近端(股骨颈+Ward三角+大转子),骨密度检测结果与同性别峰值骨密度进行比较,计算T值,根据T值判定骨量状态[5-6]:骨量正常:T值≥-1.0;骨量减少:-1.0<T值<-2.5;骨质疏松:T值≤-2.5(合并脆性骨折者,为严重骨质疏松)。
此外,抽取两组受试者入组次日晨起空腹肘静脉血5 mL,使用酶联免疫吸附法(ELISA法)对其血清IL-34水平进行检测[7],试剂盒购自美国R&D公司。
1.3 分析方法
比较患者组、对照组骨密度检测结果以及骨质疏松发生率,并按照患者组骨密度检测结果将其分为骨量正常组、骨量减少组、骨质疏松组,对比其血清IL-34水平,计算IL-34与受试者骨密度以及患者组RA活动度积分的相关性。其中,RA活动度积分计算方法参照改良28关节疾病活动评分(DAS28)[8]:RA活动度积分=[0.56×sqrt(T28)+0.28×sqrt(SW28)+ 0.70×Ln(ESR)]×1.08 + 0.16,其中,T28为肘关节、膝关节等28个关节内触痛关节数,SW28为肿胀关节数,sqrt为开平方根,Ln为取自然对数,ESR为血沉。
1.4 统计学分析
对本临床研究的所有数据采用SPSS18.0进行分析,骨质疏松发生率、性别等计数资料以(n/%)表示,并采用χ2检验,骨密度、血清IL-34水平、RA活动度积分等计量资料以(x±s)表示,并采用t检验,相关性分析采用Pearson法,以P<0.05为差异有统计学意义。
2 结果
患者组骨密度低于对照组,其骨质疏松发生率及血清IL-34水平高于后者,差异有统计学意义(P<0.05)。见表1。随着RA患者骨密度的下降,其血清IL-34水平、RA活动度积分逐渐上升,差异有统计学意义(P<0.05)。见表2。
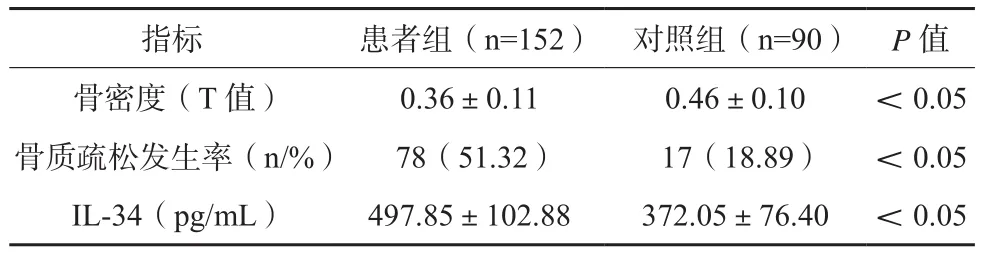
表1 患者组与对照组骨密度、骨质疏松发生率及血清IL-34水平比较(x±s)
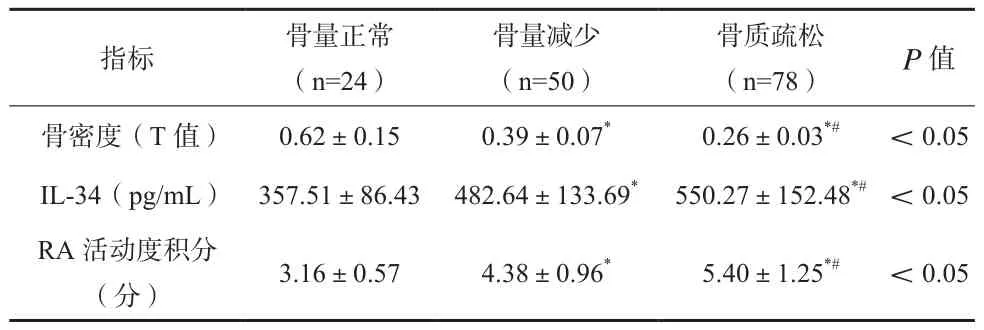
表2 不同骨密度RA患者骨密度及血清IL-34水平比较(x±s)
Pearson相关性分析结果IL-34与RA患者骨密度呈负相关(-0.608,P<0.05),与RA活动度积分呈正相关(0.557,P <0.05)。
3 讨论
作为一种以关节侵蚀破坏为特征的全身性自身免疫性疾病,RA的人群患病率约为0.4%~1.0%,若未得到及时有效的治疗,患者在1~3年内即可进展至关节畸形甚至全身性骨丢失,生活质量受到严重影响[9-10]。与此同时,由于RA的骨丢失与关节破坏特性,患者骨质疏松风险是正常人群的2倍以上,其股骨颈骨质疏松发生率为14.7%,而腰椎骨质疏松发生率高达16.8%[11]。本研究RA患者骨质疏松发生率高达51.32%,显著高于健康体检者的18.89%,印证了RA患者的高骨质疏松风险,与此同时,我国人群骨质疏松患病率也值得重视。既往有学者认为,随着RA患者病程的延长、疾病活动性的增加与病情严重度的加剧,其骨质疏松发生风险呈上升趋势,通常认为,炎症反应所致骨代谢异常可能是造成骨吸收增加、骨形成减少的主要原因[12-13]。
IL-34是21世纪初发现的一种新型细胞因子,被认为在免疫调节、炎症反应和神经保护等环节发挥着重要作用。有报道指出,RA患者血清及关节滑液中均可检出大量IL-34,且血清IL-34浓度变化与白细胞总量、自身抗体及疾病急性期指标有着密切关联[14];一项前瞻性对照分析研究结果亦显示,正常生理条件下,表皮、脾脏、脑组织中IL-34表达量较低,而病理状态下,肿瘤坏死因子-α(TNF-α)及IL-1β均可通过激活c-Jun氨基末端激酶(JNK)、核因子κB(NF-κB)通路,上调IL-34表达水平,进而促进破骨细胞的生成、诱导骨吸收活动[15]。此次研究就RA患者与健康体检者血清IL-34水平进行了对比,结果显示,RA患者不仅骨密度明显低于健康体检者,其血清IL-34水平亦显著升高,且随着患者骨丢失的加剧与病情的进展,其血清IL-34水平进一步上升。与此同时,相关性分析亦显现出IL-34与RA患者骨密度、RA活动度积分的相关性,说明IL-34在RA及骨质疏松的发生发展中均扮演了重要角色,其机制是IL-34可促进IL-6分泌,而IL-6激活NF-κB受体活化因子配体(RANKL)的作用,可介导滑膜巨噬细胞向破骨细胞分化,引发骨丢失[16]。IL-34可刺激成纤维样滑膜细胞(FLS)表达上调,而FLS细胞活化可进一步诱导炎性因子分泌,促进局部免疫细胞的活化与增殖,形成恶性循环,加强破骨细胞活化、诱导促发免疫反应的强大正反馈环出现[17]。此外, IL-34水平变化对25-羟维生素D3浓度的影响,以及IL-34水平增加所致疼痛、活动减少,也可能对RA患者骨密度的下降存在一定影响[18],关于其具体机制,有待进一步探索。
综上所述,RA患者血清IL-34水平较正常人群显著升高,且其骨密度显著下降,同时,IL-34与患者骨密度的负相关性及其与RA活动度积分的正相关性,意味着IL-34在RA及骨质疏松的发生发展中扮演了重要角色。
[1] KLOP C, DE VRIES F, BIJLSMA J W J, et al. Predicting the 10-year risk of hip and major osteoporotic fracture in rheumatoid arthritis and in the general population: an independent validation and update of UK FRAX without bone mineral density[J]. Ann Rheum Dis, 2016, 75(12): 2095-2100.
[2] MCCLU NG M R, GRAUER A, BOONEN S, et al.Romosozumab in postmenopausal women with low bone mineral density[J]. N Engl J Med, 2014, 370(5): 412-420.
[3] 中华医学会风湿病学分会. 类风湿关节炎诊断及治疗指南[J].中华风湿病学杂志, 2010, 14(4):265-270.
[4] ROSSINI M, VIAPIANA O, ADAMI S, et al. In patients with rheumatoid arthritis, Dickkopf-1 serum levels are correlated with parathyroid hormone, bone erosions and bone mineral density[J]. Clin Exp Rheumatol, 2015, 33(1): 77-83.
[5] CHEN J, LIU W, LIN Q, et al. Vitamin D def i ciency and low bone mineral density in native Chinese rheumatoid arthritis patients[J]. Int J Rheum Dis, 2014, 17(1): 66-70.
[6] MORI Y, KUWAHARA Y, CHIBA S, et al. Bone mineral density of postmenopausal women with rheumatoid arthritis depends on disease duration regardless of treatment[J]. J Bone Miner Metab, 2017, 35(1): 52-57.
[7] HAROON N N, SRIGANTHAN J, AL GHANIM N, et al.Effect of TNF-alpha inhibitor treatment on bone mineral density in patients with ankylosing spondylitis: a systematic review and meta-analysis[C]//Seminars in arthritis and rheumatism. WB Saunders, 2014, 44(2): 155-161.
[8] MOCHIZUKI T, YANO K, IKARI K, et al. Correlation between hand bone mineral density and joint destruction in established rheumatoid arthritis[J]. J Orthop, 2017, 14(4): 461-465.
[9] 张玉红, 周俊, 罗莉,等. 人脐带间充质干细胞对类风湿性关节炎患者血清因子及DAS28、HAQ评分的影响[J]. 疑难病杂志 , 2017, 16(4):368-372.
[10] TAKAHASHI K, SETOGUCHI T, TAWARATSUMIDA H, et al. Risk of low bone mineral density in patients with rheumatoid arthritis treated with biologics[J]. BMC Musculoskelet Disord,2015, 16(1): 269.
[11] ORSOLINI G, ADAMI G, ADAMI S, et al. Short-term effects of TNF inhibitors on bone turnover markers and bone mineral density in rheumatoid arthritis[J]. Calcif Tissue Int, 2016, 98(6):580-585.
[12] KUME K, AMANO K, YAMADA S, et al. The effect of tocilizumab on bone mineral density in patients with methotrexate-resistant active rheumatoid arthritis[J].Rheumatology, 2014, 53(5): 900-903.
[13] 高洁, 刘小娟, 孔瑞娜, 等. 类风湿性关节炎患者骨密度及骨代谢生化标志物的变化[J]. 中国骨质疏松杂志, 2015, 21(9):1119-1122.
[14] PACCOU J, MENTAVERRI R, RENARD C, et al. The relationships between serum sclerostin, bone mineral density,and vascular calcification in rheumatoid arthritis[J]. J Clin Endocrinol Metab, 2014, 99(12): 4740-4748.
[15] BLACK R J, SPARGO L, SCHULTZ C, et al. Decline in hand bone mineral density indicates increased risk of erosive change in early rheumatoid arthritis[J]. Arthritis Care Res, 2014, 66(4):515-522.
[16] 李海波, 刘荣清, 池淑红, 等. 肿瘤坏死因子-α拮抗剂对伴有骨量降低的活动性类风湿关节炎患者的骨量影响[J]. 中华风湿病学杂志 , 2015, 19(1): 46-50.
[17] KLEYER A, FINZEL S, RECH J, et al. Bone loss before the clinical onset of rheumatoid arthritis in subjects with anticitrullinated protein antibodies[J]. Ann Rheum Dis, 2014,73(5): 854-860.
[18] BRIOT K, ROUANET S, SCHAEVERBEKE T, et al. The effect of tocilizumab on bone mineral density, serum levels of Dickkopf-1 and bone remodeling markers in patients with rheumatoid arthritis[J]. Joint Bone Spine, 2015, 82(2): 109-115.
