血清乳酸脱氢酶在急性溶血性贫血诊断及疗效评估中的应用
2018-04-27王英张亚南
王英 张亚南
1.衡水市哈励逊国际和平医院输血科;2.衡水市哈励逊国际和平医院老年病二科,河北衡水 053000
急性溶血性贫血(Acute hemolytic anemia,AHA)是由红细胞短时间内大量破坏引发的贫血,作为一种儿科常见疾病,AHA的持续进展可导致骨髓造血功能失代偿,甚至危及生命[1]。抗人球蛋白试验、Ham试验等溶血筛选试验价值已得到临床肯定,但其耗时久且仅为定性诊断,在评估治疗效果、指导治疗方案调整层面存在较大局限性[2]。乳酸脱氢酶(Lactate dehydrogenase,LDH)是一种存在于组织内的糖酵解酶,红细胞膜、血红蛋白及红细胞酶异常均可导致LDH活性增高,并表现为血清浓度上升[3],故LDH有望成为AHA的初步筛选指标,本研究观察LDH在AHA诊断及疗效评估中应用价值。
1 资料与方法
1.1 一般资料
2014年8月至2017年5月参照第七版诸福棠实用儿科学确诊[4]的118例AHA患儿纳入AHA组,同时期100名体检儿童纳入对照组,两组既往均无溶血性贫血史。AHA组男73例,女45例,年龄6个月~12岁,平均(4.60±1.55)岁;对照组男64名,女36名,年龄8个月~14岁,平均(4.37±1.26)岁。两组受试儿童一般治疗比较,差异无统计学意义(P>0.05)。参照《血液病诊断及疗效标准》[5],按照AHA患儿病情,再分轻度AHA组、中度AHA组、重度AHA组。
1.2 检测方法
抽取空腹肘静脉血2 mL,置于肝素抗凝管内,分离血清,使用AU5800全自动生化分析仪(美国Beckman Coulter公司),选用酶标比色法,检测血清LDH水平,正常参考范围为0~240 U/L[6]。使用GENS全自动血液分析仪(美国Beckman Coulter公司),测定血红蛋白(Hb)含量。
1.3 治疗方案
AHA组患儿口服甲泼尼龙,每日1次,每次4~6 mg/kg,1周后复查Hb,口服药物改为醋酸泼尼松,每日1次,每次1.0~1.5 mg/kg,持续5周。治疗期间持续监测血清Hb,若Hb处于正常范围,每周醋酸泼尼松较上周减量10%;同时常规预防糖皮质激素副作用,必要时根据病情输注红细胞悬液或洗涤红细胞[7]。
治疗后临床疗效评价:完全缓解:临床症状消失,血清胆红素、红细胞计数、网织红细胞比例及Hb均恢复正常,抗人球蛋白试验阴性;部分缓解:Hb>80 g/L,网织红细胞比例<0.05,血清总胆红素≤34 μmol/L,抗人球蛋白试验阴性或较治疗前效价下降[8];无效:临床症状及实验室指标均未见明显改善,抗人球蛋白试验阳性。有效率=(完全缓解例数+部分缓解例数)/总例数×100%。
1.4 统计学分析
对本临床研究的所有数据采用SPSS18.0进行分析,性别、临床疗效等计数资料以(n/%)表示,并采用χ2检验,年龄、血清LDH及Hb等计量资料以(x±s)表示,并采用t检验或F检验,相关性分析采用Pearson法,以P<0.05为差异有统计学意义。
2 结果
2.1 受试儿童入组次日血清LDH及Hb水平比较
AHA患儿血清LDH水平均高于对照组,其血清Hb水平低于后者,随着患儿病情的进展,其血清LDH水平逐渐升高、血清Hb水平逐渐下降,差异有统计学意义(P<0.05)。见表1。Pearson相关性分析显示,血清LDH与Hb水平呈负相关(r=-0.693,P<0.05)。
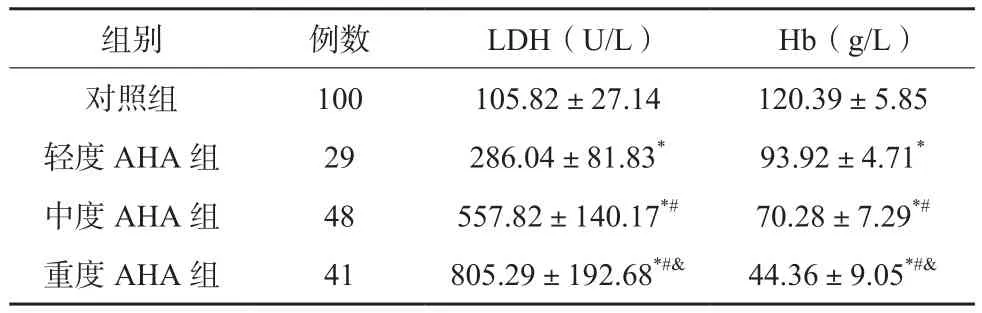
表1 各组入组日次血清LDH及Hb水平比较(x±s)
2.2 疗效评价结果
118例AHA患儿临床总有效率为81.36%(96/118),随着患儿病情的加重,其有效率逐渐下降,差异有统计学意义(P<0.05)。见表2。
2.3 AHA组患儿治疗前后血清LDH及Hb水平变化
AHA组患儿治疗后血清LDH水平均较治疗前下降,完全缓解者血清LDH水平下降最为明显,其次为部分缓解者,差异有统计学意义(P<0.05)。见表3。
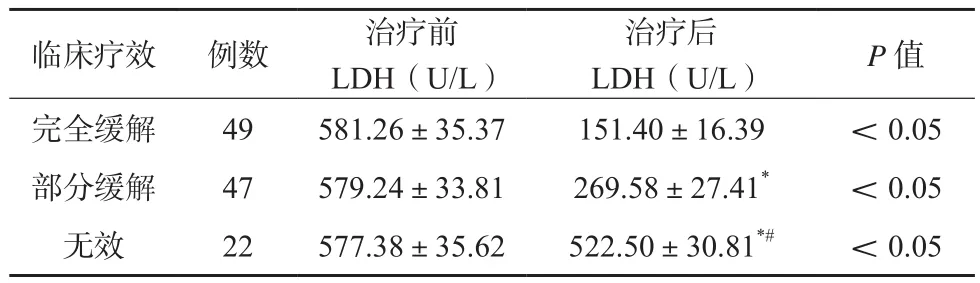
表3 不同疗效评价结果患儿治疗前后血清LDH水平比较(x±s)
3 讨论
人体红细胞的正常寿命大约为120 d,红细胞在自然衰老的过程中,可能因药物、感染等因素而出现提前破坏,造成红细胞动态平衡失衡,即骨髓产生的红细胞数量低于红细胞破坏数量,此时Hb浓度下降,溶血性贫血症状出现[9-10]。
除贫血症状外,AHA患儿还可出现巩膜黄染、肝脾增大、尿色变深等临床症状[11],除了溶血筛查试验外, AHA患儿网织红细胞计数升高、骨髓红系增生活跃等病理生理改变的特异性有限,也无法作为AHA的早期筛查依据[12-13]。既往研究发现,在人为溶血试验中,Hb浓度为10 g/L、30 g/L、50 g/L时,血清LDH活性可出现明显的变化,故有学者认为血清LDH浓度对贫血性疾病的诊断具有一定价值[14]。
此次研究AHA患儿血清LDH水平均普遍高于240 U/L的正常上限,且随着患儿病情的加重,其血清LDH水平进一步上升,说明血清LDH检测有助于AHA的辅助诊断,其机制为:红细胞内LDH含量较高,红细胞破坏1%即可造成血清LDH浓度显著上升,故血清LDH水平能够较为灵敏地反映红细胞增殖、代谢和破坏情况[15]。虽然LDH升高也可见于急性心肌梗死、骨骼肌损伤、急性肝炎、白血病、恶性肿瘤等疾病,但在明确诱因及贫血状态的基础上,若患儿出现黄疸、血红蛋白尿、外周血网织红细胞升高等表现,则不难判断血清LDH升高是由AHA所致[16]。
在了解LDH对于AHA辅助诊断价值的基础上,本研究也对AHA患儿治疗前后血清LDH水平变化进行了观察,结果显示,患儿治疗后LDH下降程度与治疗效果具有密切关联,且血清LDH水平与Hb水平存在负相关性,说明监测血清LDH水平变化对于AHA疗效评估也有着一定价值。作为AHA治疗的常用药物,糖皮质激素的作用机制包括封闭体内抗红细胞抗体、溶解淋巴细胞、抑制单核细胞-巨噬细胞上的IgG及C3受体趋化作用,从而抑制引起溶血的免疫反应、促进红细胞表面IgG的脱落、减少红细胞的吞噬破坏[17]。然而,并不是所有的患儿均可自糖皮质激素治疗中获益[18]。
综上所述,AHA患儿血清LDH普遍升高,且LDH的升高伴随着病情的加重与Hb含量的下降,在检测血清LDH的基础上,结合临床表现及实验室指标有望为AHA的早期筛查与诊断提供参考,同时,监测AHA患儿血清LDH水平变化,可评估治疗效果、指导治疗方案的调整。
[1] AUGOFF K, HRYNIEWICZ-JANKOWSKA A, TABOLA R.Lactate dehydrogenase 5: an old friend and a new hope in the war on cancer[J]. Cancer Lett, 2015, 358(1): 1-7.
[2] MECABO G, YAMAMOTO M, BIASSI T P, et al. Lactate dehydrogenase isoenzyme 3 and hemolysis in sickle cell anemia:a possible correlation?[J]. Blood, 2015, 125(24): 3821-3822.
[3] 王静, 李亚蕊, 郝国平. 研究乳酸脱氢酶在小儿贫血中的变化及诊断价值[J]. 中国医学创新, 2013(10):31-32.
[4] FIUME L, MANERBA M, VETTRAINO M, et al. Inhibition of lactate dehydrogenase activity as an approach to cancer therapy[J]. Future Med Chem, 2014, 6(4): 429-445.
[5] ITO T, AOSHIMA M, SUGIURA K, et al. Pustular psoriasislike lesions associated with hereditary lactate dehydrogenase M subunit def i ciency without interleukin-36 receptor antagonist mutation: long-term follow-up of two cases[J]. Br J Dermatol,2015, 172(6): 1674-1676.
[6] BALLAS S K, JIALAL I, RASHIDI H H, et al. Clinical utility of lactate dehydrogenase in determining the severity of hemolysis in sickle cell anemia[J]. Am J Clin Pathol, 2015,144(1): 173-174.
[7] XIE H, HANAI J, REN J G, et al. Targeting lactate dehydrogenase-a inhibits tumorigenesis and tumor progression in mouse models of lung cancer and impacts tumor-initiating cells[J]. Cell Metab, 2014, 19(5): 795-809.
[8] CETIN B, AFSAR B, DEGER S M, et al. Association between hemoglobin, calcium, and lactate dehydrogenase variability and mortality among metastatic renal cell carcinoma[J]. Int Urol Nephrol, 2014, 46(6): 1081-1087.
[9] 解飞, 洪萍, 周霖,等. 误诊为遗传性球形红细胞增多症的自身免疫性溶血性贫血[J]. 临床误诊误治, 2017, 30(4):52-54.
[10] HUANG R, LI M, GREGORY R L. Nicotine promotes Streptococcus mutans extracellular polysaccharide synthesis,cell aggregation and overall lactate dehydrogenase activity[J].Arch Oral Biol, 2015, 60(8): 1083-1090.
[11] MARKVARDSEN L H, CHRISTIANSEN I, HARBO T,et al. Hemolytic anemia following high dose intravenous immunoglobulin in patients with chronic neurological disorders[J]. Eur J Neurol, 2014, 21(1): 147-152.
[12] DEUTSCH M, DOURAKIS S P, PAPANIKOLOPOULOS K,et al. Autoimmune hemolytic anemia in a patient with acute myelocytic leukemia[J]. Am J Hematol, 2003, 74(2):147.
[13] BRIGHENTI E, CARNICELLI D, BRIGOTTI M, et al. The inhibition of lactate dehydrogenase A hinders the transcription of histone 2B gene independently from the block of aerobic glycolysis[J]. Biochem Biophys Res Commun, 2017, 485(4): 742-745.
[14] 田华, 王金波, 冯万周. LDH及sTfR在成人急性溶血性贫血中的意义[J]. 标记免疫分析与临床, 2016, 23(6): 691-692.
[15] KHENG S, MUTH S, TAYLOR W R J, et al. Tolerability and safety of weekly primaquine against relapse of Plasmodium vivax in Cambodians with glucose-6-phosphate dehydrogenase def i ciency[J]. BMC Med, 2015, 13(1): 203.
[16] CORNEC-LE GALL E, DELMAS Y, DE PARSCAU L, et al.Adult-onset eculizumab-resistant hemolytic uremic syndrome associated with cobalamin C def i ciency[J]. Am J Kidney Dis,2014, 63(1): 119-123.
[17] LIU X, YANG Z, CHEN Z, et al. Effects of the suppression of lactate dehydrogenase A on the growth and invasion of human gastric cancer cells[J]. Oncol Rep, 2015, 33(1): 157-162.
[18] KIM A, FUNG E, PARIKH S G, et al. Isocitrate treatment of acute anemia of inf l ammation in a mouse model[J]. Blood Cells Mol Dis, 2016, 56(1): 31-36.
