术中自体血液回输对红细胞功能影响观察
2018-04-27范涛陈婷婷王江
范涛 陈婷婷 王江
新疆医科大学第一附属医院麻醉科,乌鲁木齐 830054
术中失血一直是危及手术安全性的重大问题,输血对于保证手术顺利开展、挽救急性失血患者生命具有重要意义[1]。然而,当前临床常用的异体输血技术面临着库存血不足且易引发传染性疾病、异体免疫反应的挑战,异体输血对红细胞功能的影响还可导致多器官功能衰竭发生风险大幅上升[2]。自体血液回输在降低溶血反应、避免传染性疾病传播方面的优势已得到广泛认可[3]。此次研究着重分析自体血液回输对患者红细胞功能影响。
1 资料与方法
1.1 一般资料
2015年2月至2017年2月术前预计出血量超过600 mL[4]患者,排除术前合并凝血功能障碍、血小板功能异常者共391例。在征得患者及其家属知情同意后,使用随机数字表法将其分别纳入观察组(n=196,自体血液回输)、对照组(n=195,异体输血)。应用Cell Saver 5+自体血液回收机(美国Haemonetics公司)收集术野血液,以血液:肝素=5:1的比例加入肝素抗凝(抗凝液配置:生理盐水1000 mL+肝素25000 U),置入离心杯内,洗涤、浓缩后,使用Pall LipiGuard SB1自体血液过滤器(美国Biomedical公司)过滤后回输[5]。
1.2 观察指标
比较两组患者输血量、围术期凝血功能变化、血常规变化以及红细胞免疫状态变化、术后异常形态红细胞百分比,其中,凝血功能、血常规观察时点为术前、输血前、输血后。红细胞免疫状态观察时点为术前、术后2 d、术后5 d,观察指标包括红细胞C3b受体(RBC-C3bR)、免疫黏附促进因子(FEER)、协同肿瘤红细胞花环率(ATER)、自然肿瘤红细胞花环率(NTER)[7];红细胞形态于术后3 h制作血细胞涂片,使用电镜观察,不规则红细胞即记为异常红细胞[8]。
1.3 统计学分析
对本临床研究的所有数据采用SPSS18.0进行分析,性别、ASA分级等计数资料以(n/%)表示,并采用χ2检验,年龄、BMI、输血量等计量资料以(x±s)表示,并采用t检验,以P<0.05为差异有统计学意义。
2 结果
观察组术中自体血回输量为(426.38±99.45)mL、库存血用量为(98.91±16.43)mL,对照组术中库存血用量为(451.33±105.24)mL。
两组患者围术期凝血功能均未见明显变化(P>0.05)。见表1。与术前相比,两组患者输血前WBC均升高,RBC、Hb、Hct、PLT均降低,差异有统计学意义(P<0.05);观察组输血后WBC低于对照组,其RBC、Hb、Hct、PLT高于后者,差异有统计学意义(P<0.05)。见表2。
与术前相比,两组患者术后2 d RBC-C3bR、FEER、ATER、NTER均下降,FEIR均上升,对照组变化更为明显,差异有统计学意义(P<0.05);观察组术后5 d各项红细胞免疫状态指标均优于对照组,差异有统计学意义(P<0.05)。见表3。观察组术后红细胞形态异常率为(15.26±3.81)%,低于对照组的(30.75±4.60)%,差异有统计学意义(P<0.05)。
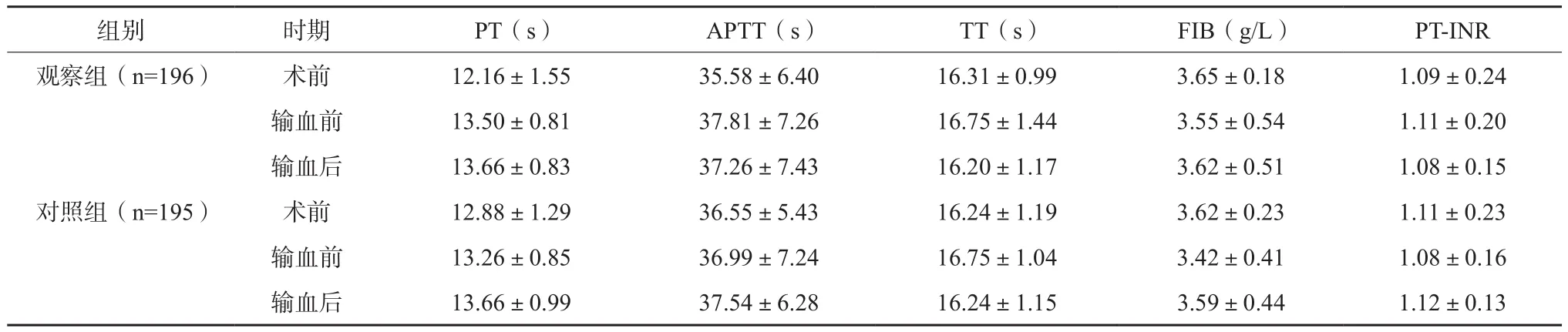
表1 两组患者围术期凝血功能变化比较(x±s)

表2 两组患者围术期血常规变化比较(x±s)
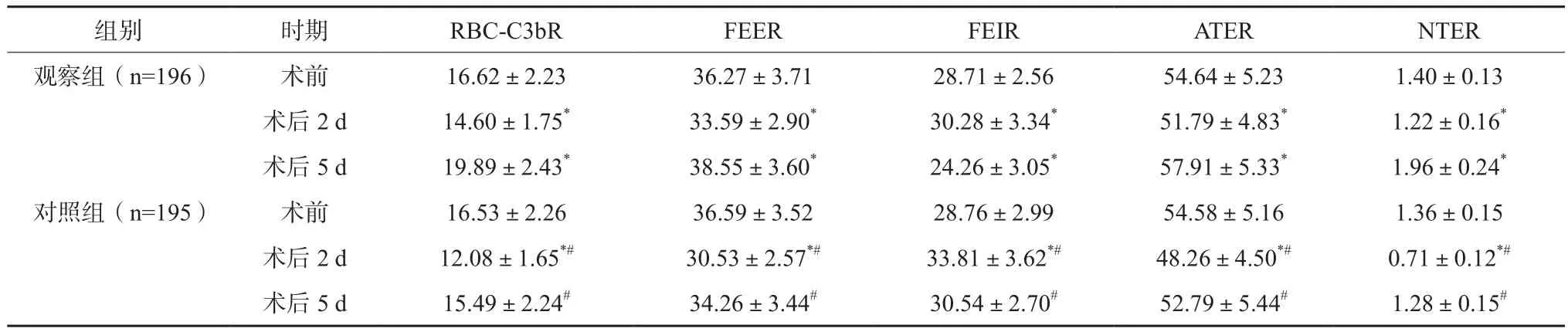
表3 两组患者围术期红细胞免疫状态变化比较(%,x±s)
3 讨论
自19世纪20年代以来,自体血液回输已有所应用[8]。回收患者术中出血,经抗凝、过滤、离心、洗涤等处理后,得到45%~65%浓缩红细胞并回输,可达到补充机体血量、降低异体血输入量、减少输血相关性并发症发生风险的目的[9-10]。
虽然库存血经多重手段检测与处理,但仍无法排除窗口期感染,且当前病毒抗体诊断试剂灵敏度未达到100%,存在漏检可能,故大量库存血的输注不仅易引发过敏、非溶血性输血,还伴随着潜在传染性疾病风险,安全性不够理想[11-12]。因此,术中自体血液回输在保证输血安全性方面的积极作用值得肯定。
既往研究发现,库存血输注对患者凝血功能、血常规带来的影响极有可能引发凝血功能障碍、急性贫血,故注重患者围术期凝血功能与血常规的监测尤为重要[13]。本研究结果示,无论是接受自体血液回输还是库存血输注,两组患者围术期凝血功能均未见明显变化,考虑与此次研究纳入人群肝肾功能良好且术中严格控制肝素与血液输注比例有关[14],此外,凝血功能的实时监测与凝血因子的适时补充,也维持患者凝血功能稳定。患者输血前各项血常规指标均存在明显波动,其原因包括手术失血、应激反应、炎症反应等,同时,术中大量晶体及胶体的输注,也在一定程度上影响着RBC、Hb、Hct等指标的变化[15]。输血后观察组血常规指标改善更为明显且PLT高于对照组。
围术期红细胞的变化可对机体抗感染能力与自身免疫稳定造成明显影响[16]。此次研究中患者术后2 d红细胞免疫状态均出现明显波动,并于术后5 d呈现恢复态势,而与对照组相比,观察组红细胞免疫状态波动更小且恢复更为理想,这是由于自体血液回输不仅能够满足患者血液需求,还可恢复血液粘度与组织氧运力,避免库存血输注所致血红蛋白氧离曲线左移,从而维持机体免疫状态稳定、促进术后各脏器功能早期恢复[17]。此外,本研究对照组术后红细胞形态异常率高于观察组,是由于库存血处理时高速离心、泵管挤压、负压吸引等多种操作对红细胞膜流动性与变形性的影响,也是导致红细胞免疫和粘附功能受损的重要原因之一[18]。
综上所述,现有的自体血液回输技术能够明显降低患者术中库存血输注量,并在维持血常规稳定的基础上降低手术、输血对红细胞功能造成的不良影响,利于节约血液资源、提高手术安全性、促进术后恢复。
[1] NEWMAN E T, WATTERS T S, LEWIS J S, et al. Impact of perioperative allogeneic and autologous blood transfusion on acute wound infection following total knee and total hip arthroplasty[J]. J Bone Joint Surg, 2014, 96(4): 279-284.
[2] SALARIA O N, BARODKA V M, HOGUE C W, et al.Impaired red blood cell deformability after transfusion of stored allogeneic blood but not autologous salvaged blood in cardiac surgery patients[J]. Anesth Analg, 2014, 118(6): 1179.
[3] 李修良, 董鹏, 张晔, 等. 择期心脏手术患者术中回收自体血液红细胞2,3-二磷酸甘油酸和游离血红蛋白水平的变化研究[J].中国输血杂志, 2016, 29(11): 1232-1235.
[4] HALLET J, HANIF A, CALLUM J, et al. The impact of perioperative iron on the use of red blood cell transfusions in gastrointestinal surgery: a systematic review and metaanalysis[J]. Transfus Med Rev, 2014, 28(4): 205-211.
[5] RISBANO M G, KANIAS T, TRIULZI D, et al. Effects of aged stored autologous red blood cells on human endothelial function[J]. Am J Respir Crit Care Med, 2015, 192(10): 1223-1233.
[6] CARSON J L, GUYATT G, HEDDLE N M, et al. Clinical practice guidelines from the AABB: red blood cell transfusion thresholds and storage[J]. JAMA, 2016, 316(19): 2025-2035.
[7] 孔祥瑞. 红细胞表面分子在肾移植术后免疫功能状态评价中的临床价值[D]. 北京:中国人民解放军军事医学科学院, 2016.
[8] STEINER M E, NESS P M, ASSMANN S F, et al. Effects of red-cell storage duration on patients undergoing cardiac surgery[J]. N Engl J Med, 2015, 372(15): 1419-1429.
[9] NEUMAN R, HAYEK S, RAHMAN A, et al. Effects of storage-aged red blood cell transfusions on endothelial function in hospitalized patients[J]. Transfusion, 2015, 55(4):782-790.
[10] OREMUS K, SOSTARIC S, TRKULJA V, et al. Inf l uence of tranexamic acid on postoperative autologous blood retransfusion in primary total hip and knee arthroplasty: a randomized controlled trial[J]. Transfusion, 2014, 54(1): 31-41.
[11] HORSTMANN W G, SWIERSTRA M J, OHANIS D, et al.Favourable results of a new intraoperative and postoperative filtered autologous blood re-transfusion system in total hip arthroplasty: a randomised controlled trial[J]. Int Orthop, 2014,38(1): 13-18.
[12] PROFFEN B L, VAVKEN P, HASLAUER C M, et al. Addition of autologous mesenchymal stem cells to whole blood for bioenhanced ACL repair has no benef i t in the porcine model[J].Am J Sports Med, 2015, 43(2): 320-330.
[13] 魏亚明. 基础输血学[M]. 北京:人民卫生出版社, 2011.
[14] SCOTT A V, NAGABABU E, JOHNSON D J, et al. 2,3-Diphosphoglycerate concentrations in autologous salvaged versus stored red blood cells and in surgical patients after transfusion[J]. Anesth Analg, 2016, 122(3): 616.
[15] CARSON J L, SIEBER F, COOK D R, et al. Liberal versus restrictive blood transfusion strategy: 3-year survival and cause of death results from the FOCUS randomised controlled trial[J].Lancet, 2015, 385(9974): 1183-1189.
[16] 唐加华, 吕毅, 芶大明, 等. 自体血回输技术对行脊柱内固定手术患者术后血液流变学和骨折愈合的影响[J]. 昆明医科大学学报 , 2016, 37(7): 78-81.
[17] SCHIERGENS T S, RENTSCH M, KASPAREK M S, et al.Impact of perioperative allogeneic red blood cell transfusion on recurrence and overall survival after resection of colorectal liver metastases[J]. Dis Colon Rectum, 2015, 58(1): 74-82.
[18] NAGABABU E, SCOTT A V, JOHNSON D J, et al. Oxidative stress and rheologic properties of stored red blood cells before and after transfusion to surgical patients[J]. Transfusion, 2016,56(5): 1101-1111.
