高效液相法测定清瘟解毒口服液中连翘苷的含量
2018-04-26杨修镇张呈军
杨修镇 张呈军 陈 玲
(山东省兽药质量检验所 山东省畜产品质量安全监测与风险评估重点实验室 山东 济南 250022)
清瘟解毒口服液收载于《兽药国家标准汇编-兽药地方标准上升国家标准》第二册,具有清热解毒的功效,临床用于鸡外感发热的治疗[1],具有见效快,无药残,重复使用不产生耐药性等特点。清瘟解毒口服液的国家质量标准中均为定性鉴别,缺乏该方剂主要药效成分的定量检测,这不利于产品质量稳定性的控制,可能导致产品临床疗效的较大差异。方中连翘在治疗时起关键性作用[2],为了更好的控制本品质量,本试验对清瘟解毒口服液中连翘苷的含量测定方法进行了研究。
1 仪器和材料
Agilent1200高效液相色谱仪,连翘苷对照品,批号110821-201213,含量:95.3%,购自中国食品药品检定研究院。清瘟解毒口服液,批号201204001、201204002、201204003山东华尔康兽药有限公司提供,批号20130101、20130102、20130103山东广元药业有限公司提供,批号13031401、13031402、13031403山东派森药业有限公司提供,批号130610烟台绿叶动物保健品有限公司提供。乙腈为色谱纯,流动相用水为超纯水,其余试剂均为分析纯。
2 方法与结果
2.1 高效液相色谱条件
色谱柱为C18(4.6mm×150mm,5µm),流动相为乙腈-水(19:81),检测波长为278nm,流速1ml/min,柱温25℃,进样量10µl。
2.2 对照品溶液制备
精密称取连翘苷对照品60mg置100ml量瓶中,加50%甲醇溶解并稀释至刻度,摇匀,即得600µg/ml的连翘苷对照品贮备液。精密量取上述连翘苷对照品贮备液5ml,置50ml量瓶中,用50%甲醇稀释至刻度,摇匀,即得60µg/ml的连翘苷对照品溶液。
2.3 供试品溶液制备[3]
精密量取清瘟解毒口服液3ml,加在中性氧化铝柱(100~200目,6g,内径为1cm)上,用70%乙醇40ml洗脱,收集流出液和洗脱液,浓缩至干,残渣加50%甲醇适量,温热使溶解,转移至5ml量瓶中,并稀释至刻度,摇匀,即得。
2.4 空白样品溶液制备
按清瘟解毒口服液标准制法项制备不含连翘的口服液并按供试品溶液制备方法制备空白样品溶液。
2.5 专属性试验
分别精密吸取对照品溶液、供试品溶液、空白样品溶液各10µl,注入液相色谱仪,测定,结果表明空白样品无干扰,连翘苷分离良好,结果见图1~3。

图1 连翘苷对照品HPLC色谱图
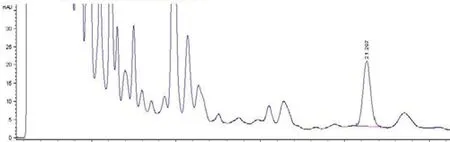
图2 清瘟解毒口服液样品HPLC图谱
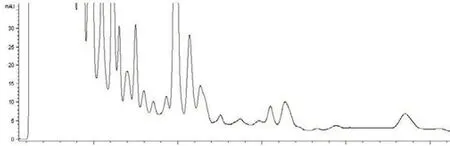
图3 空白样品HPLC色谱图
2.6 线性范围考察[4]
精密量取连翘苷对照品贮备液,用80%甲醇稀释成15、30、60、120、240、480µg/ml的系列溶液,分别精密吸取10µl,注入液相色谱仪,在上述高效液相色谱条件下进行测定,以峰面积(y)为纵坐标,浓度为横坐标(x,µg/ml),进行线性回归分析,得回归方程为:y=5.3184x+2.3155(r=0.9999),结果表明。连翘苷进样浓度在12~480µg/ml的范围内与峰面积呈良好的线性关系。
2.7 精密度试验
2.7.1 仪器精密度试验 精密量取60µg/ml的连翘苷对照品溶液10µl,注入液相色谱仪,连续进样6次,在上述高效液相色谱条件下进行测定,峰面积RSD为0.2%,表明仪器精密度良好。
2.7.2 重复性试验 分别精密量清瘟解毒口服液3ml,按供试品溶液制备项制备样品溶液,制备6份,分别精密吸取10µl,注入液相色谱仪,在上述高效液相色谱条件下进行测定,结果表明连翘苷含量RSD为0.5%,重复性良好。
2.7.3 中间精密度试验 本实验室同一分析人员在不同日期测定同一批清温解毒口服液,以及不同分析人员使用不同设备测定同一批清温解毒口服液,结果表明连翘苷含量相对相差在1.5%以内。
2.8 准确度试验
分别精密量取已知含量清温解毒口服液2ml与浓度为240 µg/ml的连翘苷对照品溶液1ml,加在中性氧化铝柱(100~200目,6g,内径为1cm)上,自“用70%乙醇40ml洗脱”起按供试品溶液制备项制备样品溶液,平行6份,注入液相色谱仪,计算连翘苷回收率,平均回收率为95.5%,RSD为0.9%,结果见表1。
2.9 耐用性试验
2.9.1 被测溶液的稳定性试验 精密量取清温解毒口服液(批号201204001)3ml,按供试品溶液制备项制备样品溶液,于制备后0、1、2、4、8、16、24、48 h分别进样测定连翘苷峰面积,结果表明RSD为0.4%,表明样品溶液在48 h内稳定。
2.9.2 流动相组成的微小波动 乙腈-水(18:82)和(20:80);不同厂家的同类型色谱柱;柱温的微小变动(22℃、28℃);流速的微小变动(0.9ml/min、1.1ml/min)及检测波长的微小变动(276nm、280nm)对连翘苷的分离效果无明显影响。
2.10 样品含量测定 分别取不同批号清瘟解毒口服液,按供试品溶液制备项制备样品溶液,在上述高效液相色谱条件下进行测定,每份样品测定2次,结果见表2。
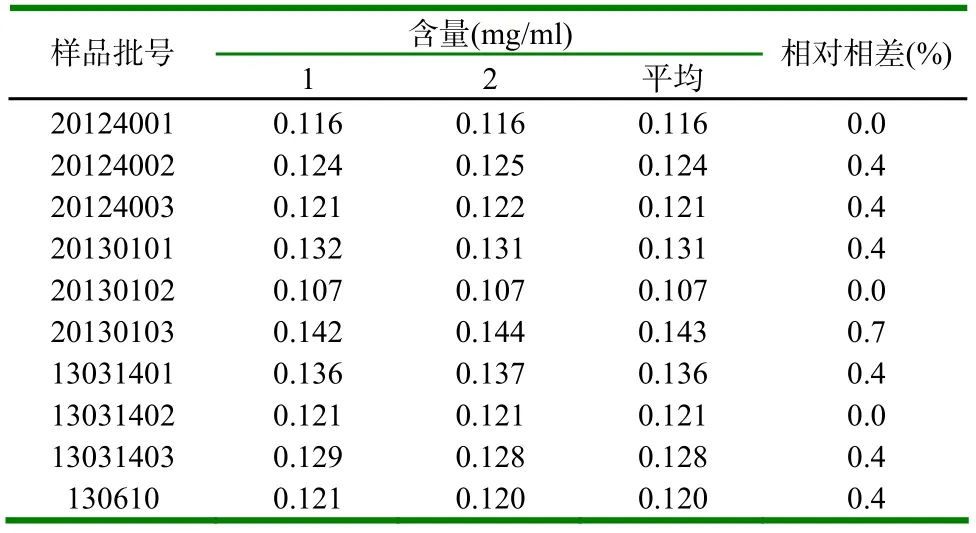
表2 样品含量测定结果
3 小结
(1)检测波长选择:取连翘苷对照品适量,用50%甲醇溶解并稀释成300µg/ml的溶液,在200~400nm波长进行扫描,结果在278nm有最大吸收,因此选择278nm作为检测波长。(2)在本研究中,参考《中国兽药典》连翘[5]项下内容和双黄连口服液项下内容,对样品进行前处理,采用连翘项下前处理方式回收率偏低,故采用双黄连口服液项下前处理方式。
本文建立的HPLC法测定清瘟解毒口服液中连翘苷的含量,空白样品无干扰,方法简便、准确、重现性好,能为进一步控制清瘟解毒口服液的质量提供依据。
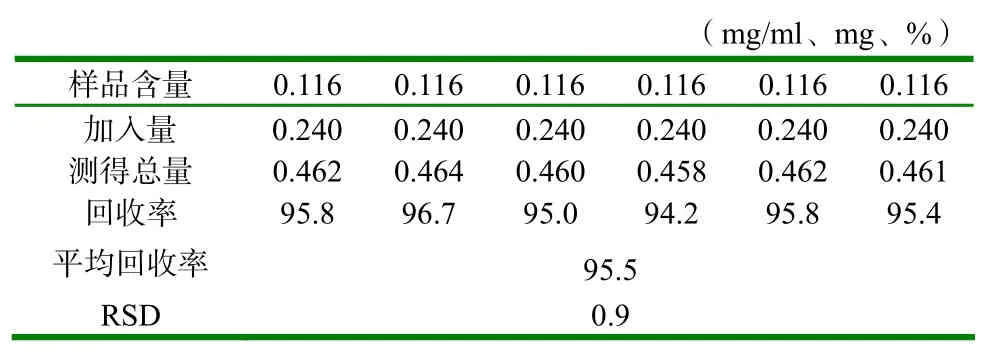
表1 加样回收率试验
[1]农业部兽药评审中心.兽药国家标准汇编[S].兽药地方标准上升国家标准(第2册). 83-84.
[2]王海新.清瘟解毒口服液在治疗传染性喉气管炎中的体会[J].兽药市场指南,2014(5): 45-45.
[3]中华人民共和国兽药典委员会.中华人民共和国兽药典[S].2010年版二部,580-581.
[4]张晓慧,建学. HPLC法测定不同产地连翘中连翘苷含量[J].中国酿造,2008,13(1): 78-79.
[5]中华人民共和国兽药典委员会.中华人民共和国兽药典[S].2010年版二部, 231-232.
