伏马毒素的危害及防控技术研究进展
2018-04-25坚乃丹常晓娇王春玲孙长坡
坚乃丹,常晓娇,孙 晶,王春玲,孙长坡,*
(1.天津科技大学食品工程与生物技术学院,天津 300457;2.国家粮食局科学研究,北京 100037)
伏马毒素又称烟曲霉毒素,是一种霉菌毒素,主要是由串珠镰刀菌(Fusarimmonitiforme)、轮状镰刀菌(Fusariumverticillioides)和多育镰刀菌(Fusariumproliferatum)等镰刀菌在适宜的温度和湿度条件下产生的一种水溶性次级代谢产物[1]。镰刀菌是农业生产中常见的致病菌,普遍存在于土壤及动植物有机体尤其以玉米、高粱、小麦为主的农作物中,极易产生伏马毒素造成秧苗的枯萎,根、茎和种子的腐烂,污染多种粮食及其制品,从而引起人和动物的病理变化,产生急性毒性及潜在致癌性[2]。据2016年中国饲料和原料霉菌毒素检测报告[3]报道最近几年全球伏马毒素污染趋势明显升高,而伏马毒素高污染情况下会协同其他病原菌[4],加重呼吸道等疾病,因此它在食品与饲料安全中的危害引发人们的广泛关注。本文阐述了伏马毒素的生物学特性及其产生的危害,并就世界范围内伏马毒素的预防和控制进行了探讨。
1 伏马毒素理化性质及种类
伏马毒素是由不同的多氢醇和丙三羧酸组成的双酯类化合物,其骨架结构是一条由19或20个碳原子组成的直链,各种羧基、羟基及酯键分布在骨架双侧,其结构式见图1[5]。伏马毒素极易溶于水,且热稳定性强,100 ℃蒸煮30 min结构也未受影响[6]。这种特性使得伏马毒素在绝大多数的粮食加工过程中性质非常稳定,很难破坏其结构,污染也最为严重。到目前为止,发现天然伏马毒素已有11种,分为四大类即FA、FB、FC和FP,但主要分布以FB1、FB2和FB3种形式存在,其中FB1占总量的70%,毒性最强,研究也最为深入[7]。
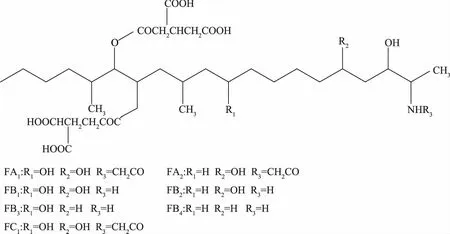
图1 伏马毒素主要化学结构式Fig.1 Structure of fumonisins
2 伏马毒素的污染现状
根据伏马毒素污染食品和饲料的情况,国内外科研工作者进行了广泛的调查。Rubert等[8]对来自法国、德国和西班牙的玉米样品进行检测分析,发现FB1和FB2在有机玉米中的污染率分别为11.4%和11.3%。Seo[9]对韩国的饲料样品进行检测,结果显示FB1污染水平最高的是家禽肉鸡饲料,浓度为14.6 mg/kg,FB2污染水平最高的是育肥犊牛饲料,浓度为2.28 mg/kg。Bryla[10]在对波兰零售市场的加工产品进行评估发现,热加工产品和各种零食小吃中的伏马毒素平均浓度为1177 μg/kg,均高于未经处理的产品。
国内李人杰等[11]监测了辽宁、河南等十七个省的596份玉米样本,其中有299份检测到伏马毒素污染,污染率为50.2%,平均污染水平为1575 ng/g,最高污染水平为59831 ng/g。郭耀东等[12]对我国18个城市的干豆、坚果、大米、面粉、其他谷物及其制品5类食品中的伏马毒素抽样检测发现,所抽样本中坚果类食品中的FB检出率最高为20.48%,干豆类食品中最低为2.17%。程传民[13]对饲料产品污染状况进行调查发现泌乳期奶牛精料补充料和青年母猪配合饲料中的伏马毒素超标较严重,超标率分别为20.0%和9.0%。此外,有研究表明,在白扁豆、赤小豆、红茶、芦笋、香辛料和药用植物中都相继检出过伏马毒素[14]。由此可见,伏马毒素污染粮食等农产品的局势日趋普遍,应当引起相关监管部门和科研人员的充分重视。
3 伏马毒素的毒性及危害
产毒菌侵染玉米和小麦等作物一方面造成饲料营养价值降低,粮食减产等经济损失,另一方面伏马毒素随着食品链条传递还严重危害人畜健康。伏马毒素具有神经毒性、器官毒性、免疫毒性、致癌性等有害作用。研究证实,FB可引起马产生脑白质软化症ELEM[15],猪肺水肿综合征PPE[16],小鼠、羔羊、小牛的不同程度肝细胞凋亡和肾毒性,并且促使灵长类动物的动脉粥样硬化[17]。Devriendt[18]使用与人胃肠道类似的仔猪作为实验模型,研究口服FB1对人肠免疫系统的影响,结果发现FB1能够使肠抗原呈递细胞的功能受损,降低T淋巴细胞的刺激功能,增加了机体对病原的易感性,表明伏马毒素可能对人类有潜在的免疫毒性。伏马毒素还可能诱发人体细胞癌变,王少康等[19]发现FB1可以增进人类正常食管上皮细胞增殖,抑制细胞凋亡,细胞从G0/G1期进入S期,致使S期和G2/M期阻滞,影响细胞的正常凋亡,从而证实了FB1可能与人类食管癌的发生有关。此外,伏马毒素还可能是诱发结肠癌发生的危险因素之一,Minervini[20]等发现伏马毒素会损伤HT-29结肠细胞DNA,造成细胞表面恶性病变。此外伏马毒素常伴随着黄曲霉毒素共同存在,致使毒性作用被聚集放大,因此伏马毒素的危害不容小觑。
4 伏马毒素的预防及控制
控制粮食作物中的伏马毒素生长及产毒,阻断污染物进入食物链避免引起疾病灾害是一个迫在眉睫的问题。目前研究人员主要利用相关的农业措施及生物技术对伏马毒素的产生进行预防控制。
4.1 利用农业措施控制伏马毒素
农业栽培措施对玉米穗腐病的发生及伏马毒素积累有一定的影响。Blandino等[21]的研究结果表明,较高的种植密度及施肥水平会出现更为严重的玉米穗腐病。因此,加强栽培管理,选择合理种植密度,是防控伏马毒素的关键措施。研究发现,在干旱、害虫和杂交种的适应期,玉米穗腐病发病率较高,容易积累伏马毒素。因此,适当小气候的改善是降低伏马毒素产生的又一关键措施。Martin等[22]发现用尿素代替硝酸铵时,伏马毒素的污染减少;增施钾肥也可提高茎腐病的防治效果。因此,合理补充各种营养元素,是降低伏马毒素产生的另一有效方法。宋立秋等[23]调查发现玉米螟虫会对玉米秸秆和穗组织造成非常严重的损害,刺激串珠镰刀菌孢子的萌发从而促进伏马毒素的产生。因此,加强害虫防治,如使用药剂拌种或包衣种子[24],控制苗期病害虫和地下害虫,为作物生长创造最佳条件,有利于增强作物对病原真菌的抵抗力,可有效减少受感染的几率。此外,确保粮食作物的适时收获,收获后及时干燥,也可达到防控效果,如使大豆、水稻谷粒水分含量少于12.5%,玉米籽粒不到13%,花生仁不足8%,存放温度比室温高3%~5%;作物在贮存过程中避免鼠害、机械碾压等伤害,注意谷物籽粒破损,及时入库贮藏。在贮存过程中使用化学熏蒸法防止霉变等,都是避免或减少伏马毒素产生的有效措施[25]。
4.2 利用天然产物控制伏马毒素
部分天然产物可通过影响植物的生化抗性机制阻碍代谢途径主动抵御疾病的进行。研究发现天然酚类化合物可通过影响细胞膜的破裂,中断伏马毒素的生物合成途径以降低其含量。草本植物绞股蓝提取物具有很高的抗氧化活性,可以有效的抑制串珠镰刀菌生长,食品级植物甜叶菊提取物也具有此效果[26]。香芹酚和丁香油酚也能有效地抑制玉米粒中的串珠镰刀菌孢子萌发和菌丝生长,而阿魏酸和绿原酸可分别抑制拟轮枝镰孢菌和禾谷镰孢菌的生长;提高作物的抗病性[27]。此外香草酸、咖啡酸、高黄绿桑、苯甲酸、羟基肉桂酸等也被发现对伏马毒素的积累具有抑制作用[28]。
精油对串珠镰刀菌抑制作用更为明显,原因可能是能更加有效地渗透到内核中,其抗菌活性可归因于其化学组合物中的脂族醇和酚的存在[26]。Dambolena等[29]报道肯尼亚丁香罗勒精油可明显抑制镰刀菌的生长。此外,Velluti等[30]从肉桂、丁香、香茅、牛至和东印度香叶中提取的精油可以控制真菌活性及FB1的产生,其中肉桂与牛至精油效果最好。
Reynoso[31]曾在研究中发现,食品级抗氧化剂丁基羟基茴香醚和对羟基苯甲酸丙酯组合使用可以影响伏马毒素产生。四氢姜黄素是一种从无毒的草本植物的根部提取的酚类抗氧化剂,可抑制体外的镰刀菌生长,若愈创木酚亚基复合使用,具备较高的抗真菌活性,且四氢姜黄素分子中苯环上的邻羟基和甲氧基的存在可影响抗真菌活性[26]。使用天然的酚类、精油和抗氧化剂可有效控制伏马毒素,但是操作时间较长,且酚类、精油和抗氧化剂成本较高,如何使之工业化生产值得探讨。
4.3 利用生防微生物控制伏马毒素
生防微生物是指生物防治微生物,通过与病原菌竞争营养物质、物理或生物位点等,保持优势进而控制植物病原微生物的生长。所以利用生物竞争技术通过作物预感染非产毒真菌菌株可抑止产毒真菌的生存。
4.3.1 植物内生菌 真菌通过种子和植物纤维的无性繁殖感染可以横向和纵向传染给植物下一代。横向感染是真菌从外部蔓延传播的方式,从外部感染可应用某些杀菌剂得到控制。但是在植物内寄生期,感染是纵向传播的,这种感染方式是不能应用杀菌剂得到控制的,并且是每一代植物的感染源,宿主植物世代会发生感染进行毒素合成,此时可以利用内生细菌生物控制系统[32]。枯草芽孢杆菌与串珠镰刀菌在植物体内有相同的生态位点,基于竞争性排斥作用可以有效抑制串珠镰刀菌的生长,阻碍伏马毒素的合成,被公认为一种安全的生物防制剂,Bacon等[33]利用该菌开发了枯草芽孢杆菌生物系统,发现经处理的样品相比未感染的枯草芽孢杆菌对照组样品伏马毒素含量低于50%。木霉因其胞外水解酶裂解真菌细胞壁效果良好,绿色木霉已被广泛用于生物肥料进行控制病害或抑制病原菌,木霉与串珠镰刀菌共培养,可以产生挥发性抗生物质,有效地抑制串珠镰刀菌在内生增长阶段产生的伏马毒素[26]。食品级酵母也被认为是理想的生防微生物,因为它们通常遗传稳定,有效浓度低,容易培养,能在不良环境条件下生存,可以兼容抗虫剂。
4.3.2 微生物代谢产物 自然界中的微生物次生代谢物降解真菌毒素高效环保,用以开发新型生物农药的有效途径。胡梁斌等[34]在被油菜菌核病菌感染的油菜茎杆内分离出一株枯草芽孢杆菌B-FS01,发现B-FS01会分泌出一种抗菌物质芬荠素,不仅能够延滞串珠镰刀菌孢子的萌发,还在活体玉米种子上表现出对串珠镰刀菌生长的抑制作用,并且其抑菌性质热稳定性强,对碱性环境有一定的耐受能力,对蛋白酶和胃蛋白酶均不敏感,更好应用于实际生产中。放线菌在生物防治研究领域也是重点对象,放线菌不仅能够产生具有拮抗作用的抗生素,还能分泌多种降解病原菌细胞壁的胞外水解酶,在生物防治研究领域值得关注。刘春静等[35]检测发现放线菌F-1发酵液对串珠镰刀菌的抑制率达到96.89%。张海霞等[36]筛选得到一直鲜黄链霉菌WM2-4可抑制串珠镰刀菌,尖孢镰刀菌等12种病原菌生长。张波等[37]在实验中发现小单孢菌属放线菌Z139的代谢产物能对11种病原真菌产生拮抗作用,抑菌率超过85%,具备开发为新型生物降解农药的潜力。
4.4 选育抗真菌感染的粮食作物新品种
Lanubile[38]等研究发现,在玉米种粒和籽苗中,不同基因型抵抗轮状镰刀霉菌时基因表达情况会存在差异,因此可以通过改变种粒和籽苗的基因型,筛选出抗真菌感染的品种,进而减少伏马毒素对玉米的污染。Rose等[39]对18份玉米自交系进行抗串珠镰刀菌筛选得到3份抗病玉米杂交种且抗性稳定。李爱军[40]筛选出2份高抗玉米杂交种,31份抗病玉米杂交种可抑制串珠镰刀菌感染将发病面积控制在10%以下。Czembor[41]等对马齿型和硬粒型玉米自交系进行筛选时发现硬粒型种质的玉米对伏马毒素的抗性强于马齿型的玉米。Balconi等[42]采用田间接种对意大利的34份及对照组6份玉米自交系进行伏马毒素的抗性鉴定,对照组自交系样品表现出较高的伏马毒素含量,表明意大利玉米种质可以作为抗穗腐病的有效抗源。随着现代生物技术的发展,新一代RNA测序方法也被用于对抗病性玉米基因型的转录水平表达变化。此技术意义重大,如参与识别的遗传标记信号转导和控制宿主抗性机制的遗传标记,以及相关量化表达等,这些数据为抗病玉米基因型的开发提供了重要的基因组资源。
4.5 利用基因工程技术开发抗性作物
4.5.1 开发抗虫害的作物新品种 改良基因抗虫性,增加作物对虫蚀的抵抗力。表达苏云金杆菌(Bt)毒素的转基因玉米,安全高效防虫、预防镰刀菌感染和伏马毒素的产生,其所表达的Cry蛋白是Bt微生物产品中的一种杀虫成分,可降低玉米螟危害进而减少了真菌感染的概率,被用作生物杀虫剂已超过50年的历史[43]。目前Bt玉米首批已进入欧洲市场,南非地区也开始实验应用。
4.5.2 开发抗真菌感染的作物新品种 利用转基因植物产生抗真菌蛋白,提高作物自身的防御体系。目前通过在转基因植物中组成型或诱导型表达单一或组合的植物来源的抗菌蛋白基因而获得了很多有前景的结果,这些蛋白包括几丁质酶和葡聚糖酶,核糖体失活蛋白和富含半胱氨酸的抗真菌肽等[44]。研究发现在豇豆苗根部分泌出β-1,3-葡聚糖酶、几丁质酶和脂质转移蛋白表现出对尖孢镰刀菌较强的抑制作用[45]。研究人员设想把相关编码抗菌蛋白的基因导入植物,通过提高植物体内抗菌蛋白的活性以提高对真菌病害的抗性。Coca等[46]研发的转基因水稻中AFD基因表达组成型AFD蛋白有效的抑制了水稻防稻瘟病菌的感染。在克雷伯氏细菌HY-l菌株中分离得到了一株能降解镰刀菌的基因,该基因包含3.6 kb的DNA片段,已经构建了含有该降解基因的质粒,导入番茄中,以期获得抗镰刀菌的转基因番茄[47]。转基因抗真菌的研究进展似乎比昆虫抗性更具挑战性,大多数研究成果依然停留在实验阶段,在实际生产或贸易应用中还受到许多因素限制。随着对植物防御体系及基因表达调控机理研究的深入,抗镰刀菌基因工程将在农业生产过程中得到应用。
4.5.3 开发具有酶解或干扰真菌毒素产生的作物新品种 利用转基因作物能分泌特异性降解酶,削减自身产生的伏马毒素。从微生物中可筛选出镰刀菌拮抗菌或抑制其产生伏马毒素的活性物质。Niderkon[48]从乳酸菌和丙酸菌中筛选到肠膜明串珠菌可降解FB1,而乳明串珠菌可降解FB2。叶火春[49]从红树林泥土中寻找到一株卡伍尔链霉菌可以抑制多育镰刀菌生长和FB1产生。Heinl等[50]从细菌鞘氨醇单胞菌MTA144中发现了降解FB1的两个基因,分别编码脱羧酶和转氨酶,这两种酶连续作用可以降解FB1。杨朋飞等[51]分离筛选出一株对伏马毒素具有较高降解能力的真菌菌株鞘氨醇盒菌,并以此降解菌为研究对象,进一步采用分子生物学手段,克隆获得了伏马毒素的相关基因。目前研究人员正重点研究使用基因介导技术将伏马毒素水解酶基因克隆到玉米或其作物,使其转化表达相关的特异性酶,降解被镰刀菌污染作物上的伏马毒素。Blackwell等实验发现斯平尼弗外瓶柄霉可分泌一种可溶性酯酶,能对伏马毒素进行脱酯反应转化为氨基酸多元醇。目前斯平尼弗外瓶柄霉已经应用于构建对伏马毒素具有解毒功能的转基因玉米[52]。
4.6 利用人工种子或种衣新技术控制伏马毒素
人工种子在迅速繁殖无性系、固定杂种优势以及与基因工程相结合等领域有着广阔的应用远景,使用人工种子或种衣新技术来改造作物种子,使其含有抑制产毒真菌生长的内生细菌是一种有效控制伏马毒素的方法[53]。该方法作为一种新型降解毒素方法,还需要深入研究。
5 结论
伏马毒素是世界范围内影响作物生长的主要霉菌之一,不仅对粮食和饲料的国际贸易构成了巨大威胁,而且对人畜健康有很大的潜在危害。目前存在几种策略来减少伏马毒素的食物来源,即控制农业生产实践,改良青贮玉米品种,选育昆虫和真菌的抗性品种等各种物理、化学、生物处理方法和基因工程方法。通过物理化学方法实现良好的农业管理可在一定程度降低伏马毒素产生,但并不能从根本上消除霉菌的生长和霉菌毒素的污染,而相关的化学措施可以简单快速的消除伏马毒素,但是长期反复使用造成土壤大气等污染,并且可能衍生其他毒性,部分国家或地区如欧盟等禁止在食品生产过程中使用化学方法除去真菌毒素。利用生物技术控制伏马毒素具有专一性强、特异性高且无污染等特点引起广泛关注,如天然产物抗氧化剂、精油、酚类化合物的有效组合作为保护粮食熏蒸剂;利用生防微生物开发新型生物农药以及构建具有降解伏马毒素能力的抗性作物得到了较高的评价。但是基于目前生物技术仍存在方法不成熟和成本较高等问题,如陈仪[54]曾提出,筛选出能产高活性解毒酶的菌株、在原料中创建一个有利于酶促反应的含水微环境,这涉及到酶工程、基因工程等研究手段,因此这个方法仍停留在理论阶段。
[1]Magoha H,Kimanya M,De M B,et al. Risk of dietary exposure to aflatoxins and fumonisins in infants less than 6 months of age in Rombo,Northern Tanzania[J]. Maternal & Child Nutrition,2016,12(3):516-527.
[2]Wang X,Wu Q,Wan D,et al. Fumonisins:oxidative stress-mediated toxicity and metabolisminvivoandinvitro[J]. Archives of Toxicology,2016,90(1):81-101.
[3]周建川,郑文革,赵丽红,等. 2016年中国饲料和原料中霉菌毒素污染调查报告[J]. 中国猪业,2017,12(6):22-26.
[4]Mutai C,Mwamburi L,Keter L,et al. Risk of Fungi Associated with Aflatoxin and Fumonisin in Medicinal Herbal Products in the Kenyan Market[J]. The Scientific World Journal,2017(5):1-6.
[5]Voss K A,Riley R T,Gardner N M,et al. Fumonisins[M]. Reproductive and Developmental Toxicology. 2017.
[6]Bryla M,Waskiewicz A,Szymczyk K,et al. Effects of pH and Temperature on the Stability of Fumonisins in Maize Products[J].Toxins,2017,9(3).
[7]Yamazoe Y,Koyama N,Kumagai S,et al. Possible Role of Phosphatidylcholine and Sphingomyelin on Fumonisin B1-mediated Toxicity[J]. 2017,5(3):75-97.
[8]Rubert J,Soriano J M,Maes J,et al. Occurrence of fumonisins in organic and conventional cereal-based products commercialized in France,Germany and Spain[J]. Food & Chemical Toxicology,2013,56(2):387-391.
[9]Seo D G,Phat C,Kim D H,et al. Occurrence of Fusarium mycotoxin fumonisin B1 and B2 in animal feeds in Korea[J]. Mycotoxin Research,2013,29(3):159.
[11]李人杰. 不同耕作方式及杀虫剂处理对玉米穗腐病发生及玉米籽粒中伏马毒素污染水平的影响[D]. 保定:河北农业大学,2015.
[12]郭耀东,刘艺茹,袁亚宏,等. 我国主要食品中伏马菌素污染水平分析与风险评估[J]. 西北农林科技大学学报自然科学版,2014,42(1):78-82.
[13]程传民,李云,周朝华,等. 2014年伏马毒素在饲料产品中的污染分布规律[J]. 饲料博览,2016(3):25-29.
[14]江曙,杨美华,段金廒,等. 伏马菌素对中药材的污染及其防治技术体系的研究[J]. 中草药,2009,40(12):2015-2018.
[15]Giannitti F,Diab S S,Pacin A M,et al. Equine leukoencephalomalacia(ELEM)due to fumonisins B1 and B2 in Argentina Leucoencefalomalacia equina devida a fumonisinas B1 e B2 na Argentina[J]. Pesquisa Veterinária Brasileira,2011,31(5):407-412.
[16]蒋艳成,陈志刚,许广人,等. 伏马毒素对猪的毒性研究进展[J]. 中国饲料,2016(1):35-38.
[17]张荷,胡琼波,刘承兰. 伏马菌素的毒性及其作用机理[J]. 西北农林科技大学学报:自然科学版,2016,44(1):162-168.
[18]Devriendt B,Gallois M,Verdonck F,et al. The food contaminant fumonisin B1 reduces the maturation of porcine CD11R1+intestinal antigen presenting cells and antigen-specific immune responses,leading to a prolonged intestinal ETEC infection[J]. Veterinary Research,2008,40(4):40.
[19]王少康. 伏马菌素B1对正常食管上皮细胞的影响及其与食管癌关系的病例对照研究[D]. 南京:东南大学,2013.
[20]Minervini F,Garbetta A,D’Antuono I,et al. Toxic mechanisms induced by fumonisin b1 mycotoxin on human intestinal cell line[J]. Archives of Environmental Contamination & Toxicology,2014,67(1):115-23.
[21]贾玉芳. 玉米穗腐病的发病原因及防治措施[J]. 中国农业信息,2015(7):51.
[22]Maiorano A,Reyneri A,Magni A,et al. A decision tool for evaluating the agronomic risk of exposure to fumonisins of different maize crop management systems in Italy[J]. Agricultural Systems,2009,102(1):17-23.
[23]宋立秋,石洁,王振营,等. 亚洲玉米螟为害对玉米镰孢穗腐病发生程度的影响[J]. 植物保护,2012,38(6):50-53.
[24]赵希. 应用包衣技术防治水稻烂秧效果示范研究[J]. 种子科技,2017(4):112-112.
[25]王守经,胡鹏,汝医,等. 谷物真菌毒素污染及其控制技术[J]. 中国食物与营养,2012,18(3):13-16.
[26]Alberts J F,Zyl W H V,Gelderblom W C A. Biologically Based Methods for Control of Fumonisin-Producing Fusarium Species and Reduction of the Fumonisins[J]. Frontiers in Microbiology,2016,7.
[27]段灿星,王晓鸣,宋凤景,等. 玉米抗穗腐病研究进展[J].中国农业科学,2015,48(11):2152-2164.
[28]Ferrochio L,Cendoya E,Farnochi M C,et al. Evaluation of ability of ferulic acid to control growth and fumonisin production ofFusariumverticillioidesand Fusarium proliferatum on maize based media[J]. International Journal of Food Microbiology,2013,167(2):215-220.
[29]Dambolena J S,Zunino M P,López A G,et al. Essential oils composition of Ocimum basilicum L. and Ocimum gratissimum L. from Kenya and their inhibitory effect on growth and fumonisin production byFusariumverticillioides[J]. Innovative Food Science & Emerging Technologies,2010,11(2):410-414.
[30]Velluti A,Sanchis V,Ramos A J,et al. Inhibitory effect of cinnamon,clove,lemongrass,oregano and palmarose essential oils on growth and fumonisin B 1,production by Fusarium proliferatum,in maize grain[J]. International Journal of Food Microbiology,2004,89(2-3):145-154.
[31]Reynoso M M,Torres A M,Ramirez M L,et al. Efficacy of antioxidant mixtures on growth,fumonisin production and hydrolytic enzyme production byFusariumverticillioidesand F. proliferatuminvitroon maize-based media[J]. Mycological Research,2002,106(9):1093-1099.
[32]王晓英,刘秀梅. 串珠镰刀菌伏马菌素产毒株分子遗传学研究进展[J]. 卫生研究,2005,34(2):248-251.
[33]Bacon C W,Yates I E,Hinton D M,et al. Biological control of Fusarium moniliforme in maize.[J]. Environmental Health Perspectives,2001,109 Suppl 2(Suppl 2):325.
[34]胡梁斌. 细菌B-FS01抗菌物质的鉴定以及对串珠镰刀菌生长和伏马菌素B1产生的抑制效应[D]. 南京:南京农业大学,2007.
[35]刘春静,王昌禄,陈勉华,等. 串珠镰刀菌拮抗菌的分离筛选及其抑菌作用[J]. 粮食与饲料工业,2011,12(1):41-42.
[36]张海霞. 土壤放线菌WM2-4的分离、筛选及拮抗作用的研究[D]. 大庆:黑龙江八一农垦大学,2010.
[37]张波,白红进,付骋宇,等. 农用抗生素产生菌Z(139)菌株的稳定性[J]. 植物保护,2004,30(5):26-29.
[38]Lanubile A,Pasini L,Marocco A.Corrigendum to“Differential gene expression in kernels and silks of maize lines with contrasting levels of ear rot resistance after Fusarium verticillioides,infection”[J].Journal of Plant Physiology,2011,168(3):1398-1406.
[39]Rose L,Mouton M,Beukes I,et al. Multi-environment evaluation of maize inbred lines for resistance to Fusarium ear rot and fumonisins[J]. Plant Disease,2016,100(10):2134-2144.
[40]李爱军,李洪,董红芬,等. 玉米种质资源的抗穗腐病鉴定[J]. 安徽农业科学,2012(12):7151-7151.
[41]Czembor E,Ochodzki P. Resistance of flint and dent maize forms for colonization byFusariumspp. and mycotoxins contamination.[J]. Maydica,2009,54(2):263-267.
[42]Balconi C,Berardo N,Locatelli S,et al. Evaluation of ear rot(Fusariumverticillioides)resistance and fumonisin accumulation in Italian maize inbred lines.[J]. Phytopathologia Mediterranea,2014,53(1):14-26.
[43]王春玲,Bruce Hammond. 转基因抗虫作物中苏云金芽孢杆菌Cry蛋白的食品安全问题[J].生物技术进展,2011,1(4):235-241.
[44]黄春萍,张宏,张晓喻. 植物抗真菌蛋白的分类及抗菌机制研进展[J]. 国外医药抗生素分册,2007,28(4):167-171.
[45]Nóbrega F M,Santos I S,Cunha M D,et al. Antimicrobial proteins from cowpea root exudates:inhibitory activity against Fusarium oxysporum,and purification of a chitinase-like protein[J]. Plant & Soil,2005,272(1-2):223-232.
[46]Coca M,Bortolotti C,Rufat M,et al. Transgenic rice plants expressing the antifungal AFP protein from Aspergillus giganteus show enhanced resistance to the rice blast fungus Magnaporthe grisea[J]. Plant Molecular Biology,2004,54(2):245-259.
[47]王卓娅,刘玉焕,李荷. 克雷伯氏菌ZD112氯氰菊酯降解酶基因的克隆与生物信息学分析[J]. 广东药学院学报,2008,24(3):277-281.
[48]Niderkorn V,Boudra H,Morgavi D P. Binding of Fusarium mycotoxins by fermentative bacteriainvitro[J]. Journal of Applied Microbiology,2006,101(4):849-856.
[49]叶火春,赖先文,王艳丽,等. 1株抑制镰刀菌生长及产生伏马菌素链霉菌的分离和鉴定[J]. 西北农林科技大学学报自然科学版,2013,41(7):150-156.
[50]Heinl S,Hartinger D,Thamhesl M,et al. Degradation of fumonisin B1 by the consecutive action of two bacterial enzymes[J]. Journal of Biotechnology,2010,145(2):120-129.
[51]杨朋飞. 伏马毒素降解菌的机制解析及降解酶基因的克隆[D]. 郑州:河南工业大学,2016.
[52]Heinl S,Hartinger D,Thamhesl M,et al. Degradation of fumonisin B1 by the consecutive action of two bacterial enzymes[J]. Journal of Biotechnology,2010,145(2):120-129.
[53]谷睿智,吴沿友,滕博群,等. 添加纳米TiO2制作的人工种皮对种子萌发的影响[J]. 北方园艺,2016(12):20-24.
[54]左丽. 饲料霉菌毒素生物酶解毒技术的研究及应用前景[J]. 广东饲料,2014,23(9):1-3.
