植物甾醇酯对高脂饮食大鼠结肠内容物短链脂肪酸的影响
2018-04-25李雅婷欧阳鹏凌宋立华
李雅婷,欧阳鹏凌,曲 丹,蒋 芮,宋立华,3,*
(1.上海交通大学农业与生物学院,上海 200240;2.上海市第七人民医院,上海 200137;3.上海交通大学陆伯勋食品安全研究中心,上海 200240)
现代生活中,随着饮食结构和生活方式的改变,传统的高纤维、低脂肪、低热量饮食模式向低纤维、高脂肪、高热量饮食模式转变[1]。研究证明,肠道共生菌会直接参与脂肪酸和胆固醇代谢[2],因此高脂饮食会影响机体肠道健康和相关的菌群组成;通常,高脂饮食引起的肠道环境改变不利于厌氧菌生长繁殖[3],同时也会影响肠道短链脂肪酸(short chain fatty acids,SCFAs)的含量[4-5]。SCFAs是肠道微生物的主要代谢产物之一,由肠道菌群通过发酵不能被宿主代谢的膳食纤维等物质产生,可作为结肠上皮的营养物质,对健康和机体代谢具有重要意义[6]。其可影响细胞增殖、分化、基因表达,参与调节肠道pH,并在调控机体糖、脂代谢等方面发挥显著作用[6-8]。将SCFAs作为饮食补充剂时,可改善高脂饮食诱导的肥胖和胰岛素抵抗[9-11];丙酸盐和丁酸盐通过增加肠道糖异生作用,对机体葡萄糖代谢和能量稳态产生有益作用[12]。
植物甾醇(phytosterol,PS)是源于食品的一类三萜类物质,其降胆固醇活性早在上世纪九十年代开始即被应用于食品和制药行业[13]。植物甾醇酯(phytosterol ester,PSE)是植物甾醇的酯化产物。PS/PSE结构类似于胆固醇[14],可通过竞争性附着于肠上皮受体,限制人体对胆固醇的吸收,从而降低胆固醇水平[15]。目前关于PSE的生理活性研究多集中在其降血脂、抗炎、抗氧化等方面[16-20],而涉及PSE对肠道内环境的影响的相关研究较少。已有研究发现,PSE在肠腔内的竞争作用可导致机体对胆固醇的吸收率降低,从而使肠道中胆固醇浓度升高,而有些胆固醇衍生物对特定种类的肠道菌群有抑制作用[21]。于是推测PSE可能会通过调节肠道菌群组成间接发挥其生理功能。作为肠道菌群的主要发酵产物,SCFAs含量的变化可直接反映机体的饮食、菌群组成和肠道健康状况。因此,本实验以高脂饮食饲喂大鼠,同时灌胃给予不同剂量PSE强化牛奶,利用气相色谱法检测各组大鼠结肠内容物SCFAs水平,观察PSE对高脂饮食大鼠肠道内环境的影响。
1 材料与方法
1.1 材料与仪器
伊利纯牛奶 购自当地超市;植物甾醇酯 巴斯夫中国有限公司提供(PSE含量≥91%,游离PS含量≤6%)(甾醇组成:胆甾醇≤2%,菜籽甾醇≤6%,菜油甾醇20.0%~29.0%,豆甾醇12.0%~23.0%,β-谷甾醇42.0%~55.0%,D5-燕麦甾醇≤4%,D7-燕麦甾醇≤2%,D7-豆甾烯醇≤2%,其他≤5%));大鼠饲料 福贝世亨生物医药(上海)有限公司提供(其中基础饲料配方:水分≤10%,粗蛋白≥20%,粗脂肪≥4%,粗纤维≤5%,灰分≤8%,钙1%~1.8%,磷0.6%~1.2%,赖氨酸1.32%,蛋氨酸+胱氨酸0.78%;高脂饲料配方:基础饲料52.65%,猪油21%,胆固醇1.25%,胆盐0.5%,蔗糖10%,酪蛋白10%,预混料1.9%,麦芽糊精2.7%);6周龄健康雄性SD大鼠(170±10) g 由上海斯莱克实验动物有限公司提供;乙酸(≥99.7%)、戊酸(≥99.5%)、丙酸(≥99.5%)、丁酸(>99.5%)、异丁酸(≥99.5%)、异戊酸(≥99.5%)和2-甲基戊酸(>98.0%)上海阿拉丁生化科技股份有限公司;其他分离试剂均为国产分析纯试剂。
台式高速冷冻离心机TGL-16 湖南湘仪实验室仪器开发有限公司;xh-c型漩涡混匀器 常州翔天实验仪器厂;APV-2000高压均质机 波兰APV公司;GC-2010气相色谱仪 日本SHIMADZU公司。
1.2 实验方法
1.2.1 灌胃溶液配制 称取膏状PSE产品7.5 g(或15.0 g)于灭菌玻璃瓶中,于65 ℃水浴至液态,用纯牛奶定容至150 mL,配制成含0.05 g/mL(或0.10 g/mL)的PSE强化牛奶。混合液在20 MPa下高压循环均质,待彻底乳化、无明显液滴后用于大鼠灌胃。
1.2.2 动物分组及干预 动物适应性喂养一周后,在确保每组平均体重一致的前提下随机分为4组:正常对照组(NC,n=4),高脂模型组(BC,n=9),低剂量PSE组(PSE-L,n=9),高剂量PSE组(PSE-H,n=9)。其中,NC组饲喂基础饲料,其他三组饲喂高脂模型饲料;低、高剂量PSE干预组每天下午分别灌胃给予不同浓度PSE强化牛奶,灌胃剂量分别为0.05 g/100 g·体质量(body weight,BW)和0.10 g/100 g·BW(相当于成人3和6 g/d的摄入量),NC组和BC组大鼠灌胃给予等体积纯牛奶。室温维持在(25±1) ℃,相对湿度为45%~65%,12 h明暗轮换采光(6:00~18:00)。实验期间各组大鼠自由饮食及饮水。实验第13周结束时,腹腔麻醉大鼠,摘除其结肠后,纵向剪开结肠组织,取出内容物,置于-80 ℃冰箱中冷冻保存。
1.2.3 气相色谱法测定结肠内容物中SCFAs
1.2.3.1 样品处理 参照Zhao等[22]和谭力等[23]的方法测定。称取内容物0.4 g,加1.6 mL超纯水涡旋混匀,在5000 r/min条件下离心20 min;吸取上清0.8 mL,加入0.2 mL 50% H2SO4,再加入1 mL含内标物2-甲基戊酸50 μg/mL的乙醚溶液。涡旋混匀后,在12000 r/min条件下离心10 min,至冰箱(4 ℃)放置30 min。静置结束后,取上层乙醚相进行GC分析。
1.2.3.2 标准曲线绘制 精密称取乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸适量,加乙醚制成分别约含0.5 mg/mL的溶液,为储备液。取储备液和内标溶液,配制成含标准品最终浓度各1000、400、200、100、50、10、5 μg/mL的系列溶液(各含内标50 μg/mL),进样分析。以标准物和内标物浓度的比为横坐标,对应峰面积比为纵坐标,绘制标准曲线。
1.2.3.3 色谱分析条件 色谱柱为DB-FFAP(30 m×0.25 mm×0.25 μm),进样口温度220 ℃,进样量1 μL,分流比5∶1,载气为氦气(99.999%);柱流量2.00 mL/min,柱温100 ℃保留1 min,5 ℃/min 升温至170 ℃,以30 ℃/min升至230 ℃(保留2 min)。氢焰离子化检测器(FID)检测温度230 ℃,空气流量400 mL/min,氢气流量40 mL/min,尾吹(氮气)流量30 mL/min。
1.3 统计学处理
采用GraphPad Prism 6软件作图,结果以平均值±标准差(mean±SD)表示。数据采用单因素ANNOVA进行显著性分析,并Turkey HSD法两两比较,p<0.05为差异显著,p<0.01为差异极显著(SPSS 19.0)(IBM,美国)。
2 结果与分析
2.1 标准SCFAs与结肠内容物SCFAs色谱分离结果
图1及图2分别为本实验中标准品及实验动物结肠内容物样品乙酸(4.2 min)、丙酸(5.3 min)、异丁酸(5.7 min)、丁酸(6.6 min)、异戊酸(7.3 min)、戊酸(8.5 min)及内标物2-甲基戊酸(9.0 min)的出峰色谱图。从图中可看出六种SCFAs所对应的色谱峰分离清晰,峰型较理想,基线比较平稳,杂质峰干扰较小,表明样品前处理及色谱分离条件合适。
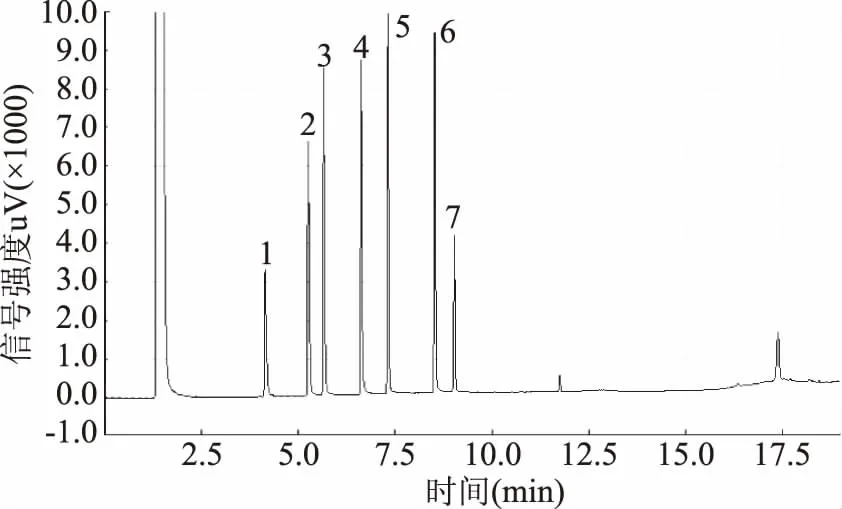
图1 六种SCFAs标准品色谱图Fig.1 Gas chromatogram of six standards of SCFAs注:1.乙酸(4.2 min);2.丙酸(5.3 min);3.异丁酸(5.7 min);4.丁酸(6.6 min);5.异戊酸(7.3 min);6.戊酸(8.5 min);7. 内标物:2-甲基戊酸(9.0 min);图2同。
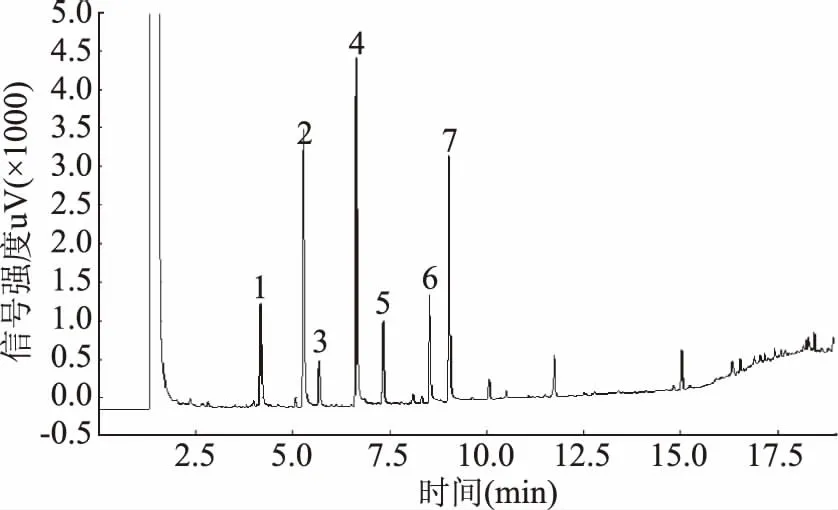
图2 高脂饮食大鼠结肠内容物SCFAs色谱图Fig.2 Gas chromatogram of SCFAs in colon contents of rats fed a high fat diet
2.2 PSE对高脂饮食大鼠结肠内容物SCFAs含量的影响
2.2.1 PSE对高脂饮食大鼠结肠总SCFAs含量的影响 由图3可看出,BC组SCFAs总含量较NC组增加了33.63%(p>0.05),表明高脂饮食会使大鼠结肠中总SCFAs水平有升高的趋势。此结果与高脂低纤饮食显著升高Wistar大鼠粪便总SCFAs的结果一致[4]。而不同剂量PSE干预后总SCFAs含量分别较BC组降低了32.73%(p>0.05)和49.15%(p<0.05),其变化趋势与NC组更接近。表明PSE干预可抑制高脂饮食引起的大鼠结肠中SCFAs水平的升高。
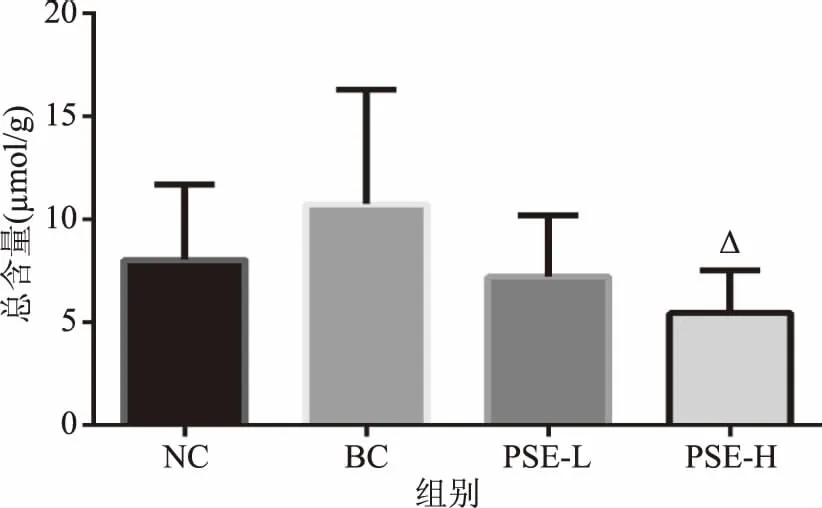
图3 PSE对高脂饮食大鼠结肠内容物中总SCFAs含量的影响Fig.3 Effects of PSE on total SCFAs in colon contents of rats fed a high fat diet注:Δ表示与 BC相比,有显著差异(p<0.05)。图4、图9同。
2.2.2 PSE对高脂饮食大鼠结肠内容物乙酸含量的影响 由图4可看出,BC组大鼠结肠内容物乙酸含量较NC组增加了26.05%(p>0.05),表明高脂饮食会使大鼠结肠内容物中乙酸水平有升高的趋势;而PSE干预后乙酸分别较BC组降低了16.42%(p>0.05)和48.64%(p<0.05),其中PSE-L组与NC组接近(p>0.05),而PSE-H组则显著低于BC组(p<0.05)。提示PSE干预会影响高脂饮食引起的大鼠结肠内肠道微环境的变化。此结果与已有研究中植物甾醇对心脑血管疾病大鼠粪便乙酸含量的影响趋势相一致[24]。
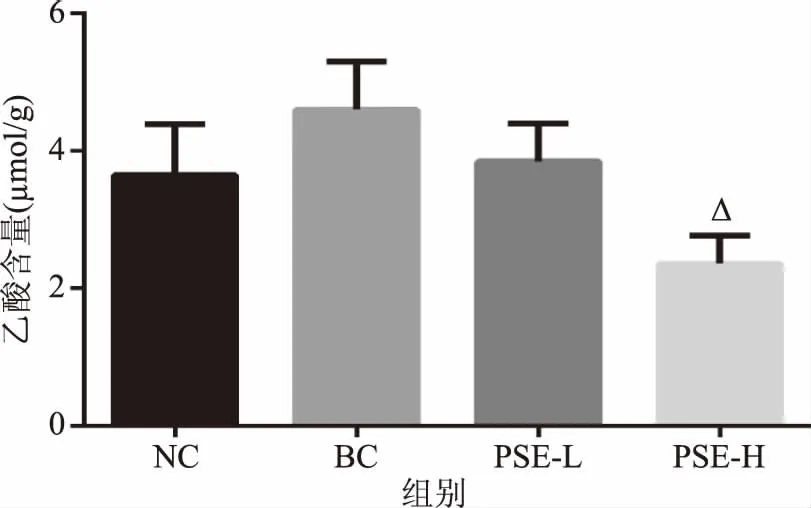
图4 PSE对高脂饮食大鼠结肠内容物中乙酸含量的影响Fig.4 Effects of PSE on acetic acid in colon contents of rats fed a high fat diet
2.2.3 PSE对高脂饮食大鼠结肠内容物丙酸含量的影响 图5中丙酸的变化趋势与乙酸一致,BC组丙酸含量较NC组显著升高了126.07%(p<0.05),而PSE干预后分别较BC组极显著降低了51.52%和58.39%(p<0.01),且均与NC组水平接近(p>0.05)。表明PSE可有效抑制高脂饮食引起的丙酸含量升高。
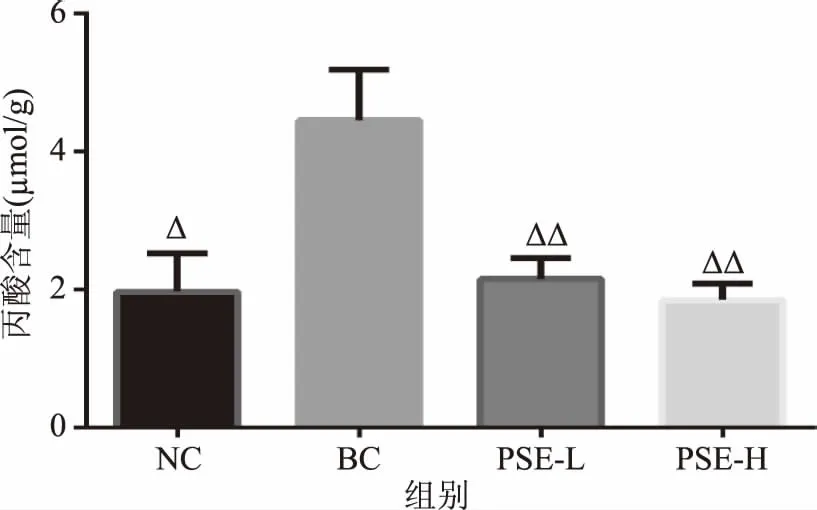
图5 PSE对高脂饮食大鼠结肠内容物中丙酸含量的影响Fig.5 Effects of PSE on propionic acid in colon contents of rats fed a high fat diet注:Δ表示与BC相比,有显著差异(p<0.05),ΔΔ表示与BC相比,有极显著差异(p<0.01)。
丙酸和乙酸均可在肠道内被吸收,作为能量底物参与代谢;但过多的能量摄入容易引起机体代谢失衡,导致脂肪的累积和肥胖等代谢疾病的产生。本实验结果表明PSE干预后有助于抑制高脂饮食引起的大鼠结肠内乙酸和丙酸含量的升高,使其接近正常组水平,提示PSE对高脂饮食下大鼠结肠内微环境可能具有一定的改善作用。
2.2.4 PSE对高脂饮食大鼠结肠内容物丁酸的影响 可以看出,图6中BC组丁酸水平较NC组有一定程度的降低(33.21%)(p>0.05);PSE-L组较NC组和BC组分别极显著降低了73.01%和59.59%(p<0.01),PSE-H组较NC组显著降低了52.90%(p<0.05),较BC组降低了29.48%(p>0.05)。表明高脂饮食会使大鼠结肠内丁酸有下降的趋势,而PSE的干预会增大这种趋势,使丁酸含量显著降低,且低剂量PSE降低效果更显著。有研究显示,健康人群摄入PSE(8.6 g/d)强化的人造奶油后,其粪便中丁酸含量也呈现降低的趋势[25]。
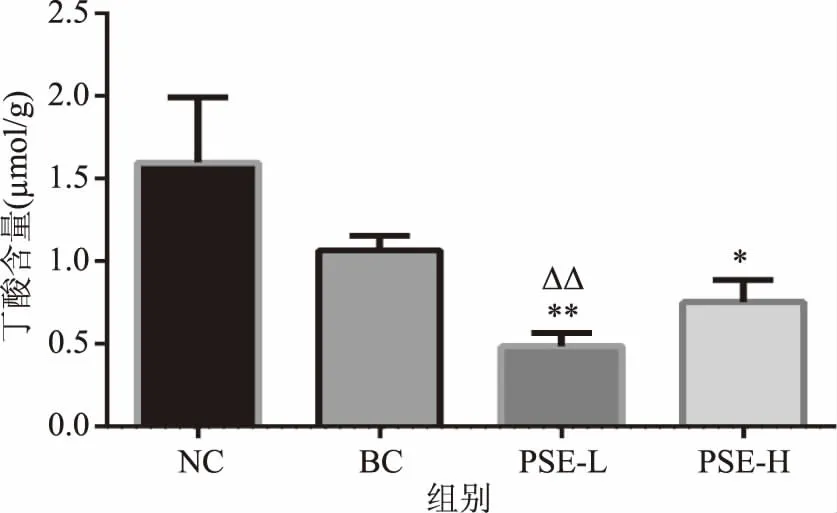
图6 PSE对高脂饮食大鼠结肠内容物中丁酸的影响Fig.6 Effects of PSE on butyric acid in colon contents of rats fed a high fat diet注:*表示与NC相比,有显著差异(p<0.05);**表示与NC相比,有极显著差异(p<0.01);ΔΔ表示与BC相比,有极显著差异(p<0.01)。
丁酸盐作为结肠上皮细胞代谢的能量底物具有重要作用,其可减少炎症介质如TNF-α,IL-8的分泌[26],还可通过抑制IFN-γ的信号传导来调节炎症反应[27],并对上皮细胞屏障功能的恢复发挥有益作用[28]。本实验中PSE干预可使高脂饮食大鼠结肠中丁酸含量进一步降低,这可能会对肠道微环境具有潜在的不利影响,但具体的作用及其机制尚有待进一步研究。
2.2.5 PSE对高脂饮食大鼠结肠内容物异丁酸的影响 图7显示,虽然各组间异丁酸含量无显著差异(p>0.05),但总体上,高脂饮食组大鼠结肠内异丁酸水平最高,较NC组增加了23.41%;PSE干预组分别较BC组降低了35.75%和43.37%。
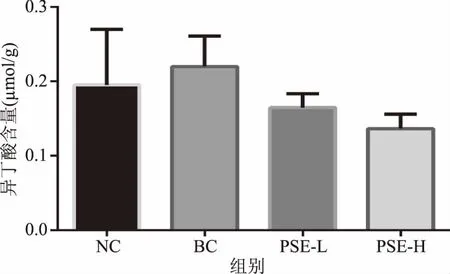
图7 PSE对高脂饮食大鼠结肠内容物中异丁酸的影响Fig.7 Effects of PSE on isobutyric acid in colon contents of rats fed a high fat diet
2.2.6 PSE对高脂饮食大鼠结肠内容物戊酸的影响 图8中显示高脂饮食会使大鼠结肠内容物戊酸水平有下降趋势,BC组较NC组降低了23.92%(p>0.05)。PSE干预组较BC组分别显著降低了72.07%和69.12%(p<0.05),较NC组分别显著降低了78.75%和76.50%(p<0.05)。PSE浓度对戊酸降低的效果无明显差别。作为结肠上皮细胞的能量来源之一[6],戊酸的降低有可能会对肠道健康带来潜在的不利影响。鉴于啮齿类动物与人类代谢特点有所不同,尚需进一步研究。
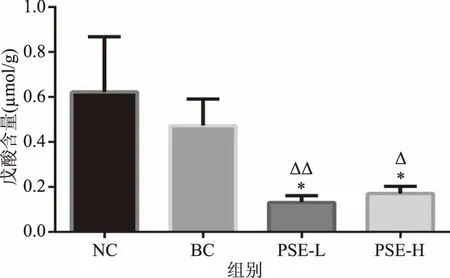
图8 PSE对高脂饮食大鼠结肠内容物中戊酸的影响Fig.8 Effects of PSE on valeric acid in colon contents of rats fed a high fat diet注:*表示与NC相比,有显著差异(p<0.05);Δ表示与BC相比,有显著差异(p<0.05)。
2.2.7 PSE对高脂饮食大鼠结肠内容物异戊酸的影响 由图9中数据可看出,BC组较NC组异戊酸增加了42.11%(p>0.05);PSE干预组较BC组分别显著降低了60.66%和58.59%(p<0.05),与NC组更接近(p>0.05),但不同浓度的PSE对异戊酸降低效果无明显差别。由于戊酸与异戊酸主要由蛋白质发酵产生[21],因此其含量的降低提示结肠内蛋白质发酵减少,有利于维持机体肠道环境健康。

图9 PSE对高脂饮食大鼠结肠内容物中异戊酸的影响Fig.9 Effects of PSE on isovaleric acid in colon contents of rats fed a high fat diet
3 结论与讨论
SCFAs具有多种生理活性,是维持机体肠道健康和内环境平衡的重要物质,可以发挥多方面的肠道和系统性效应。如,作为结肠细胞的能量来源,提高肠道通透性,改善肠道环境,调节能量稳态和代谢,调节免疫细胞趋化性,发挥抗炎、抗癌活性和抗微生物活性等[29]。此外,SCFAs还参与胆固醇的合成,与肥胖、胰岛素抵抗和2型糖尿病等疾病关联[30];其在食欲调节中也起重要作用。
本实验利用高脂饲料饲喂SD大鼠,检测结肠内容物中SCFAs的含量,发现高脂饮食会降低大鼠结肠内容物中丁酸和戊酸的含量,升高乙酸、异戊酸及丙酸的含量;对异丁酸含量无影响,总体上使SCFAs的含量升高。表明长期高脂饮食可导致肠道微生态的变化,进而影响结肠内SCFAs水平[25]。具体地,高脂饮食会使大鼠肠道内厚壁菌门增多,拟杆菌门减少[31],而前者正是发酵产生SCFAs的关键菌之一[30]。同时也有研究证实肥胖相关的微生物群具有更强的发酵碳水化合物的能力[32-33]。此外,由缬氨酸和亮氨酸发酵产生的异丁酸和异戊酸属于支链脂肪酸(branched chain fatty acids,BCFAs)[34],可以用来评估结肠内蛋白质的发酵程度。虽然蛋白质发酵时会产生少量的SCFAs[35],但其副产物,如NH3、酚类、吲哚类、H2S和胺类等对肠道粘膜细胞有害,因此蛋白质发酵通常被认为是不利于机体健康的一类反应[36]。本实验中,高脂组大鼠结肠内容物中异丁酸和异戊酸较正常组均略有上升,可能与蛋白质发酵增强有关。
PS/PSE是食品中的活性成分,具有良好的降脂作用。已有研究证明,PS/PSE的肠吸收率小于2%,显著低于肠道对胆固醇的吸收率(约为50%)[37],且极少被微生物利用[25],因此推测PSE随着食物残渣进入结肠,通过影响其中胆固醇的吸收和排泄而改变肠道内环境,导致肠道菌种类和丰度的变化,进而间接调节结肠内容物中SCFAs的含量。本研究发现PSE干预后能够抑制高脂饮食所引起的大鼠肠道中SCFAs水平的升高,使其维持在与正常组相近的水平。值得注意的是,PSE干预可抑制高脂饮食引起的大鼠结肠内乙酸和丙酸的升高。低剂量PSE可使大鼠结肠内乙酸维持在与正常对照组相近的水平,而高剂量PSE降乙酸的作用较低剂量组更明显。而不同剂量PSE均可显著降低丙酸水平,且与正常对照组相近。一方面,这两种酸能作为脂肪和糖原生成的底物被肝脏吸收[38];另一方面,过量产生的乙酸和丙酸会在肝脏中直接转化为甘油三酯[39],增加肝脏脂肪的累积,可能会引起肝脏的脂肪病变。尽管肠道菌分解复杂多糖产生SCFAs,增强了宿主消化膳食纤维的能力,但同时也增加了宿主的能量摄入[40-41]。因此,上述乙酸和丙酸的含量降低可能是PSE发挥其降脂生理活性的机制之一:即通过控制肠道的能量吸收,减少机体尤其是肝脏的脂质积累,有助于预防非酒精性脂肪肝的产生[16]。另外,PSE干预可降低高脂饮食大鼠结肠中异丁酸、戊酸、异戊酸的含量,表明PSE可有效减少结肠内的蛋白质酵解,对结肠健康发挥一定的有益作用。
本实验中,PSE干预会显著降低高脂饮食大鼠结肠内容物中丁酸和戊酸水平。丁酸作为最有效的肠道细胞营养物质,对维持细胞形态,抑制肿瘤细胞转化具有重要意义[42];丁酸和戊酸还可降低肠腔内pH,有利于抑制病原微生物的繁殖,增加营养物质的吸收[43]。考虑到啮齿类动物与人类代谢特点存在一定差异,并且本实验中PSE干预后SCFAs总的变化趋势与正常对照组较接近,因此,PSE干预对结肠上皮细胞形态以及结肠正常生理功能是否有不利影响还有待进一步研究。此外,本实验仅研究了高脂饮食状态下PSE对大鼠肠道SCFAs的影响,正常饮食状态下其对肠道SCFAs的作用效果尚不明确。
[1]Den B G,Bleeker A,Gerding A,et al. Short-chain fatty acids protect against high-fat diet-induced obesity via a pparγ-dependent switch from lipogenesis to fat oxidation.[J]. Diabetes,2015,64(7):2398-408.
[2]Resta S C. Effects of probiotics and commensals on intestinal epithelial physiology:implications for nutrient handling[J]. The Journal of physiology,2009,587(17):4169-4174.
[3]任婷婷,卢放根,张尤历,等. 高脂饮食对SD大鼠肠道菌群的影响[J]. 世界华人消化杂志,2010,18(25):2694-2697.
[4]Jakobsdottir G,Xu J,Molin G,et al. High-fat diet reduces the formation of butyrate,but increases succinate,inflammation,liver fat and cholesterol in rats,while dietary fibre counteracts these effects[J]. Plos One,2013,8(11):e80476.
[5]Schwiertz A,Taras D,Schäfer K,et al. Microbiota and SCFA in lean and overweight healthy subjects.[J]. Obesity,2010,18(1):190-195.
[6]Ríoscovián D,Ruasmadiedo P,Margolles A,et al. Intestinal short chain fatty acids and their link with diet and human health[J]. Frontiers in Microbiology,2016,7:185.
[7]Raman M,Ambalam P,Doble M. Probiotics and bioactive carbohydrates in colon cancer management.[M]. India:Springer India,2016.
[8]Morrison D J,Preston T. Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism[J]. Gut Microbes,2016,7(3):189-200.
[9]Gao Z,Yin J,Zhang J,et al. Butyrate improves insulin sensitivity and increases energy expenditure in mice.[J]Diabetes,2009,58(7):1509-1517
[10]Kondo T,Kishi M,Fushimi T,et al. Vinegar intake reduces body weight,body fat mass,and serum triglyceride levels in obese Japanese subjects.[J]. Bioscience Biotechnology & Biochemistry,2009,73(8):1837-1843.
[11]Lin H V,Frassetto A,Jr E J K,et al. Butyrate and propionate protect against diet-induced obesity and regulate gut hormones via free fatty acid receptor 3-independent mechanisms[J]. Plos One,2012,7(4):e35240.
[12]De Vadder F,Kovatcheva-Datchary P,Goncalves D,et al. Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits[J]. Cell,2014,156(1):84-96.
[13]Luo X,Su P,Zhang W. Advances in microalgae-derived phytosterols for functional food and pharmaceutical applications[J]. Marine Drugs,2015,13(7):4231-4254.
[14]Hernándezledesma B,Herrero M,Hernándezledesma B,et al. Bioactive compounds from marine foods:plant and animal sources.[M].John Wiley & Sons,2013:249-313.
[15]Dziedzic K,Szwengiel A,Górecka D,et al. The effect of processing on the phytosterol content in buckwheat groats and by -products[J]. Journal of Cereal Science,2016,69(3):25-31.
[16]Song L,Qu D,Zhang Q,et al. Phytosterol esters attenuate hepatic steatosis in rats with non-alcoholic fatty liver disease rats fed a high-fat diet[J]. Scientific Reports,2017,7:41604.
[17]Dumolt J H,Rideout T C. The lipid-lowering effects and associated mechanisms of dietary phytosterol supplementation[J].Current Pharmaceutical Design,2017.
[18]Scholz B,Guth S,Engel K H,et al. Phytosterol oxidation products in enriched foods:occurrence,exposure,and biological effects[J]. Molecular Nutrition & Food Research,2015,59(7):1339-1352.
[19]Azlina M,Qodriyah H,Norazlina M,et al. Palm oil-derived phytosterol:glutathione antioxidant status in rats exposed to carbon tetrachloride[J]. 2016,6(8):90-95.
[20]Hu Q,Zhao Z,Fang S,et al. Phytosterols improve immunity and exert anti-inflammatory activity in weaned piglets[J]. Journal of the Science of Food & Agriculture,2017.
[21]Martínez I,Perdicaro D J,Brown A W,et al. Diet-induced alterations of host cholesterol metabolism are likely to affect the gut microbiota composition in hamsters[J]. Applied & Environmental Microbiology,2013,79(2):516-524
[22]Zhao G,Nyman M,Jönsson J A. Rapid determination of short-chain fatty acids in colonic contents and faeces of humans and rats by acidified water-extraction and direct-injection gas chromatography[J]. Biomedical Chromatography,2006,20(8):674-682.
[23]谭力,鞠熀先,黎介寿. 生物样品中短链脂肪酸的提取与测定[J]. 色谱,2006,24(1):81-87.
[24]张蕾. 植物甾醇及制品降心脑血管疾病风险的功能性评价[D]. 天津:天津商业大学,2014.
[25]Ayesh R,Weststrate J A,Drewitt P N,et al. Safety evaluation of phytosterol esters. Part 5. Faecal short-chain fatty acid and microflora content,faecal bacterial enzyme activity and serum female sex hormones in healthy normolipidaemic volunteers consuming a controlled diet either with or without a phytosterol ester-enriched margarine[J]. Food and Chemical Toxicology,1999,37(12):1127-1138.
[26]Rodríguezcabezas M E,Gálvez J,Lorente M D,et al. Dietary fiber down-regulates colonic tumor necrosis factor alpha and nitric oxide production in trinitrobenzenesulfonic acid-induced colitic rats[J]. Journal of Nutrition,2002,132(11):3263-3271.
[27]Klampfer L,Huang J,Sasazuki T,et al. Inhibition of interferonγsignaling by the short chain fatty acid butyrate[J]. Molecular Cancer Research,2003,1(11):855-862.
[28]Venkatraman A,Ramakrishna B S,Pulimood A B. Butyrate hastens restoration of barrier function after thermal and detergent injury to rat distal coloninvitro[J]. Scandinavian Journal of Gastroenterology,1999,34(11):1087-1092.
[29]Xu J,Chen H,Li S. Understanding the molecular mechanisms of the interplay between herbal medicines and gut microbiota[J]. Medicinal Research Reviews,2017,37(5):1140-1185.
[30]Nicholson J K,Holmes E,Kinross J,et al. Host-gut microbiota metabolic interactions[J]. Science,2012,336(6086):1262-1267.
[31]Aron-Wisnewsky J,Gaborit B,Dutour A,et al. Gut microbiota and non-alcoholic fatty liver disease:new insights[J]. Clinical Microbiology and Infection,2013,19(4):338-348.
[32]Turnbaugh P J,Ley R E,Mahowald M A,et al. An obesity-associated gut microbiome with increased capacity for energy harvest[J]. Nature,2006,444(7122):1027-1031.
[33]Turnbaugh P J,Bäckhed F,Fulton L,et al. Diet-induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome[J]. Cell Host & Microbe,2008,3(4):213-223.
[34]Smith E A,Macfarlane G T. Dissimilatory amino acid metabolism in human colonic bacteria[J]. Anaerobe,1997,3:327-337.
[35]Blachier F,Mariotti F,Huneau J F,et al. Effects of amino acid-derived luminal metabolites on the colonic epithelium and physiopathological consequences[J]. Amino Acids,2007,33:547-562.
[36]周中凯,杨艳,郑排云,等. 肠道微生物蛋白质的发酵与肠道健康的关系[J]. 食品科学,2014,35(1):303-309.
[37]Ostlund R E,McGill J B,Zeng C M,et al. Gastrointestinal absorption and plasma kinetics of soy Δ 5-phytosterols and phytostanols in humans[J]. American Journal of Physiology-Endocrinology and Metabolism,2002,282(4):E911-E916.
[38]Caricilli A M,Saad M J A. The Role of Gut Microbiota on Insulin Resistance[J]. Nutrients,2013,5(3):829.
[39]Gangarapu V,Yldz K,Ince A T,et al. Role of gut microbiota:obesity and NAFLD[J]. Turkish Journal of Gastroenterology,2014,25(2):133-140.
[40]Flint H J,Bayer E A,Rincon M T,et al. Polysaccharide utilization by gut bacteria:potential for new insights from genomic analysis[J]. Nature Reviews Microbiology,2008,6(2):121-131.
[41]Samuel B S,Shaito A,Motoike T,et al. Effects of the gut microbiota on host adiposity are modulated by the short-chain fatty-acid binding G protein-coupled receptor,Gpr41[J]. Proceedings of the National Academy of Sciences,2008,105(43):16767-16772.
[42]杨月欣,王竹,洪洁,等. 抗性淀粉结肠内酵解对大鼠肠道健康的影响[J]. 世界华人消化杂志,2004,12(11):2618-2622.
[43]Macfarlane G T,Macfarlane S. Bacteria,colonic fermentation,and gastrointestinal health[J]. Journal of AOAC International,2012,95(1):50-60.
