响应面法优化石上柏穗花杉双黄酮提取工艺
2018-04-25田应彪蒋永梅袁仕梦
王 刚,田应彪,蒋永梅,何 群,袁仕梦,魏 玮
(遵义医学院药学院,贵州遵义 563000)
石上柏(SelaginelladoederleiniiHieron.)属于蕨类卷柏科卷柏属植物,多年生草本,也叫深绿卷柏,多分布在我国贵州、四川、重庆、广西等地。该植物具有食用、药用、保健价值,具有抗氧化[1-2]、抗炎[3]、抗肿瘤、抗诱变和抗突变的作用[4-8]。该植物含有双黄酮、生物碱、木质素、有机酸等化合物,其中双黄酮是该植物主要的有效成分[9]。
穗花杉双黄酮(amentoflavone)是石上柏中的双黄酮化合物之一,是控制石上柏质量的指标成分(结构式如图1所示),在药材中含量约为0.3%~0.7%[10]。如前面所述,穗花杉双黄酮具有较强的抗氧化、降血脂、抗菌及抗肿瘤等作用[11-14]。目前未见石上柏穗花杉双黄酮提取工艺的研究报道,本文为了节约溶剂,同时改善提取效率,重点考察微波辅助提取穗花杉双黄酮的效果,并结合响应面法优化工艺参数。

图1 穗花杉双黄酮的结构式Fig.1 Chemical structures of amentoflavone
1 材料与方法
1.1 材料与仪器
石上柏 采自贵州赤水,编号:SD20130916,存放于遵义医学院生药学实验室;穗花杉双黄酮标准品 生产批号:160622,成都瑞芬恩生物有限公司;甲醇、乙腈 均为色谱纯,成都科龙试剂公司。
1100高效液相色谱仪、1100二极管阵列检测器 美国安捷伦公司;C18Symmetry®色谱柱 美国Waters公司;SECURA124-1CN电子分析天平 德国赛多利斯公司;KQ118超声波清洗器 北京佳源兴业科技有限公司;DZ-2A型电热真空干燥箱 北京北空兴源涛科贸有限公司;旋转蒸发仪 西安太康生物科技有限公司;Xinyi-1A微波提取仪 杭州艾普仪器设备有限公司;FW80型高速万能粉碎机 天津泰斯特仪器有限公司。
1.2 实验方法
1.2.1 穗花杉双黄酮溶液的提取 取干燥好的石上柏药材10 g粉碎,过40目筛,置250 mL圆底烧瓶中,加入一定体积的95%乙醇,设置一定微波功率,在一定的时间和温度下进行微波提取,提取完成后过滤,将滤液减压浓缩,转移到100 mL容量瓶中,用乙醇定容作为穗花杉双黄酮溶液。通过液相分析,测定穗花杉双黄酮的峰面积,利用线性回归方程计算穗花杉双黄酮的含量,从而得到石上柏中穗花杉双黄酮的得率。
1.2.2 单因素实验
1.2.2.1 固液比对得率的影响 固定温度为50 ℃,提取功率为400 W,时间40 min,研究固液比1∶5、1∶10、1∶15、1∶20、1∶25和1∶30 g/mL对穗花杉双黄酮得率的影响。
1.2.2.2 提取温度对得率的影响 固液比1∶20 g/mL,提取功率为400 W,时间40 min,研究提取温度30、40、50、60、70 ℃对穗花衫双黄酮得率的影响。
1.2.2.3 微波功率的影响 固液比1∶20 g/mL,提取功率为400 W,提取时间40 min,提取温度50 ℃,研究微波功率100、300、500、700、900 W对石上柏穗花衫双黄酮得率的影响。
1.2.2.4 提取时间的影响 固液比1∶20 g/mL,提取功率为400 W,提取温度50 ℃,研究提取时间为10、20、30、40、50、60 min对石上柏穗花衫双黄酮得率的影响。
1.2.3 响应面实验设计 以提取温度、微波功率、提取时间为自变量,以石上柏提取物中穗花杉双黄酮得率为响应值Y,根据Box-Behnken的中心组合原理进行实验设计,实验因素和水平见表1。
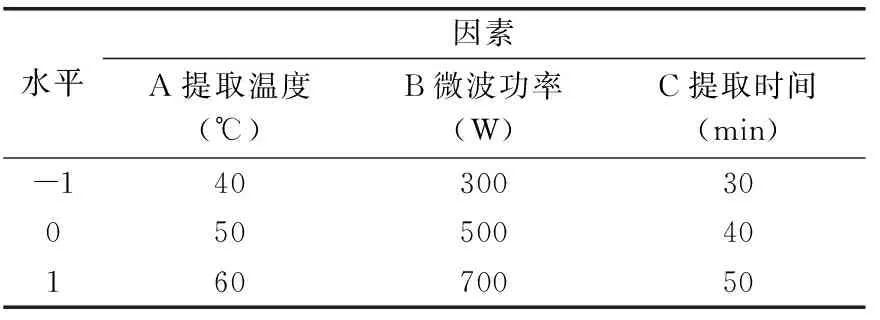
表1 因素水平表Table 1 Factors and levels table
1.2.4 标准品溶液的制备 精密称取穗花杉双黄酮标准品19.5 mg,加甲醇适量同置25 mL容量瓶中,200 W超声溶解,室温静置,并用甲醇定容,摇匀,配制成0.78 mg/mL的穗花杉双黄酮的溶液。
1.2.5 标准曲线的制作 精密吸取穗花杉双黄酮标准品溶液1、2、3、4、5、6 mL,分别置于 10 mL 容量瓶中,加甲醇定容,摇匀,得系列对照品溶液,分别注入高效液相色谱仪中测定峰面积。以对照品峰面积为纵坐标,浓度为横坐标,绘制标准曲线,得到穗花杉双黄酮回归方程为:Y=5293X-2881.8,相关系数R2=0.9995。结果表明穗花杉双黄酮的浓度在78.0~468.0 μg/mL范围内与峰面积积分值呈良好线性关系。
1.2.6 HPLC检测波长的选择 实验中对穗花杉双黄酮溶液进行紫外全波长扫描,综合最大吸收情况,实验结果提示,检测波长为330 nm时的色谱峰灵敏度高,峰面积较好,所以确定330 nm为检测波长。
1.2.7 HPLC流动相的选择 色谱柱:DikmaDiamons C18柱(150 mm×4.6 mm,5 μm);流动相:乙腈-0.1%甲酸水,采用梯度洗脱程序(表2);检测波长:330 nm;柱温:25 ℃;流速:0.6 mL/min;进样量:10 μL;进样前样品用0.45 μm微孔滤膜过滤。在上述条件下,穗花杉双黄酮与其它色谱峰达到了基线分离。
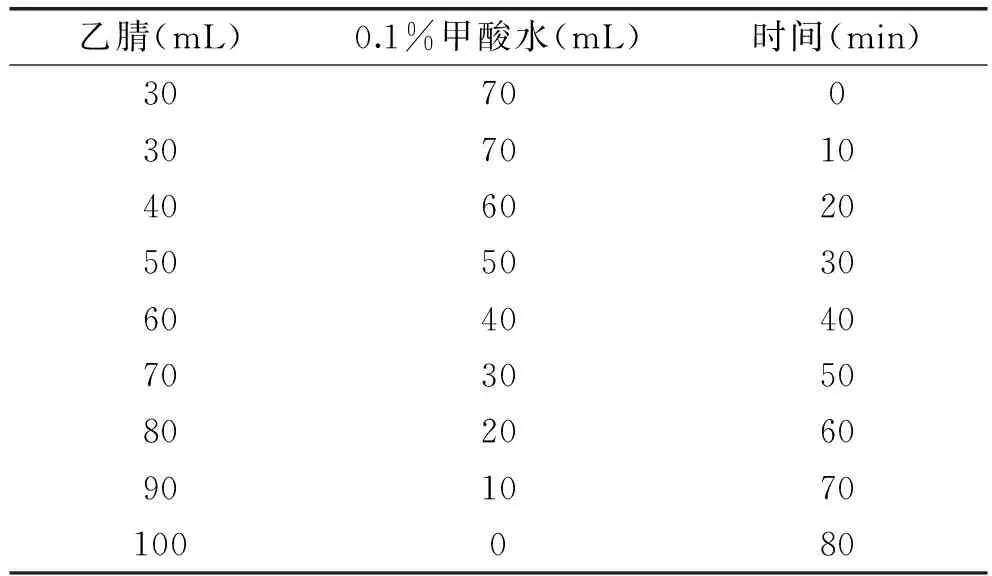
表2 HPLC梯度洗脱程序Table 2 HPLC gradient elution program
1.2.8 微波提取法与其他提取方法的比较 本文将微波辅助提取法与传统的2种提取方法相比较,以穗花杉双黄酮的得率为考察指标,比较三种提取方法之间的差异。
1.2.8.1 乙醇回流提取法 取10.0 g石上柏于烧瓶中,加120 mL 95%乙醇(固液比1∶12 g/mL),置于80 ℃恒温水浴锅,提取2 h,过滤,取滤液于1000 mL容量瓶中,加95%乙醇定容至刻度。平行实验3次[15]。
1.2.8.2 索氏提取法 取10.0 g石上柏用滤纸包裹放入索式提取器内,并加入200 mL 95%乙醇,加热回流,虹吸 2 h。将提取液倒入1000 mL容量瓶中,加95% 乙醇定容至刻度。平行实验3次[15]。
1.2.9 穗花杉双黄酮得率的计算 穗花杉双黄酮得率(%)=(c×100 mL)/m×100,式中,m为石上柏药材总质量(g);c为石上柏中穗花杉双黄酮的浓度(g/mL)[16]。
1.3 数据处理
2 结果与分析
2.1 单因素实验
2.1.1 固液比对得率的影响 由图2可知,随着固液比例的增大,产品得率随之增加,当固液比在1∶15~1∶25 g/mL时,得率基本没有明显变化。这可能是由于药材中双黄酮的量是一定的,继续增加溶剂,很难得到更多的目标产物,但得率较高。考虑到固液比的增加会造成后处理的困难以及溶剂的浪费。因此,固液比选择1∶15 g/mL。
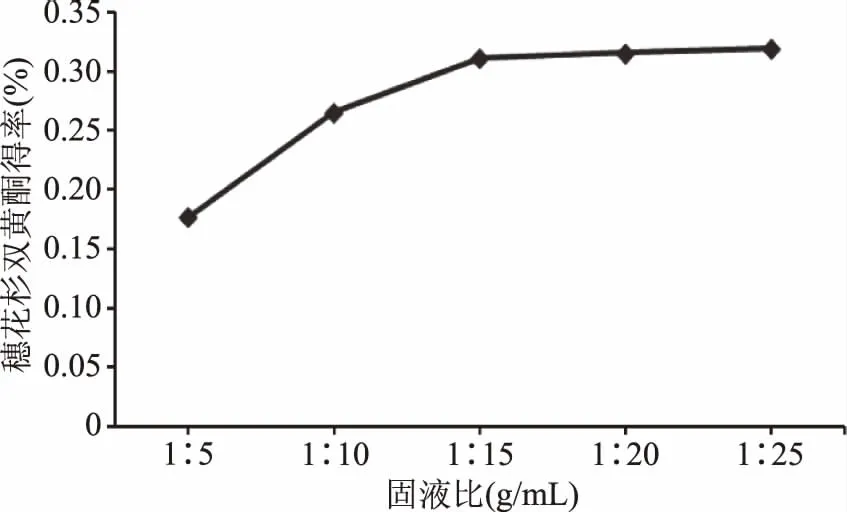
图2 固液比对穗花杉双黄酮得率的影响 Fig.2 Effect of solid-liquid ratio on yield of amentoflavone
2.1.2 提取温度对得率的影响 由图3可知,随着温度的增加,产品得率随之增加,当温度高于50 ℃后,产品得率随之下降,这可能是由于温度增高、氧化加快等原因,使得具有一定热不稳定性的黄酮类成分的化学结构发生变化,转变成非黄酮类成分,因而产品得率会减少。因此,在响应面分析中,选择在40~60 ℃的范围内进行优化。
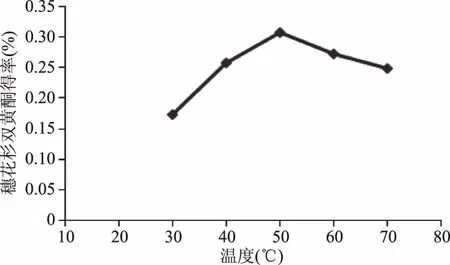
图3 提取温度对穗花杉双黄酮得率的影响 Fig.3 Effect of temperature on yield of amentoflavone
2.1.3 微波功率的影响 由图4可知,随着微波功率上升,产品的得率随之增加,当微波功率超过500 W,产品的得率开始减少,经过反复实验,可能是当微波功率过高时,温度不易控制,同时反应体系温度开始上升,使受热不稳定的黄酮类成分氧化转变成非黄酮类成分,因而产率下降。因此,在响应面分析中,选择在300~700 W的范围内进行优化。

图4 微波功率对穗花杉双黄酮得率的影响 Fig.4 Effect of microwave power on yield of amentoflavone
2.1.4 提取时间的影响 由图5可知,当提取时间小于40 min时,随着提取时间的增加,得率增加。当超过40 min时,随着提取时间的增加,得率则反而呈现出下降的趋势,这可能是由于穗花杉双黄酮含有多个酚羟基,时间过长,在高温下容易被氧化。因此,在响应面分析中,选择在30~50 min的范围内进行优化。
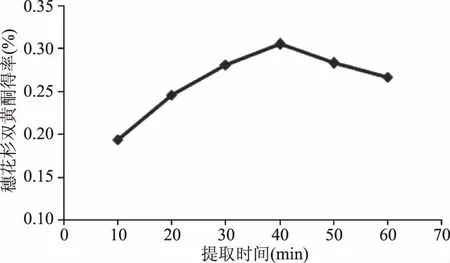
图5 提取时间对穗花杉双黄酮得率的影响 Fig.5 Effect of extraction time on yield of amentoflavone
2.2 响应面实验结果分析
2.2.1 提取工艺参数的优化 通过Design-Expert软件进行二次响应面回归分析(结果见表3和表4),得到如下多元二次响应面回归模型:Y(%)=-1.48169+0.052A+5.125×10-4B+0.0264C+2.5×10-6AB-1.92554×10-18AC+6.25×10-6BC-5.675×10-4A2-9.8125×10-7B2-3.925×10-4C2。
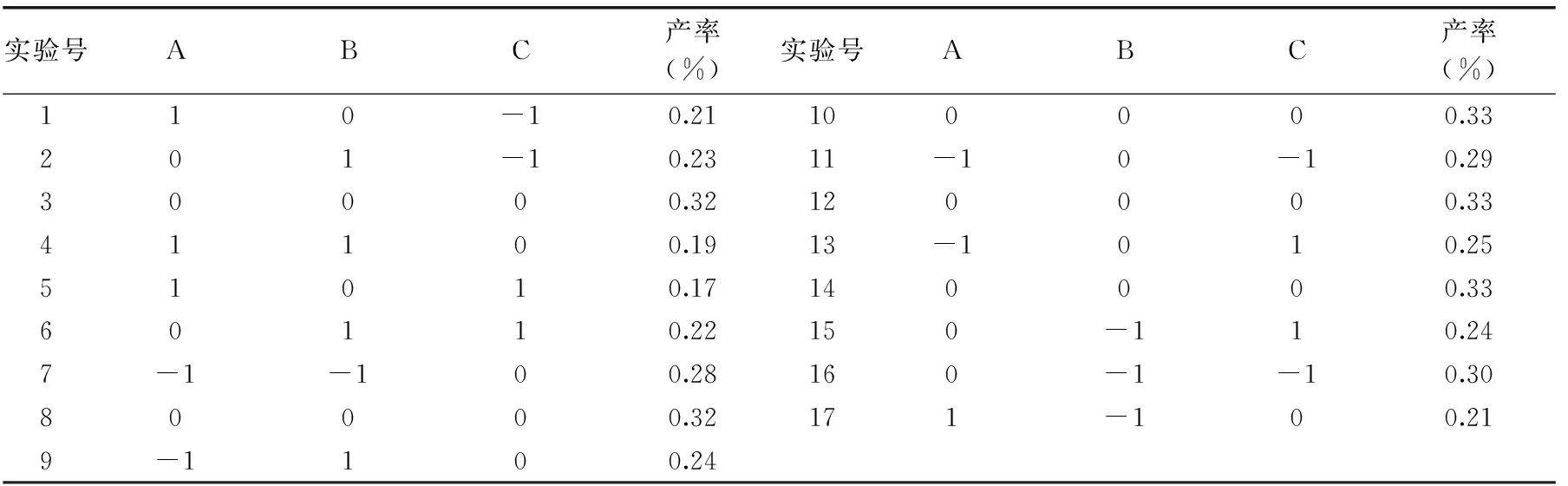
表3 响应面实验设计与结果Table 3 The results of experiment design

表4 响应面法分析结果Table 4 Analysis of variance(ANOVA)of the response surface quadratic mode
由表4可知,F=79.81,p<0.0001,表明模型极显著;失拟项F=3.61,p>0.05,不显著,证明回归方程无失拟因素存在,同时,模型R2=0.9903,表明该模型的拟合能够较好地反映实际情况。一次项A、B、C,交互项BC和二次项A2、B2、C2都有显著影响,其中一次项各因素对穗花杉双黄酮得率的影响依次为A>B>C,并且三个二次项A2、B2、C2都为p<0.0001,有极显著影响,说明各因素对响应值的影响不是简单的线性关系,而是存在一定交互作用。模型的变异系数(C.V.)仅为3.04%,在可接受的范围内。另外,调整拟合优度R2=0.9779,“预测拟合度”为0.8831,两者的差值在0.20的可接受范围内。“信噪比”为24.488,表明模型精确;方差分析(ANOVA)与统计学分析的结果表明,该模型完全可用于响应值的预测。
2.2.2 各因素的交互影响分析 根据回归方程得出不同因素之间相互影响结果见图6~图8,从该组图可以分析出多个自变量对响应值的影响。据图6所示为温度与微波功率的交互影响效应,由三维曲线和等高线图可以看出,微波功率较低时,得率随功率呈现先上升后下降的趋势;提取温度较高时,得率随微波功率呈下降趋势,温度越高,下降幅度越大。虽然提取温度和微波功率对响应值而言都具有显著影响,但二者交互对响应值的影响不显著(p>0.05)。
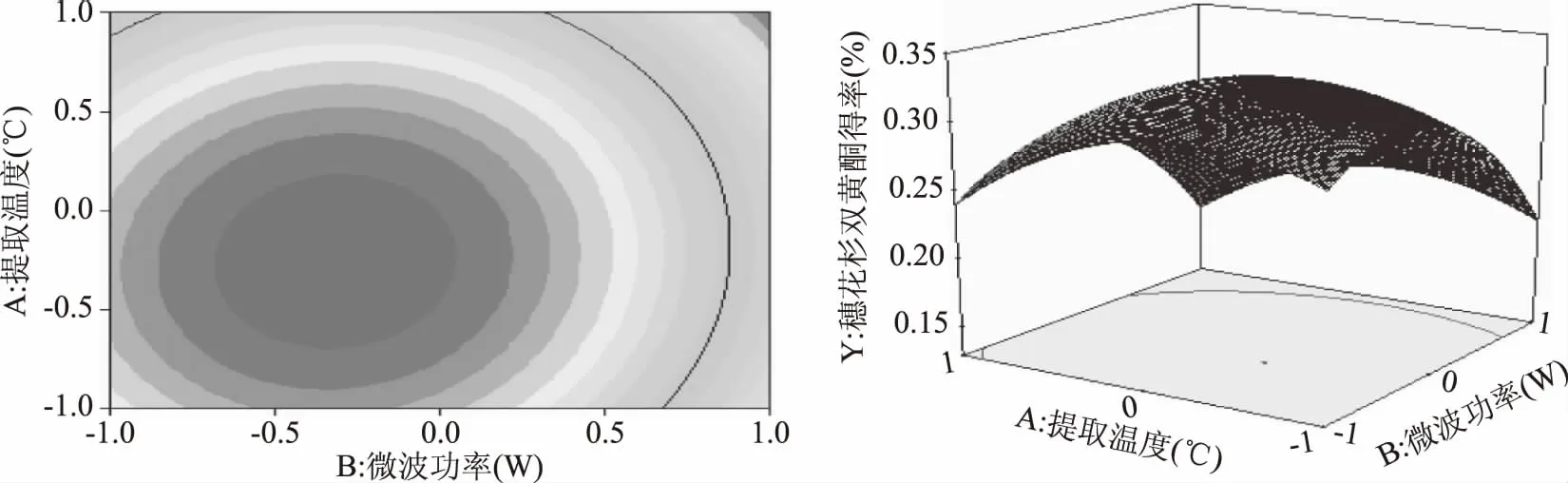
图6 Y=f(A,B)的响应面立体分析及其等高线图 Fig.6 Response surface plots of variable parameters A and B on the yield of amentoflavone
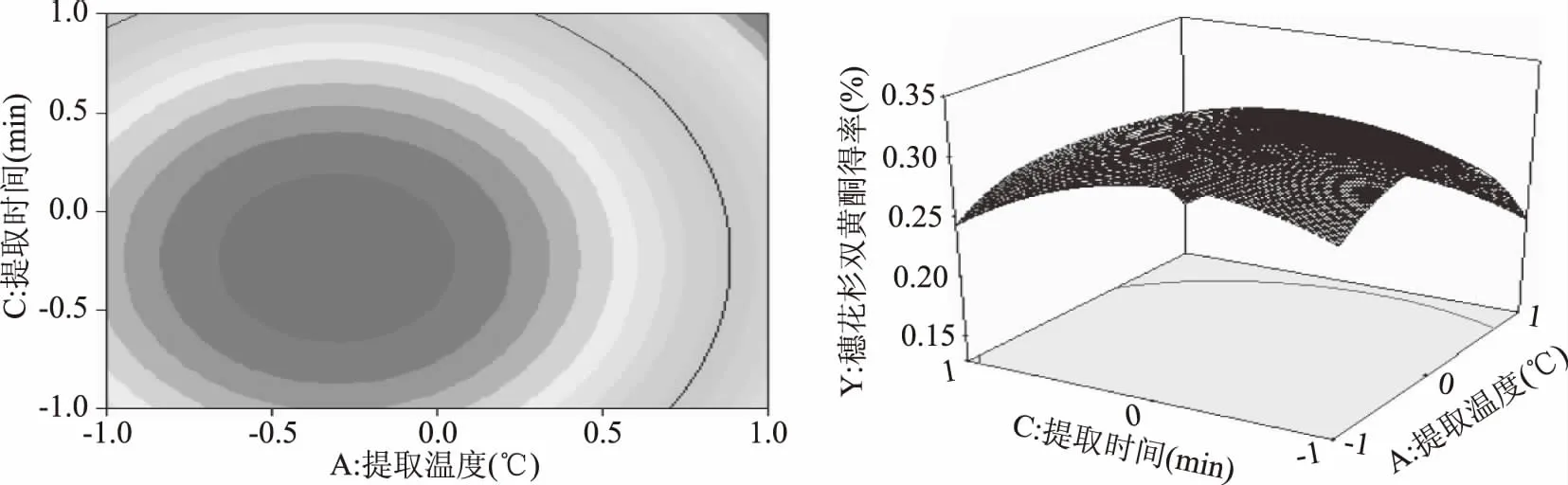
图7 Y=f(A,C)的响应面立体分析及其等高线图 Fig.7 Response surface plots of variable parameters A and C on the yield of amentoflavone
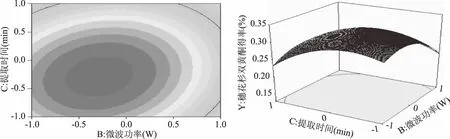
图8 Y=f(B,C)的响应面立体分析及其等高线图 Fig.8 Response surface plots of variable parameters B and C on the yield of amentoflavone
图7显示了微波功率为零水平,提取时间与提取温度对穗花杉双黄酮得率的影响和两者之间的交互作用。提取温度较低时,得率随提取时间呈现先上升后下降的趋势;提取温度较高时,得率随提取时间呈下降趋势,时间越长,下降幅度越大。虽然提取温度和提取时间对响应值而言都具有显著影响,但二者交互对响应值的影响不显著(p>0.05)。
图8给出温度为零水平时,微波功率与时间之间的交互效应的关系。在前50 min,得率随着时间的延长而增加,之后趋于减少。由于双黄酮类化合物含有酚羟基,可能在长时间受热的情况下发生氧化等反应,而使产率减小。在300~500 W范围内,得率随着时间延长而增加,当超过500 W后,得率逐渐减少。并且微波功率和提取时间的交互对响应值的影响显著(p<0.05)。
2.2.3 验证结果 优化得到的最佳提取条件为:微波功率为438.92 W,提取时间为37.13 min,提取温度为46.78 ℃,穗花杉双黄酮得率预测值为0.34%。实际调整微波功率400 W,提取时间为37 min,提取温度为47 ℃,穗花杉双黄酮得率为0.33%±0.08%,与预测值相比较无显著性差异(p>0.05)。
2.3 穗花杉双黄酮含量测定
2.3.1 精密度实验 精密吸取同一供试品溶液,按“1.2.7”项下色谱条件测定,连续进样6次,计算峰面积的RSD为0.32%,表明方法精密度良好。
2.3.2 稳定性实验 精密吸取同一供试品溶液,在室温下分别于0、2、4、8、12 h,按“1.2.7”项下色谱条件测定,计算峰面积的RSD为1.32%,供试品溶液在12 h内基本稳定。
2.3.3 重复性实验 精密称取同批石上柏药材5份,每份样品精密称定8.0 g,按“1.2.4”方法制备及“1.2.7”色谱条件测定峰面积,并计算其含量及相对标准偏差,计算峰面积的RSD为1.35%,表明方法重现性良好。
2.3.4 加样回收率实验 取已知含量的同一批石上柏样品3.5 g(穗花杉双黄酮浓度为2.345 mg/g药材),精密称定,精密加穗花杉双黄酮溶液10.0 mL(浓度为0.78 mg/mL),待溶剂挥干后,依法制成样品溶液,测定,计算回收率。计算穗花杉双黄酮平均回收率为99.03%,RSD为2.03%。实验结果表明方法回收率较好。
2.4 与传统提取方法相比
本研究将微波辅助提取法与传统2种提取方法以穗花杉双黄酮的含量为考察指标进行了对比。如表5所示,微波辅助提取法与其它2种提取方法对比不仅增加了提取效率(穗花杉双黄酮的含量提高了近2倍),还显著地降低了提取时间(从120 min降低到37 min)。通过对3种提取方法进行比较,证明了微波辅助提取法具有巨大的潜力,有望成为一种从石上柏中快速、高效、绿色的提取穗花杉双黄酮的方法。这3种方法的重复性在97.71%~99.62%之间,RSD低于1.00%。
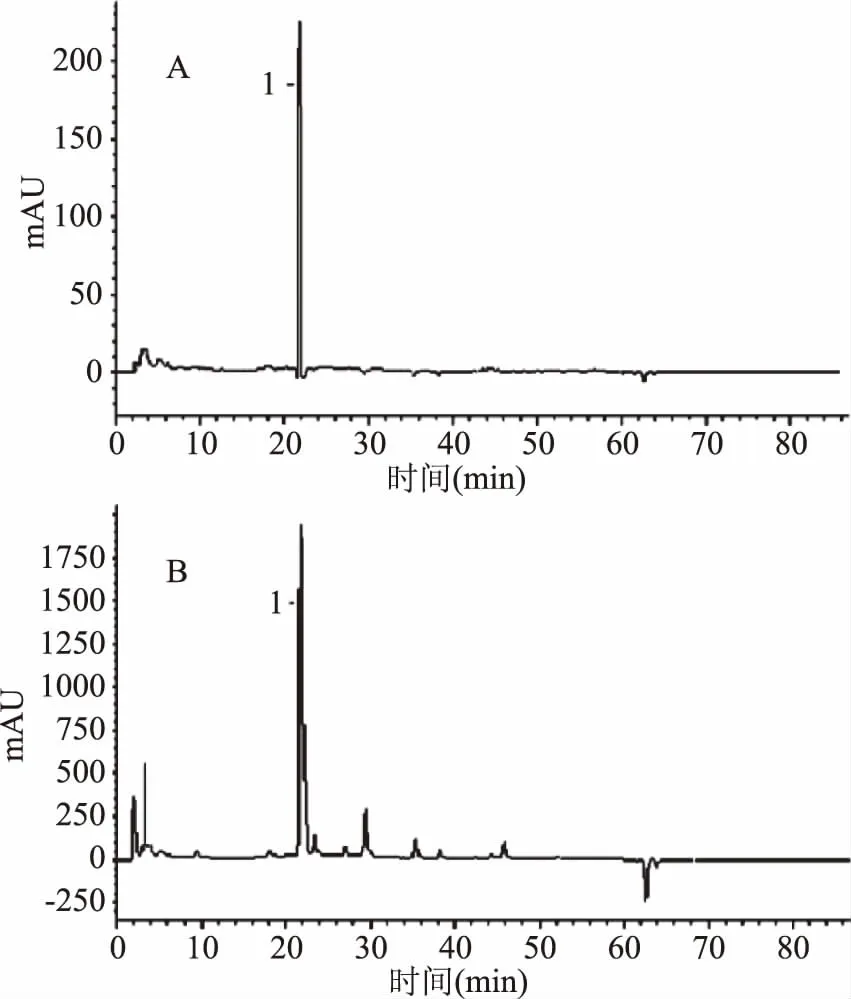
图9 高效液相色谱图Fig.9 HPLC spectra of amentoflavone and the extract from Selaginella doederleinii注:A:穗花杉双黄酮对照品;B:石上柏乙醇提取物;1-穗花杉双黄酮。

表5 不同提取方法提取效果的影响(n=3)Table 5 Effect of different extraction methods on the extraction yield of amentoflavone(n=3)
3 结论
本实验在单因素实验的基础上,采用响应面法对穗花杉双黄酮的提取工艺进行优化,通过Box-Behnken设计实验,建立了石上柏中穗花杉双黄酮提取工艺参数的二次多项式回归模型。方差分析结果表明,该模型准确可靠,可用于石上柏穗花杉双黄酮得率的预测和分析。优化得到的最佳工艺条件为:固液比为1∶15 g/mL,实际调整微波功率400 W,提取时间为37 min,提取温度为47 ℃,穗花杉双黄酮得率预测值为0.34%,实际得率为0.33%±0.08%,与预测值相比较无显著性差异(p>0.05)。对3种提取方法进行比较,表明了微波辅助提取适合石上柏穗花杉双黄酮的提取,在穗花杉双黄酮得率和提取时间均优于索式提取和乙醇回流提取,对贵州赤水石上柏资源的研究开发提供了一定的参考价值。
[1]Wang G,Song H,Yao S,et al. Identification study using
fourier transform infrared spectroscopy for several herbs of the genusSelaginella[J]. WIT Transactions on Biomedicine and Health,2014,18:511-518.
[2]Wang G,Yao S,Zhang X X,et al. Rapid screening and structural characterization of antioxidants from the extract ofSelaginelladoederleiniiHieron. with DPPH-UPLC-Q-TOF/MS method[J]. International Journal of Analytical Chemistry,2015,2015(2):849769.
[3]Dan Li,Yan Qian,Yu-Jia Tian. Optimization of ionic liquid-assisted extraction of biflavonoids from Selaginella doederleinii and evaluation of its antioxidant and antitumor activity[J]. Molecules,2017,22(5):586-602.
[4]戴卫波,梅全喜,曾聪彦. 石上柏化学成分、药理作用及临床应用研究进展[J]. 中国药业,2011,20(2):15-16.
[5]Wang G,Song H,Yao S,et al. Infrared spectroscopic analysis of different extracts fromSelaginelladoederleinii[J]. WIT Transactions on Biomedicine and Health,2014,18:503-510.
[6]Wang G,Yao S,Cheng L,et al. Antioxidant and anticancer effection of the volatile oil from various habitats ofSelaginelladoederleiniiHieron. [J]. Technology & Health Care Official Journal of the European Society for Engineering & Medicine,2015,23 Suppl 1(s1):S21.
[7]黎丹,李三华,杨龙江,等. 基于组效关系的石上柏挥发油抗肿瘤有效成分的辨识[J]. 中国实验方剂学杂志,2018,24(2):44-50.
[8]Wang G,Song H,Yao S. Optimization of the microwave-assisted extraction,GC-MS analysis and antimicrobial activity of the volatile oil constituents fromSelaginelladoederleiniiHieron. [J]. Journal of Investigative Medicine,2013,61(4):13-16.
[9]Wang G,Song H,Yao S. Analysis of volatile oil inSelaginelladoederleiniiHieron. from various habitats by GC-MS[J]. Advanced Materials Research,2013,641-642:862-866.
[10]张建华,杨帆,申健,等. 高效液相色谱法快速测定卷柏药材中穗花杉双黄酮含[J]. 中南药学,2009,7(7):487-489.
[11]Wang G,Li SH,Zhou HL. Comparison of antioxidant and anticancer of the extracts from various habitats ofSelaginelladoederleinii[J]. Adavances in Engineering Research,2016,84:785-790.
[12]Banerjee T,Van der Vilet A,Ziboh VA,et al. Down regulation of COX-2 and iNOS by amentofl avone and quercetin in A549 human lung adenocarcinoma cell line[J]. Prostaglandins Leuk Essen Fatty Acids,2002,66(5-6):485-492.
[13]Dell’Agli M,Galli GV,Bosisio E. Inhibition of cGMPphosphodiesterase-5 by bifl avones of ginkgo biloba[J]. Plant Med,2006,72(5):468-470.
[14]李三华,黎丹,蒋永梅,等. 不同产地石上柏抗氧化和抗肿瘤活性比较[J]. 中国民族民间医药,2017,26(22):11-14.
[15]于定荣,顾雪竹,张村. 白芍中芍药苷提取工艺的对比研究[J]. 中国实验方剂学杂志,2013,19(15):49-51.
[16]王刚,郭延磊,周欣. 大孔吸附树脂法纯化金花葵花总黄酮的研究[J]. 食品工业科技,2013,34(11):235-237.
