鹰嘴豆纳豆液态发酵高产蛋白酶的培养基及发酵条件优化
2018-04-25卓晓沁赵慧莹何国庆
卓晓沁,赵慧莹,何国庆
(浙江大学生物系统工程与食品科学学院,浙江杭州 310058)
纳豆作为特色发酵豆制品,因其独特的滋气味深受消费者喜爱。纳豆产品的保健功效不断受到关注,如它的抗肿瘤、抗氧化[1]和降血压等保健功能[2];纳豆对心脑血管疾病有潜在的防治作用[3],Ji等[4]探讨了纳豆激酶对脑缺血的作用机制。
鹰嘴豆(Chickpea)起源于中东和亚洲西部地区,是世界第二大消费豆类[5]。鹰嘴豆富含不饱和脂肪酸、蛋白质、氨基酸和粗纤维等营养素,以及核黄素、烟酸、硫胺素、叶酸等重要维生素[6-8],其发酵产物中的11S蛋白质可以降血脂[9],正钒酸钠孵育的富钒鹰嘴豆芽可降血糖、改善脂质代谢[10]并调节胆固醇[11],鹰嘴豆白蛋白水解物可以使超氧化物歧化酶活性显著升高,并有降低肿瘤体积、抑制肿瘤[12]等功能。鹰嘴豆作为食药功能兼备的食品,在发酵工艺中应用范围十分广泛。除了鹰嘴豆乳制品的发酵[13],更多则是应用在纳豆发酵中。根据底物形态不同,纳豆发酵分为固态发酵和液态发酵。固态发酵中,卫拯友等[14]将鹰嘴豆代替黄豆,分离出优良的发酵用菌,采用传统纳豆生产工艺研制出口感更好的纳豆,降低拉丝和氨味,其纳豆激酶活力为727 U/g,比大豆纳豆提高142%左右。赵倩楠[15]以生物量和纳豆激酶活性为指标,通过正交实验直观分析得出:鹰嘴豆浸泡时间20 h、接种量1.5%、固态发酵16 h,纳豆激酶酶活为21.6×102IU/g。液态发酵中,肖萍等[16]采用筛选分离所得的菌株确定了最优培养基成分:蔗糖50.0 g/L,鹰嘴豆34.85 g/L,氯化钙0.42 g/L,硫酸镁0.35 g/L,磷酸氢二钾5.00 g/L,磷酸二氢钾6.00 g/L,优化后溶纤酶活力为3210 U/mL,比出发培养基提高了2.10倍。
目前日本在纳豆相关产品的研究方面在世界上处于领先水平,而我国纳豆发酵技术的掌握程度参差不齐。受发酵菌种的生长、制作工艺及产品保存特殊性的约束,纳豆产品的工业化生产在我国未得到普遍推广,关于纳豆的多样化研究在整体水平上有待提高。此外,如何提高纳豆产品中的蛋白酶活力也是亟待解决的关键技术之一。
基于此,本研究以鹰嘴豆为主要发酵原料,以蛋白酶活力为指标对鹰嘴豆纳豆的发酵效果进行考察,优化液态纳豆发酵培养基的营养成分和发酵条件,以期提高纳豆激酶和蛋白酶活力。
1 材料与方法
1.1 材料与仪器
鹰嘴豆 市售;枯草纳豆芽孢杆菌(Bacillussubtilisnatto)SG菌株 由浙江大学浙江省食品微生物重点实验室保藏;鹰嘴豆、黄豆粕 食品级,市售;纤维蛋白原、凝血酶(1000 U) 北京索莱宝科技有限公司;琼脂糖 西班牙BIOWEST公司;蛋白胨 生工生物工程(上海)股份有限公司;氯化钠、葡萄糖、牛肉膏 国药集团化学试剂有限公司。
PK-S28电热恒温水浴锅 上海精宏实验设备有限公司;756PC型紫外可见分光光度计 上海光谱仪器有限公司;BSA124S电子天平 赛多利斯科学仪器(北京)有限公司;R134A冷冻离心机 德国Eppendorf公司;ZHWY-2102恒温摇床 上海智城分析仪器制造有限公司;CTHI-250B恒温恒湿培养箱 施都凯仪器设备(上海)有限公司;SJB-CJ-1FX超净工作台 苏州佳宝净化工程设备有限公司;UPR纯水仪 西安优普(Ulupure)仪器设备有限公司;600Y多功能粉碎机 铂欧五金厂。
1.2 实验方法
1.2.1 鹰嘴豆粉、豆粕粉的制备 将鹰嘴豆和豆粕用制粉机分别打磨,100目过筛备用。
1.2.2 培养基 斜面培养基:牛肉膏6 g、蛋白胨10 g、氯化钠5 g、琼脂20 g,加水至1000 mL,pH7.5;种子培养基:牛肉膏10 g、蛋白胨10 g、氯化钠5 g,加水至1000 mL,pH7.5;发酵培养基:鹰嘴豆粉、豆粕粉及其它材料按需添加,加水至1000 mL,自然pH。发酵培养基的对照组为鹰嘴豆粉45 g,加水至1000 mL,自然pH。以上培养基均121 ℃、20 min灭菌后使用。
1.2.3 种子培养 将4 ℃保藏的枯草芽孢杆菌种经斜面培养基于37 ℃活化培养18~24 h,取一环菌种接入种子培养基中,以生长温度37 ℃,转速200 r/min的条件培养18 h。
1.2.4 发酵培养 根据发酵培养基的装液量,将一定比例的种子培养基接种至其中,在一定温度、转速等条件下摇床发酵,测定蛋白酶活力。对照组装液量100 mL/500 mL,发酵温度37 ℃,转速200 r/min。
1.2.5 酶活检测
1.2.5.1 蛋白酶活力 Folin酚法[17]。
1.2.5.2 纳豆激酶酶活 纳豆激酶是一种可分泌至胞外且具有高效溶栓能力的丝氨酸蛋白酶,1987年首次被日本Sumi H人发现并命名[18]。在Astrup法[19-21]的基础上对纤维蛋白平板的制备进行改进。将纤维蛋白源和凝血酶分别溶于pH=4磷酸盐缓冲液中,制成0.89 mg/mL可凝结纤维蛋白溶液和7.5 U/mL的凝血酶溶液;取可凝结纤维蛋白溶液15 mL、凝血酶1 mL及琼脂糖(0.5%)20 mL于50 ℃水浴加热15 min,充分混合后倒入直径为9 cm平板中冷却备用。纤维蛋白平板法的检测结果受孵育时间、平板厚度、测量误差等因素的影响,因此纳豆激酶酶活仅可作为辅助指标,用以检测优化结果的准确性[22]。
1.2.6 发酵条件优化
1.2.6.1 单因素实验 速效碳、氮源:该部分只考虑单一因素对发酵产蛋白酶活力的影响。主要原料鹰嘴豆粉中速效碳源含量低,拟添加速效碳源以促进菌体早期繁殖,并添加氮源以完善营养。分别采用单因素实验比较碳、氮源对产蛋白酶的影响,其中麦芽糖、淀粉、蔗糖、葡萄糖等碳源添加量为0.6%,豆粕粉、蛋白胨、鱼蛋白胨、黄豆粉等氮源添加量为1%。接种量:为考察种子液接入量对纳豆枯草芽孢杆菌产蛋白酶活力的影响,在发酵培养基中接入种子液的体积分数分别为2%、3%、5%和8%。盐离子:为考察盐离子对蛋白酶活力的影响,在培养基中分别加入氯化钙、硫酸镁、磷酸氢二钾和磷酸二氢钾四种不同的盐离子,添加量为0.01%。
1.2.6.2 Plackett-Burman法筛选影响产蛋白酶的重要因素 影响纳豆芽孢杆菌发酵鹰嘴豆产生蛋白酶的因素有碳源、氮源、接种量、装液量、摇瓶转速、氯化钙、葡萄糖、氯化钠等,因为因子数众多,且未确定各因子对因变量的影响程度,故采用Plackett-Burman法,以蛋白酶活力为指标筛选显著影响发酵的因素,因素水品设计见表1。PB实验设计中另设3个虚拟列C、F和I,以考察实验误差。

表1 Plackett-Burman因素及水平设计Table 1 Factors and level design of Plackett-Burman
1.2.6.3 最陡爬坡实验 为使响应面实验在临近最佳数值时建立有效的响应面方程[23],爬坡实验把变量的变化趋势作为爬坡方向,依据各自变量的数值大小确定步长,方可快速有效地接近最高点。实验设计见表2。
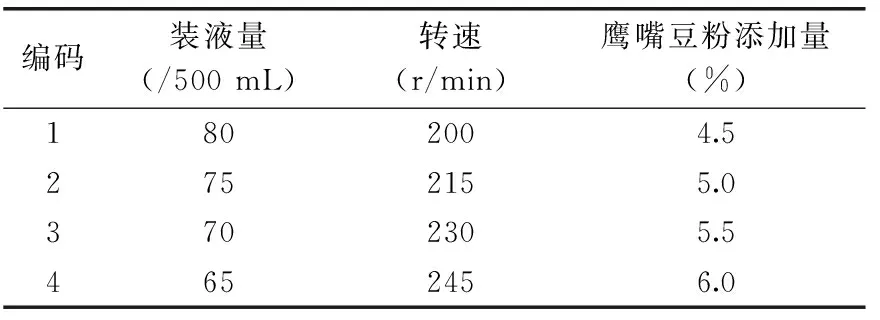
表2 最陡爬坡实验设计Table 2 Experimental design of steepest climbing method
1.2.6.4 Box-Behnken实验与响应面优化 根据Plackett-Burman和最陡爬坡实验的结果,设计Box-Behnken实验的因素与水平(见表3),以蛋白酶活力为指标,辅以纳豆激酶检测值为验证,筛选出对液态鹰嘴豆纳豆发酵影响效果最显著的3个因素,设计3因素3水平的中心组合实验设计[24],并与响应面优化相结合,进一步考察这三个因素不同水平下不同组合对鹰嘴豆纳豆产蛋白酶能力的影响。

表3 响应面分析方法因素与水平设计Table 3 The factors and levels of response surface analysis
1.3 数据处理
实验中每组数据重复3次,用SAS、SPSS 17.0及Excel处理数据并作图。
2 结果与分析
2.1 单因素实验
结果见图1所示。不同碳源对纳豆枯草芽孢杆菌产蛋白酶活力的影响见图1(a)。添加蔗糖和淀粉不利于纳豆枯草芽孢杆菌产蛋白酶,甚至有抑制作用;但麦芽糖和葡萄糖可有效促进纳豆菌产蛋白酶,分别比对照组提高15%和23%,这与Gul等[25]的结果一致,即微生物最易利用单糖。据此,选用葡萄糖作为速效碳源。
不同氮源对纳豆枯草芽孢杆菌产蛋白酶活力的影响见图1(b)。添加蛋白胨和鱼蛋白胨后的酶活低于对照组;添加黄豆粉后,酶活并无明显提高;添加豆粕粉后,蛋白酶活力提高38.5%。据此,选用豆粕粉作为外加氮源。
由图1(c)可知,当种子液接入量为2%时蛋白酶活力最高,接种量为3%和5%时蛋白酶活力有所下降,而8%时虽有升高,但仍不及2%组。其原因可能是当接入量过低时,菌体生长较慢,过高则加速消耗发酵底物。因此以2%的接种量进行后续实验。
如图1(d)所示,添加氯化钙和硫酸镁的酶活分别为832和815 U/mL,均高于对照组;添加磷酸氢二钾和磷酸二氢钾的蛋白酶活力分别为784 U/mL和682 U/mL低于对照组。因此选择添加氯化钙进行后续实验。
2.2 基于Plackett-Burman法的培养基与发酵条件筛选结果
PB实验设计与结果见表4,各参数及水平见表5。

表4 n=12的Plackett-Burman实验设计与结果Table 4 The experimental design and results of n=12 Plackett-Burman

表5 Plackett-Burman实验因素、水平及其效应Table 5 Factors,levels and effects of Plackett-Burman
表5结果显示,该PB模型极显著(p<0.0001)。A(装液量)与Y(蛋白酶活力)呈负相关,这是由于纳豆芽孢杆菌为好氧细菌,减少装液量可增大空气接触面,提高溶氧量。同理,B(转速)与蛋白酶活力呈正相关。D(鹰嘴豆粉添加量)作为主要碳氮源,为菌体生长繁殖提供营养,且与Y呈显著正相关;E(豆粕粉)对Y有较小的影响,可能因为鹰嘴豆本身富含蛋白质,但豆粕粉中大豆蛋白的小分子物质起到前期诱导的作用[26]。此外,J(葡萄糖)、K(氯化钠)对结果无显著影响,为避免其效应是在影响更大因素的存在下被忽略,因此二者的添加量保持不变;H(接种量)对结果有负效应,可能由于接种量较大时发酵前期菌体的生长繁殖会消耗大量营养物质,导致酶的合成过程中营养相对不足,但接种量太低会延长微生物繁殖时间,酶活高峰期延后到来,后续实验仍保持2%的种子液接入量,该结果与Li等[27]的研究相同。由文献知,豆粕粉、葡萄糖作为速效碳氮源,可缩短微生物的延滞期[28-29]。G(氯化钙)在PB实验中为负效应,本实验以食品工业生产为方向,本着健康天然、减少添加的原则,后续实验不添加氯化钙。因此本实验其余因素分别采取豆粕粉1.0%、葡萄糖0.6%、氯化钠0.5%、接种量2%。
2.3 最陡爬坡实验
Plackett-Burman结果表明,对鹰嘴豆纳豆液体发酵影响最大的3个因素分别是装液量、转速和鹰嘴豆粉添加量。最陡爬坡实验结果见表6。以逼近最大酶活区域的3号条件作为下一步实验基准,即装液量70 mL/500 mL、转速230 r/min、鹰嘴豆粉含量5.5%。

表6 最陡爬坡实验结果Table 6 The results of steepest climbing method
2.4 Box-Behnken实验与响应面优化
在最陡爬坡实验结果的基础上,采取三因素三水平分析方式,并对装液量Z1、转速Z2、鹰嘴豆粉添加量Z3做如下变换:X1=(Z1-70)/10,X2=(Z2-230)/20,X3=(Z3-5.5)/1,以X1、X2、X3为自变量,以蛋白酶活力为响应值Y,实验方案及结果见表7。
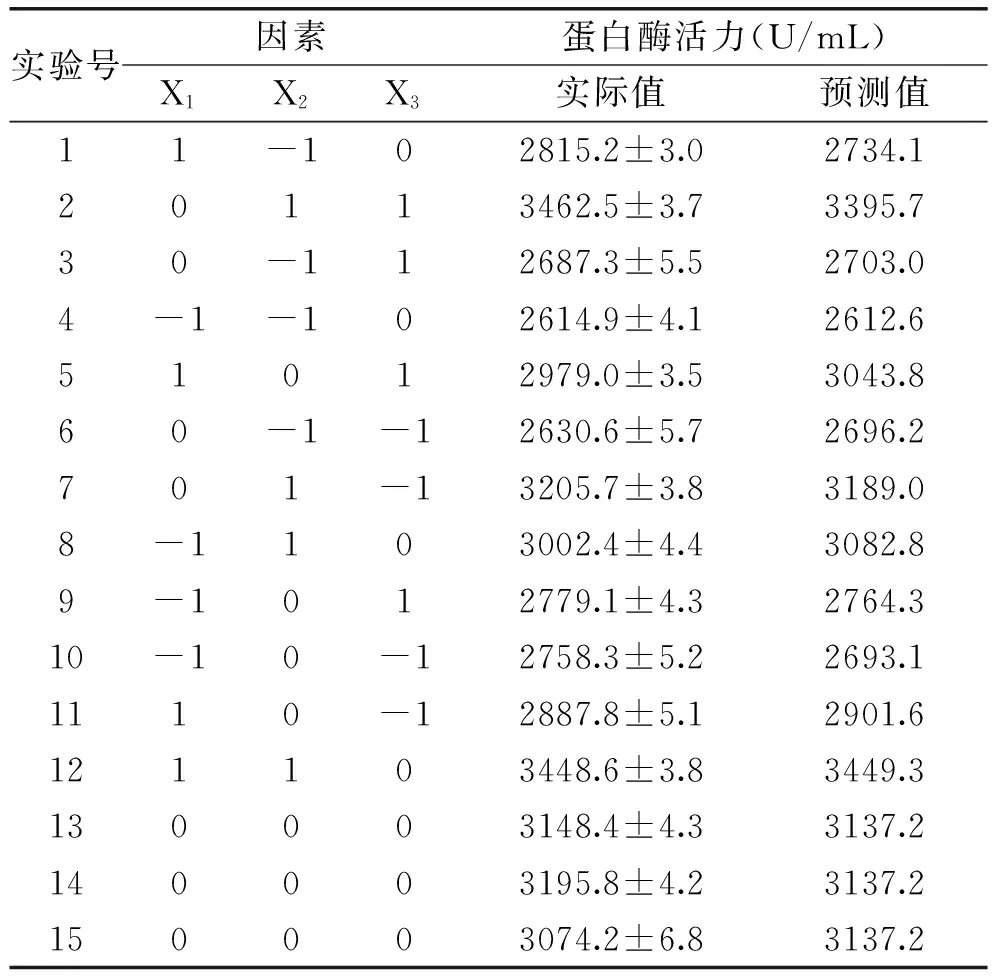
表7 响应面分析实验方案及结果Table 7 Experimental program and results
通过Minitab 17对结果进行方差分析,并得到二次多项回归拟合实验数据:
Y=3137.20+122X1+296.38X2+53.38Z3+61.25X1X2+17.75X1X3+50X2X3-156.35X12-11.10X22-130.1X32。
由表8知,所选模型之间处理方式有显著差异(p<0.05)。在线性影响效应中X1(装液量)和X2(转速)的p<0.05,说明装液量与转速对蛋白酶活的效应显著,而X3(鹰嘴豆粉添加量)的效应不显著。ATP等高能化合物为细胞生长与酶合成提供能量[30],充足的氧气才能降解碳氮源以产生ATP,确保溶氧量是基础。延滞期在速效碳氮源的作用下缩短之后,细胞开始分解利用非速效碳氮源。当使用较稀或较易利用的培养基时,细胞的生长往往使营养物质过早耗尽,导致微生物细胞过早自溶,使发酵产物的产量降低[31]。鹰嘴豆粉可维持培养基的浓度,不至于被过快分解。二次项系数A2影响极显著(p<0.01),C2影响显著(p<0.05),说明装液量与鹰嘴豆粉添加量对蛋白酶活有重要影响,导致曲面效应显著,具体实验因子对响应值变化的影响较复杂。交互项的交互效应p值均大于0.05,说明两两交互效应不显著。失拟项不显著p=0.2014,模型显著,拟合度良好。回归方程的响应面图见图2。每张图都是两个交互因素的响应面,每个响应面都存在最高点。250 r/min已达到本实验室摇床的最高水平,故设定250 r/min为最高转速。
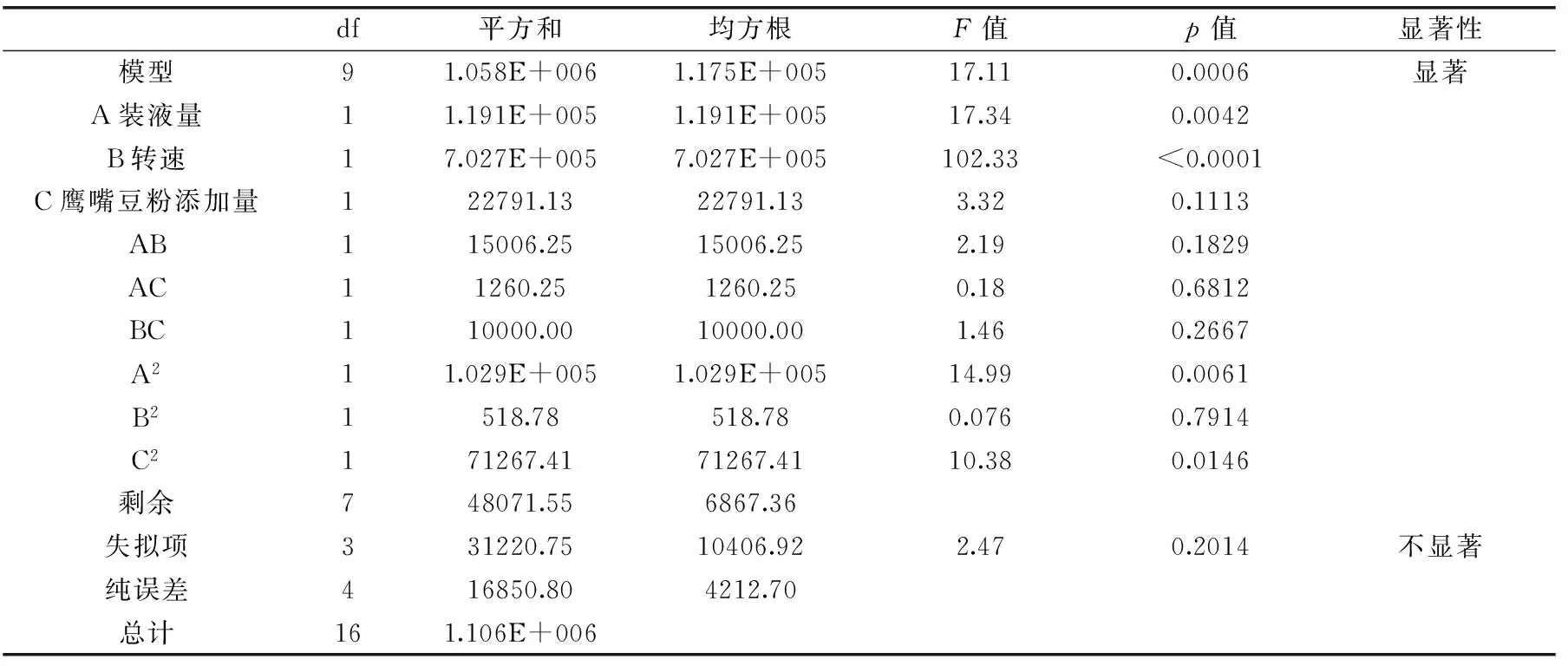
表8 Box-Behnken实验方差分析Table 8 Variance analysis of Box-Behnken
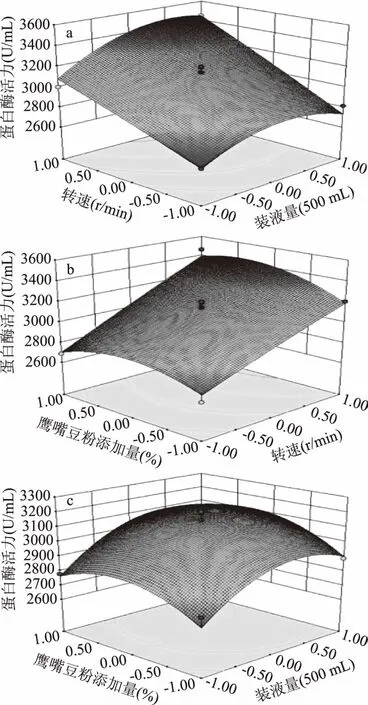
图2 鹰嘴豆纳豆液态发酵条件的响应面图Fig.2 Response surface of submerged fermentation condition of chickpea natto
由图2(a)可知,蛋白酶活随转速的提高在250 r/min达到最高;装液量对蛋白酶活力的影响呈现先升高后降低的趋势,低装液量60/500 mL易增加发酵液的蒸发,培养基底物较快消耗完毕,菌体进入稳定和自溶,而80/500 mL则溶氧降低、菌体生长密度和液体剪切力等均受影响,因此二者的响应值明显低于70/500 mL。由图2(b)可知,鹰嘴豆粉添加量为4.5%和6.5%时蛋白酶活力较低,而添加量为5.5%时较高,蛋白酶活力先上升后下降。鹰嘴豆粉含量决定发酵液的浓稠程度,太浓或太稀均不利于菌体生长。溶氧率更多取决于转速,因此蛋白酶活力随转速的提高而明显上升。由图2(c)可知,在装液量和鹰嘴豆粉添加量的交互作用下,装液量和鹰嘴豆粉添加量对蛋白酶活力影响的趋势相同,为先增后减,二者的交互作用明显,并存在最高点。
SAS分析获得最高酶活的发酵方案是装液量76 mL/500 mL、转速250 r/min、鹰嘴豆粉添加量5.9%,其他条件和添加量保持不变,此条件下预测的酶活是3501.1 U/mL。该模型的验证结果是(3558.0±1.5) U/mL,误差=1.6%±0.053%<2.0%,故该模型稳定,优化后的回归方程适合用于纳豆枯草芽孢杆菌发酵鹰嘴豆产蛋白酶活力的分析和预测。
2.5 纳豆激酶的辅助验证
随机取多组离心处理的发酵液于纤维蛋白平板上孵育18 h之后测量溶解圈直径。相同条件下溶解圈直径越大,纳豆激酶活力越强。纤维蛋白平板法辅助验证Folin酚法的结果见图3,纳豆芽孢杆菌产蛋白酶活力与其纳豆激酶活力趋势基本相同,由分析可知,二者有78.1%的相关性(p=0.001),纤维蛋白平板法的验证结果较可靠。对照培养基与优化培养基的纳豆激酶溶解圈对比如图4所示,其中对照培养基的纳豆激酶溶解圈直径为36.0 mm,优化培养基的纳豆激酶溶解圈直径为52.0 mm,后者的面积是前者的2.08倍,说明培养基和发酵条件优化后纳豆激酶活力有所提高。因此在两种方法检测下,液态发酵的优化效果更具有说服力。
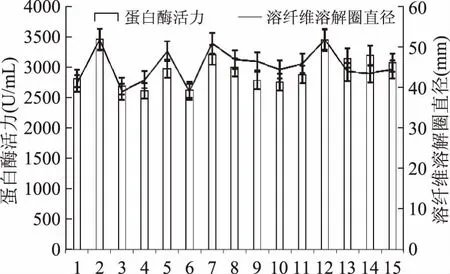
图3 纤维蛋白平板法辅助验证Folin酚法的参照Fig.3 The reference of Folin Phenol method by fibrin plate method

图4 对照培养基与优化培养基的纳豆激酶溶解圈对比Fig.4 Comparison of dissolved circle between control medium and optimized medium注:A为对照培养基的纳豆激酶溶解圈,B为优化培养基纳豆激酶溶解圈,ΦA=36 mm,ΦB=52 mm。
3 结论
在大量预实验的基础上筛选速效碳氮源,优化了鹰嘴豆纳豆液态发酵工艺。由单因素实验得到:添加氮源为葡萄糖,添加氮源为豆粕。在Plackett-Burman实验基础上得到,装液量、转速和鹰嘴豆粉添加量的影响最为显著。
经优化得到鹰嘴豆纳豆液态发酵的最佳培养基为:鹰嘴豆粉添加量5.9%,豆粕粉1.0%,葡萄糖0.6%,氯化钠0.5%;培养条件:装液量76 mL/500 mL、温度37 ℃,转速250 r/min,得到的蛋白酶活力为(3558.0±1.5) U/mL。相较于空白对照组,蛋白酶活力提高42.8%,通过纤维蛋白平板法的验证,纳豆激酶溶解圈面积提高了108.6%。该优化培养基提高豆粕的利用率,拓宽豆粕的利用范围和鹰嘴豆发酵纳豆的新思路,不仅培养基的营养更全面,也为后续提纯纳豆激酶的可能性、功能性纳豆食品的研发及发酵罐的放大生产打下科学基础。
[1]柯学,杨文文,林丹丹. 一种抗氧化的中药组合物、制备方法及用途:中国,CN103908532A[P]. 2014.
[2]谢秋玲,郭勇. 纳豆——一种多功能食品[J]. 食品工业科技,1999(1):71-72.
[3]王婷,温子健,季晓彤,等. 海参卵纳豆菌发酵条件及产物生物活性[J]. 食品科学,2017,38(8):43-48.
[4]Ji H,Wang L,Bi H,et al. Mechanisms of lumbrokinase in protection of cerebral ischemia.[J]. European Journal of Pharmacology,2008,590(3):281-289.
[5]马连升. 鹰嘴豆的栽培[J]. 中国农业信息,2016(12):93-94.
[6]Paredeslopez O,Ordoricafalomir C,Olivaresvazquez M R. Chickpea protein isolates:physicochemical,functional and nutritional characterization[J]. Journal of Food Science,1991,56(3):726-729.
[7]Mongi M. Phenotypic,genetic and biochemical characterization of five tunisian varieties of chickpea[J]. Journal of Agricultural Studies,2017(1):77-89.
[8]Jukanti A K,Gaur P M,Gowda C L,et al. Nutritional quality and health benefits of chickpea(CicerarietinumL.):a review[J].British Journal of Nutrition,2012,108 Suppl 1(S1):S11.
[9]Neves V A,Demonte A,Amaral A L,et al. Legumin from chickpea:hypolipidemic effect in the liver of hypercholesterolemic rats[J]. Nutrition and Food Science,2014,44(5):378-388.
[10]Mao X,Ling Z,Xia Q,et al. Vanadium-enriched chickpea sprout ameliorated hyperglycemia and impaired memory in streptozotocin-induced diabetes rats[J]. Biometals,2008,21(5):563.
[11]Gu Y,Yue X,Yang Y. Chickpea extracts as therapeutic agents and foods in the treatment and prevention of obesity and non-insulin-depenent diabetes:US,US 20080138453 A1[P]. 2008.
[12]Xue Z,Gao J,Zhang Z,et al. Antihyperlipidemic and antitumor effects of chickpea albumin hydrolysate[J]. Plant Foods for Human Nutrition,2012,67(4):393-400.
[13]傅樱花. 鹰嘴豆酸奶的发酵工艺优化[J]. 食品工业,2012(2):58-60.
[14]卫拯友,吴富强,訾静. 鹰嘴豆发酵生产纳豆初探[J]. 陕西农业科学,2009,55(6):64-66.
[15]赵倩楠. 四种豆子纳豆发酵工艺条件的研究及产品开发[D]. 西安:陕西科技大学,2014.
[16]肖萍,姚四平,康然,等. 高产纤溶酶菌株筛选及发酵鹰嘴豆培养基优化[J]. 食品科技,2014(10):32-38.
[17]国家标准管理委员会. GB/T 23527-2009蛋白酶制剂[S]. 中国标准出版社,2009.
[18]Sumi H,Hamada H,Tsushima H,et al. A novel fibrinolytic enzyme(nattokinase)in the vegetable cheese Natto;a typical and popular soybean food in the Japanese diet[J]. Experientia,1987,43(10):1110-1111.
[19]Astrup T,Mullertz S. The fibrin plate method for estimating fibrinolytic activity[J]. Archives of Biochemistry and Biophysics,1952,40(2):346-351.
[20]Walton P L. An improved fibrin plate method for the assay of plasminogen activators[J]. Clinica Chimica Acta,1966,13(5):680-684.
[21]Deogny L,Weidenbach A,Hampton J W. Improved fibrin plate method for fibrinolytic activity measurements:Use of bentonite precipitation and agar solidification[J]. Clinica Chimica Acta,1975,60(1):85.
[22]宋文超. 高产纳豆激酶菌株筛选和纳豆激酶分离纯化及药效学研究[D].武汉:华中农业大学,2013.
[23]胡升,梅乐和,姚善泾. 响应面法优化纳豆激酶液体发酵[J]. 食品与发酵工业,2003,29(1):13-17.
[24]Liu J,Xing J,Chang T,et al. Optimization of nutritional conditions for nattokinase production byBacillusnatto,NLSSE using statistical experimental methods[J]. Process Biochemistry,2005,40(8):2757-2762.
[25]Gul S,Rahman M U,Ajmal M,et al. Effects of carbon and nitrogen sources on production of proteases byBacillussubtilisIC-5[J]. Bangladesh Journal of Botany,2015,44(2):285-292.
[26]谢秋玲,郭勇,林剑,等. 纳豆激酶的合成机制[J]. 暨南大学学报(自然科学与医学版),2001,22(3):110-114.
[27]Li P,Lin W,Liu X,et al. Effect of bioaugmented inoculation on microbiota dynamics during solid-state fermentation of Daqu starter using autochthonous ofBacillus,Pediococcus,WickerhamomycesandSaccharomycopsis[J]. Food Microbiology,2017,61:83-92.
[28]吴艳,顾阳,任聪,等. 微生物分解代谢物控制蛋白CcpA的研究进展[J].生命科学,2011(9):882-890.
[29]车晓曦,李社增,李校堃. 1株解淀粉芽孢杆菌发酵培养基的设计及发酵条件的优化[J]. 安徽农业科学,2010,38(18):9402-9405.
[30]何国庆,贾英民,丁立孝. 食品微生物学[M]. 北京:中国农业大学出版社,2010.
[31]何国庆. 食品发酵与酿造工艺学[M]. 北京:中国农业出版社,2001.
