有机肥氮投入比例对土壤微生物碳源利用特征的影响
2018-04-25何翠翠李贵春尹昌斌
何翠翠,李贵春,尹昌斌*,张 洋
(1 中国农业科学院农业资源与农业区划研究所,北京 100081;2 中国农业科学院农业环境与可持续发展研究所,北京 100081)
土壤为微生物提供了生存的自然环境,微生物以其所具有的各种生物化学活性参与土壤物质转化过程中[1]。微生物是土壤中发生各种生化反应的驱动力,是土壤各种生物化学和生理过程的动态平衡的调节者,在农业生态系统中承担着重要的角色[2]。土壤微生物直接或者间接地受到土壤环境的影响,其中施肥是一个影响微生物的重要因子[3–4]。施肥可以改变土壤中微生物群落多样性和微生物活性。施用无机肥料对微生物的影响还存在一定的争议,有学者认为,无机肥料氮素的施入限制土壤微生物生长,减少土壤细菌种类,改变土壤微生物的优势种群,降低土壤微生物多样性[5–6]。另有学者认为,化肥氮素的施入对土壤细菌群落结构影响不大[7]。也有学者认为,无机肥料氮磷钾配施显著增强了土壤微生物对碳源利用的能力,提高微生物活性[8–9]。同时,研究学者一致认为有机无机肥料配施对土壤微生物群落结构、代谢活性有正作用[4–7,10],但有机肥料与无机肥料的最佳比例尚未明确。
关于土壤微生物代谢活性的研究,研究学者指出微生物代谢某种单一物质的活性并不能代表土壤肥力状况[4],微生物对多种与土壤肥力相关的、分布广泛的物质代谢活性,共同影响、表征着土壤肥力水平[5,11–12]。Biolog ECO板能够准确地测定出土壤微生物代谢活性的强弱,主要是根据微生物对31种碳源利用能力来判定的,而微生物对碳源利用的能力强弱可以依据AWCD值来进行判定[17–18]。而Biolog ECO板中的31种碳源均为生态环境中常见的碳源,如,氨基酸是土壤有机氮的重要组成部分,羧酸则是植物根系分泌物的重要组分,D-木糖存在于玉米芯中,是构成半纤维素的重要成分之一[14],Biolog ECO板方法能够反映不同施肥处理下土壤微生物的特性[19],因此,本研究选择用Biolog ECO板根据微生物对31种碳源利用的情况来表征土壤微生物多样性以及活性。
冬小麦–夏玉米轮作体系中,秋施基肥是有机肥施入的最佳时期,因此,本研究重点针对秋施基肥时进行有机肥替代无机肥试验,探讨有机无机肥料氮素比例对土壤微生物碳源利用特征的影响,旨在揭示土壤微生物多样性和活性对不同有机无机肥料氮素配比的响应规律。
1 材料与方法
1.1 试验地概况
试验地位于我国的粮食主产区华北平原,河北省徐水县,公益性行业 (农业部) 科研专项试验站(37.8°N,114.7°E)。该试验地所属区域的气候类型为暖温带半湿润半干旱季风气候,年平均气温12.2℃,年平均降水量536.8 mm。试验地耕层土壤容重1.27 g/cm3,pH值7.80,有机碳含量17.1 g/kg,全氮含量1.01 g/kg,全磷含量0.83 g/kg,全钾含量18.11 g/kg。土壤类型为石灰性潮褐土,试验地种植类型为冬小麦–夏玉米轮作。
1.2 试验设计与样品采集
试验小区面积为20 m2(5 m × 4 m),试验小区之间用40 cm的PVC板隔开 (地上20 cm,地下20 cm)。试验共设5个处理:1) 不施肥对照处理(CK);2) 施用无机化肥处理 (M0),基肥时期采用复合肥 (N∶P∶K为22∶8∶10);3) 有机肥替代20%基肥无机肥氮素处理 (M20);4) 有机肥替代50%基肥无机肥氮素处理(M50);5) 有机肥替代100%基肥无机肥氮素处理 (M100)。追肥采用尿素。3个重复,共计15个小区,试验小区的排列方式为随机区组。除对照不施任何肥料外,所用处理冬小麦和夏玉米均施N 200 kg/hm2,且冬小麦、夏玉米秸秆均不还田。试验开始于2010年6月,土壤样品采集时间为2015年6月,即冬小麦收获后。采用五点取样法,原状土壤采集 (20 cm × 20 cm × 10 cm),混匀,筛分,放置–20℃冰箱冷冻,以供微生物多样性和微生物活性测定。冬小麦每年10月1日施基肥,翌年3月12日追肥。夏玉米每年6月15日施基肥,8月1日追肥。具体施肥量见表1。
1.3 土壤微生物多样性与活性的测定与分析
采用Biolog-ECO板对土壤微生物多样性和活性进行测定。Biolog ECO板8行 × 12列,共96孔,每4列为一个重复。其中,第一个微孔为对照孔,其余31个微孔每孔均含有一种不同的有机碳源和相同含量的四唑紫染料,可以得出土壤微生物对31种碳源的利用特征[13–14]。结合有机化合物化学官能团微生物生理代谢途径和生态功能3个方面将ECO板的31种碳源底物分为6大类[15]:12种糖类及其衍生物,6种氨基酸,5种羧酸,4种多聚物,2种酚酸类和2种胺类。
Biolog-ECO板测定过程,包括浸提、接种、培养和读数[16]。首先,称取相当于5 g干土的新鲜土样于无菌锥形瓶中,加入45 mL无菌NaCl溶液(0.85%,质量比),封口后,在摇床上震荡15 min(200 r/min),静置15 min取上清液。然后,在超净工作台上,采用逐步稀释的方法,用无菌NaCl溶液(0.85%, 质量比) 将上清液稀释100倍。接着用8通道加样器将稀释液接种到Biolog-ECO微平板,每孔接种150 μL。最后,将接种好的培养板置于生化培养箱中25℃培养10 d,在培养前期每隔12 h (后期为24 h) 在590 nm下读取Biolog-ECO板的吸光值。
土壤微生物碳源代谢活性用平均微孔颜色吸光值 (average well color development, AWCD) 来描述,计算公式如下:式中:Ci为第i种碳源的吸光度,C0为对照孔的吸光度,31为碳源的数目。
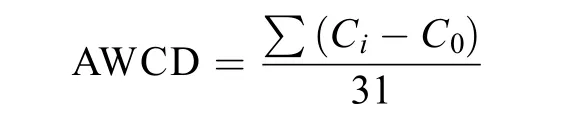
用Shannon-Wiener多样性指数来描述微生物群落代谢多样性,计算公式如下:
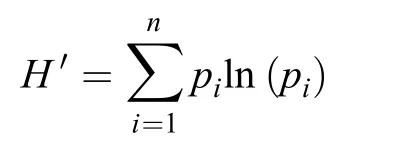
式中:pi为第i孔的相对吸光值与整个微平板的相对吸光值总和的比值。
Shannon-Wiener均匀度指数E,计算公式如下:
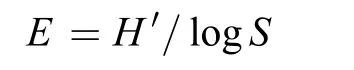
式中:H'为多样性指数,S为利用碳源的个数。
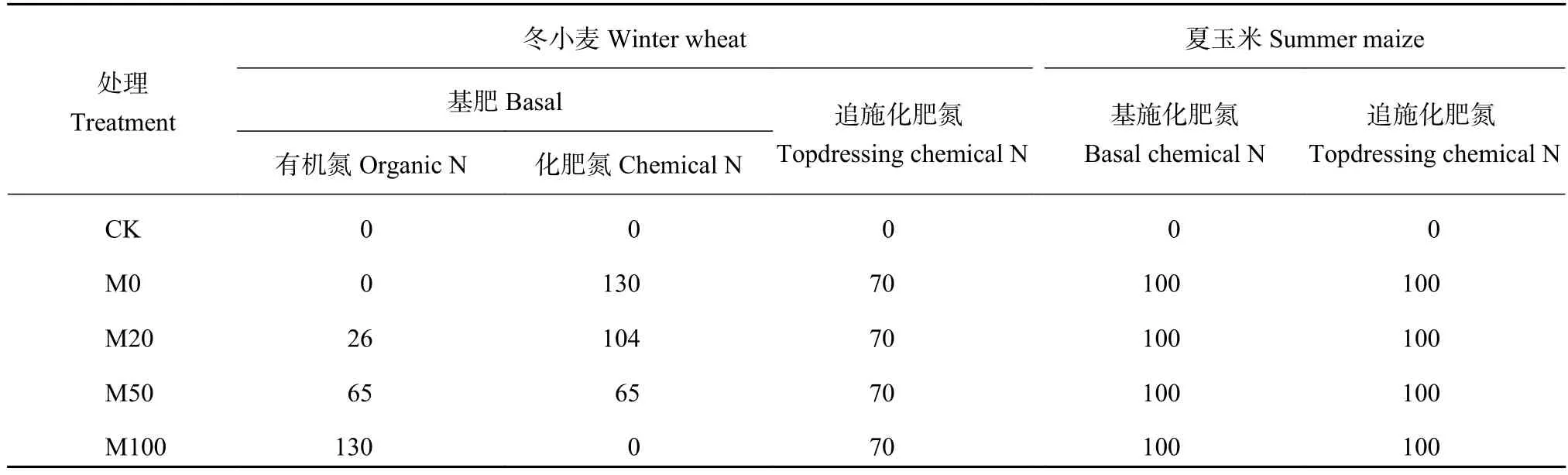
表 1 不同处理中不同来源氮施用量 (kg/hm2)Table 1 N source and input amount in different treatments
丰富度指数 (R) 是指被利用的碳源的总数目,该研究中为每孔中 (Ci-R) 的值大于0.25的孔数.
Simpson 优势度指数 (D):D= 1–∑pi2
1.4 计算方法与数据分析
采用SPSS 18.0软件对数据进行单因素方差分析,采用SigmaPlot、Canoco 4.5进行绘图。
2 结果与分析
2.1 不同施肥处理的土壤微生物碳源代谢整体能力分析
土壤微生物总碳源代谢活性用平均微孔颜色吸光值AWCD表示,所有施肥处理的AWCD值随着培养时间的变化呈现典型的Logistic增长曲线(图1),相关参数见表2,拟合的Logistic增长曲线决定系数均大于0.97。由图1和表2可以看出,M0处理中土壤微生物对碳源利用的潜伏期最长,大于24 h,其他处理的潜伏期较短,在12~24 h之间。指数期增长速率,CK处理的最低为0.0452,然后是M0、M50、M20,在0.0450~0.0500之间,M100最高,为0.0635。M100处理的AWCD值最先达到0.5 K,耗时约56 h,M20和M50处理达到0.5 K耗时分别为61 h、63 h,CK处理为69 h,M0处理最后达到0.5 K,耗时长达77 h。不同施肥处理土壤微生物代谢活性K值,M0最低,为0.3954,CK处理稍高,为0.4143,M20为0.4272,M50和M100最高,大于0.4500。
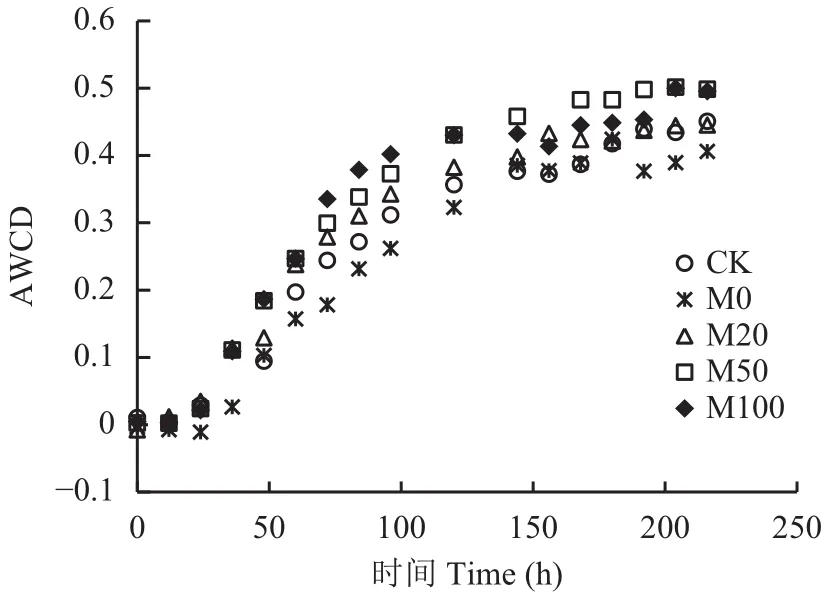
图 1 不同施肥处理中随着时间变化的平均吸光值Fig. 1 Average well color development (AWCD) with incubation time in fertilizer treatments
2.2 不同施肥处理的土壤微生物碳源代谢指纹图谱
Biolog-ECO板在接种土壤样品后,约120 h达到0.8 K,经过将近10天的培养,基本能够保证微生物新陈代谢完全。从Biology-ECO板的代谢指纹

表 2 拟合“S”型增长模型参数Table 2 Kinetic parameters of the fitted logistic growth equations
图谱看 (图2),不同施肥处理的土壤微生物对六类碳源的利用率从高到低依次为:糖类、胺类、氨基酸类、多聚类、羧酸类和酚酸类。不同处理的土壤微生物对糖类的利用程度差异不大。除去糖类之外,M0处理对氨基酸类、羧酸类、多聚类、酚酸类和胺类这五类碳源的利用率都显著低于其他处理。M50和M100两个处理对六类碳源的利用程度均最高。
华北平原地区冬小麦–夏玉米轮作系统中,土壤微生物对G1、H1、D2、C1和G4 (D-纤维二糖、D-乳糖、D-甘露醇、吐温40和苯乙基胺) 这几种碳源的利用程度最高,其中,D2 (D-甘露醇) 是半纤维素的重要单体,在所有施肥处理中土壤微生物对D-甘露醇的利用程度最大,居于31种碳源之首;对H2和E3 (D, L-磷酸甘油和γ-羟基丁酸) 的利用率最低。CK处理土壤微生物基本不利用E1,F1和B2(α-环式糊精、肝糖、D-木糖),施肥处理则可以利用这三种碳源,只是利用能力较弱。其中α-环式糊精具有环状结构,稳定性较强,不容易发生反应,对α-淀粉酶和β-淀粉酶有很大的阻抗性。糖肝在土壤中也不常见,可在细菌和个别植物中找到。相对于以上两种碳源,D-木糖在自然界存在较为丰富,存在于玉米芯中,是构成半纤维素的重要成分之一。
整体上,以AWCD > 0.6碳源计数,CK处理最多有11种 (糖类5种,氨基酸3种,多聚类2种,胺类1种);其次为M100处理,共计10种 (糖类5种,氨基酸2种,多聚类1种,羧酸类1种,胺类1种);M50处理为9种 (糖类5种,氨基酸2种,多聚类1种,胺类1种);M20和M0高于0.6的碳源种类最少,分别为7种 (糖类5种,氨基酸1种,多聚类1种) 和5种 (糖类3种,氨基酸
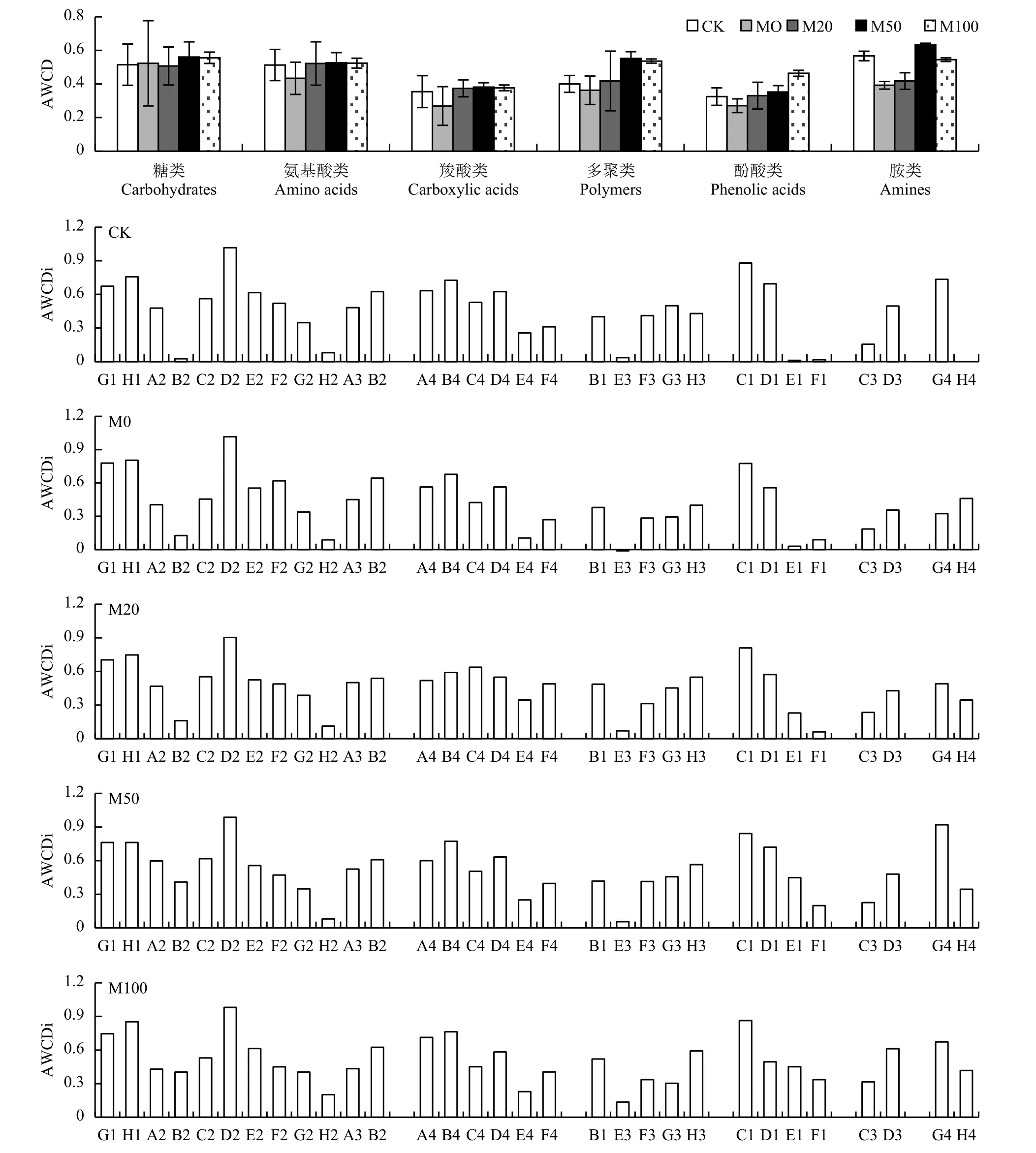
[注(Note):A2—ß-甲基-D-葡萄糖苷ß-methyl-D-glucoside;A3—D-半乳糖内酯 D-galactonic acid-γ-lactone;A4—L-精氨酸 L-arginine;B1—丙酮酸甲脂Pyruvic acid methyl ester;B2—D-木糖D-xylose;B3—D-半乳糖醛酸D-galacturonic acid;B4—L-天冬酰胺酸L-asparagine;C1—吐温 40 Tween 40;C2—I-赤藻糖醇I-erythritol;C3—2-羟苯甲酸 2-hydroxy benzoic acid;C4—L-苯基丙氨酸L-phenylalanine;D1—吐温 80 Tween 80;D2—D-甘露醇 D-mannitol;D3—4-羟基苯甲酸 4-hydroxy benzoic acid;D4—L-丝氨酸 L-serine;E1—α-环式糊精 α-cyclodextrin;E2—N-乙酰基-D-葡萄胺 N-acetyl-D-glucosamine;E3—γ-羟基丁酸 γ-hydroxybutyric acid;E4—L-苏氨酸L-threonine;F1—肝糖Glycogen;F2—D-葡萄糖胺酸D-glucosaminic acid;F3—衣康酸Itaconic acid;F4—甘氨酰-L-谷氨酸Glycyl-L-glutamic acid;G1—D-纤维二糖 D-cellobiose;G2—葡萄糖-1-磷酸盐 Glucose-1-phosphate;G3—α-丁酮酸 α-ketobutyric acid;G4—苯乙基胺 Phenylethyl-amine;H1—α-D-乳糖 α-D-lactose;H2—D, L-α-甘油 D, L-α-glycerol;H3—D-苹果酸 D-malic acid;H4—腐胺 Putrescine.]
1种,多聚类1种)。CK处理总AWCD值不高,但其高于0.6的种类较多,说明不施肥的对照处理可以保持微生物多样性。
2.3 不同施肥处理的土壤微生物碳源代谢主成分分析
采用主成分分析的方法对0.5 K、0.8 K (微生物生长较为关键的点) 进行数据分析。利用培养60 h的AWCD值 (0.5 K),对不同处理下利用不同碳源种类的特性进行主成分分析,由图3可知,碎石图曲线从第二个因子开始变得比较平缓,特征根小于等于1。其中,第一主成分 (PC1) 特征根为4.834,方差贡献率为80.6%,第二主成分 (PC2) 特征根为0.704,方差贡献率为11.7%,第三主成分 (PC3) 特征根为0.378,方差贡献率为6.3%。选取PC 1和PC2分析进行绘图 (图3),不同施肥处理的碳源利用在PC轴上差异显著。CK和M0处理位于PC 1的中端靠右的位置;M20处理位于PC1的最右端;M50和M100位于PC1的左边部分,同时,M50位于PC2的负端,M100位于PC2的正端。其中,糖类、胺类、氨基酸类、多聚类、羧酸类和酚酸类对PC1的载荷值分别是0.948、0.983、0.843、0.844、0.967和0.782,载荷值越高表示对应碳源种类对主成分的影响越大。
利用培养120 h的AWCD值 (0.8 K) 对不同处理利用不同碳源种类的特性进行主成分分析。由图4可知,碎石图曲线从第三个因子开始变得比较平缓,特征根小于等于1。其中,第一主成分 (PC1)特征根为4.358,方差贡献率为72.6%,第二主成分(PC2) 特征根为1.141,方差贡献率为19.0%。在主成分分析图中,有且仅有CK处理处在PC1和PC2的负部,M0处理处在PC1的负部、PC2的正部,M20处理处在PC1的中间部位和PC2的正部,M50和M100两个处理所处的位置较为接近,处在PC1的正部。其中,糖类、胺类、氨基酸类、多聚类、羧酸类和酚酸类对PC1的载荷值分别是0.813、0.971、0.910、0.933、0.907和0.481;对PC2的载荷值分别是–0.567、0.024、–0.112、–0.083,0.222 和0.866。从图4和图5中可以清晰地看出,无论是在微生物快速增长的时期,还是在微生物群落达到最大容量时,M50和M100处在不同种类碳源作用密集区,由此说明,秋施基肥有机肥替代无机肥氮素这项施肥措施可以促进土壤微生物对糖类、胺类、氨基酸类、多聚类、羧酸类和酚酸类等多种碳源的利用。
2.4 土壤微生物氨基酸类、糖类、多聚类和羧酸类代谢主成分分析
本研究对微生物氨基酸类、糖类、多聚类和羧酸类的代谢进行进一步分析。B4 (L-天门冬酰胺)、C1 (吐温40)、B1 (丙酮酸甲酯) 分别是氨基酸类、多聚类和羧酸类对M100处理起决定作用的碳源。对于糖类来说,M100处理起决定作用的碳源种类较多,有 H2 (D, L-磷酸甘油)、H1 (α-D-乳糖)、E2 (N-乙酰-D-葡萄糖胺)、A3 (D-半乳糖酸-γ-内酯)、B2 (D-木糖)。在氨基酸类、糖类、多聚类和羧酸类的主成分分析图中 (图5),可以清晰地看出M50和M100处理均处在碳源作用密集区。在M0处理中长期施用化肥,土壤微生物分解B3 (D-半乳糖醛酸)、F2 (D-葡萄糖胺酸) 的能力增强。
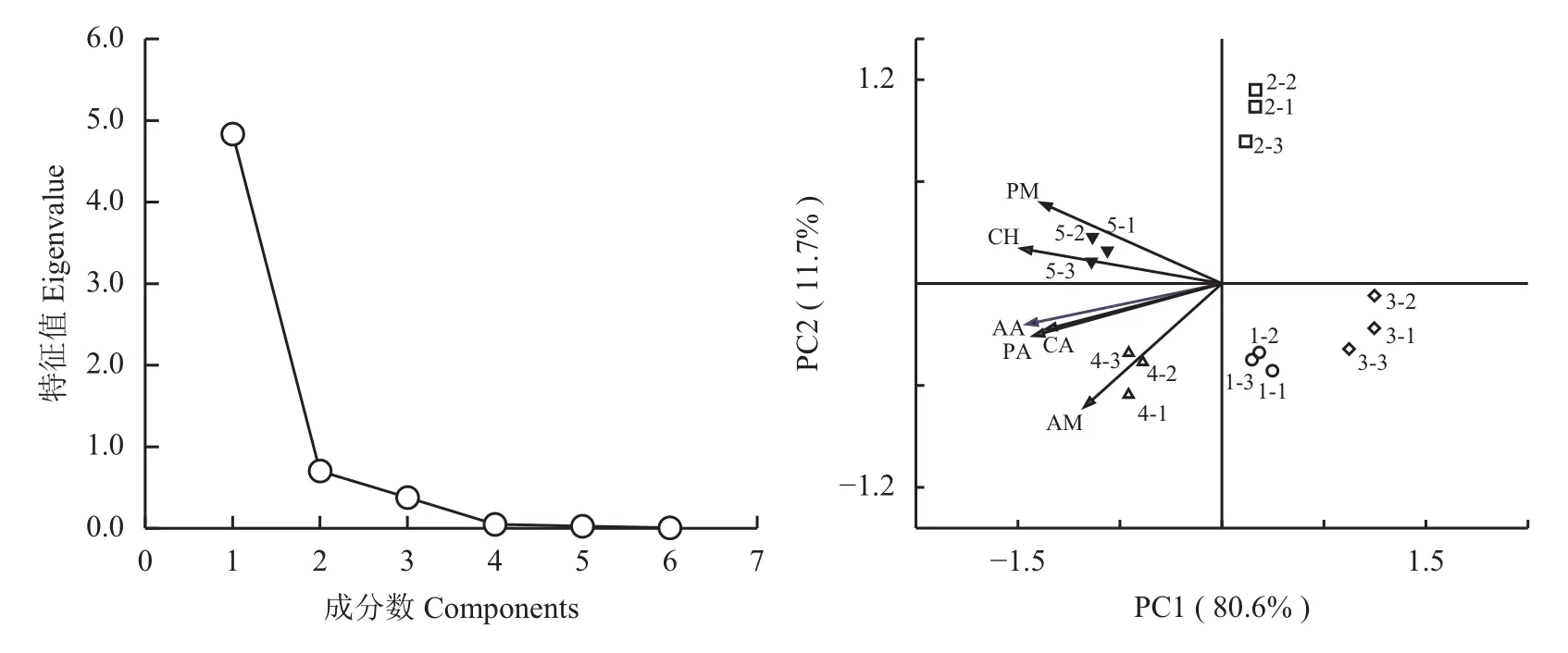
图 3 不同施肥处理土壤微生物多样性主成分分析 (60 h)Fig. 3 Principal component analysis of soil microbial diversity in different fertilization soils (60 h)
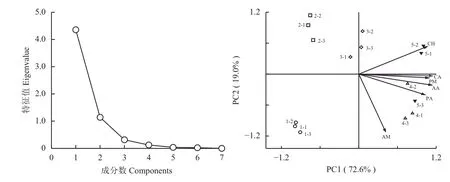
图 4 不同施肥处理土壤微生物多样性主成分分析 (120 h)Fig. 4 Principal component analysis of soil microbial diversity in different fertilization soils (120 h)
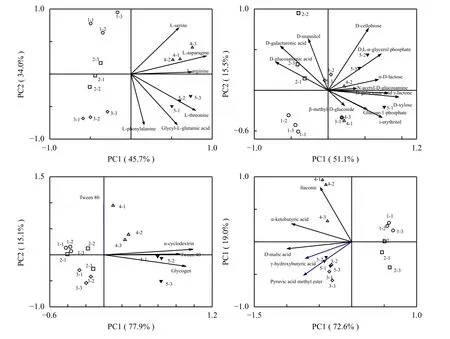
图 5 不同施肥处理土壤微生物不同碳源代谢主成分分析 (120 h)Fig. 5 Principal component analysis of different carbons sources of soil microbial diversity in different fertilization soils (120 h)
2.5 不同施肥处理的土壤微生物碳代谢多样性指数
从表3中可以看出,M0微生物碳源代谢的香农
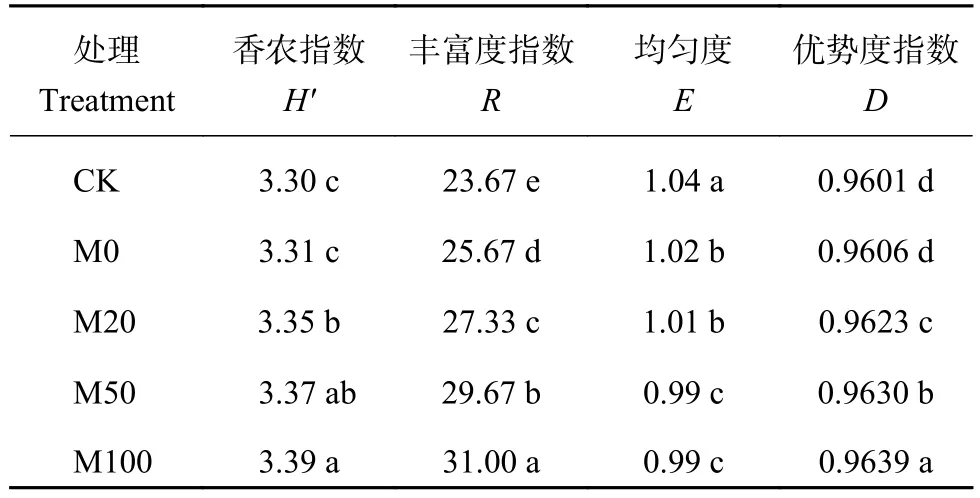
表 3 不同施肥处理下微生物多样性指数 (120 h)Table 3 Diversity indexes of soil bacteria in different treatments at 120 h
指数和优势度指数略高于CK处理,差异没有达到显著水平,丰度度指数显著高于CK处理,均匀度指数显著降低。秋施基肥有机肥替代化肥处理的微生物香农指数、丰富度指数、优势度指数均显著高于CK和M0,但是均匀度指数有了明显的降低,且随着有机肥氮素替代的比例增大,差异越明显。结果表明,有机肥替代无机肥氮素可以提升土壤微生物种类、丰度,以及优势种群的优势度,并使得微生物的均匀度指数下降。
2.6 土壤有机质与微生物碳代谢多样性指数的相关性分析
为了进一步探究不同施肥处理土壤微生物对碳源利用与土壤养分含量关系,本研究选取了不同的土壤养分指标,土壤有机质、土壤全氮含量、土壤碳氮比、土壤全磷含量等与微生物碳代谢等指标进行相关研究,结果发现,土壤有机质与土壤微生物碳代谢相关程度较高。图6表明,土壤有机质含量越高,相应的香农指数、丰富度指数、优势度指数及AWCD值越大,而土壤有机质含量越高均匀度指数越低。
3 讨论
越来越多的学者对微生物多样性的研究采用了现代分子生物学技术,从基因的水平研究土壤微生物的多样性[17–20],但Biolog方法测定土壤微生物多样性依然具有其不可取代的优点,如,无需分离培养微生物,测定简便等[21]。本研究发现,Biolog方法在表征土壤微生物多样性的同时,还可以表征土壤微生物活性。例如,香农指数、丰富度指数、均匀度指数等指标表征了土壤微生物多样性,这在很多文献中都有显示[4,5],而AWCD值拟合的Logistic曲线中的K值大小、潜伏期长短、对数增长期增长速率等指标代表了土壤微生物对碳源的利用效率,能够在一定程度上表征土壤微生物活性,即K值越大、潜伏期越短、对数增长期增长速率越大,土壤微生物活性越高,其报道尚不多见。其主要原因是大多数试验对 Biolog 板的读数间隔设置为 24h[4–5,22–23],该时间间隔较长,掩盖了潜伏期、对数增长期等微生物生长的关键时期。用Biolog方法表征土壤微生物活性,需要进一步对测试方法进行改进,缩短读数间隔。本研究采用读数间隔为12 h,也只是粗略地看到M0处理的潜伏期大于24 h,其他处理的潜伏期处在12~24 h之间,今后研究可以在微生物生长关键时期加大Biolog板的读数频率,更好地拟合微生物生长曲线,进而更准确地表征微生物活性。
本研究发现,五年连续施用无机肥料处理降低了K值、延长潜伏期、降低了对数期增长速率,进一步说明施用无机肥料降低了微生物活性,而香农指数、优势度指数没有显著变化,说明没有降低微生物多样性。原因有以下两个方面:一、无机肥料氮素和有机肥料氮素投入量相等,无机肥料氮素易流失,造成了M0处理留在农田生态系统的氮含量大大减少;二、可能是由于施用无机肥料,改变了土壤环境,降低pH、增加容重、降低含水量等[25],抑制微生物呼吸作用[24],直接降低微生物活性,但没有降低微生物多样性。
很多研究者在研究中得出有机无机肥料配施可以提高土壤微生物多样性和微生物活性[4–7],对于有机无机肥料配施这种施肥管理措施仍然需要进一步研究,首先,有机肥料的施入时期,其次,有机肥料与无机肥料的比例。本研究发现,在冬小麦–夏玉米轮作系统中,秋施基肥有机肥替代无机肥料氮素可以显著提高土壤微生物对碳源的利用能力,提高K值、缩短潜伏期、增加对数期增长速率,说明有机肥替代无机肥料氮素提高土壤微生物多样性,并且土壤微生物多样性随着有机肥施入量增加而呈现增大的趋势,其中M50处理土壤微生物多样性最大;而香农指数、优势度指数的增加,说明有机肥替代化肥提高了土壤微生物活性,并且随着有机肥氮素施入量增加而呈现增大的趋势,其中M100处理土壤微生物活性最强。有机肥氮素施入增加土壤微生物多样性的主要原因可能是有机肥中含有新类型的有机碳,促使新的微生物种类的产生。如,CK和M0处理土壤微生物对D-木糖的利用能力较弱,原因可能是本试验没有进行秸秆还田,没有外源的D-木糖碳源投入到这两个处理中,而M20、M50和M100处理土壤微生物对D-木糖的利用能力较强,其原因可能是有机肥选用了牛粪,牛粪中含有未被完全利用的玉米芯,而玉米芯是D-木糖存在较多的物料。有机肥的施入增加土壤微生物活性的主要原因有两方面:一是土壤微生物多样性的增加为微生物活性的增加提供了基础;二是微生物的激发效应[26],即新鲜外源有机碳的加入,可能会激发了土壤微生物活性,使得土壤原有有机碳分解速率发生剧烈变化。这样一来,土壤微生物为植株提供了大量的可利用的养分,从而提高了植株生物量,高的植株生物量又会分泌更多的简单有机物进一步提高微生物活性。
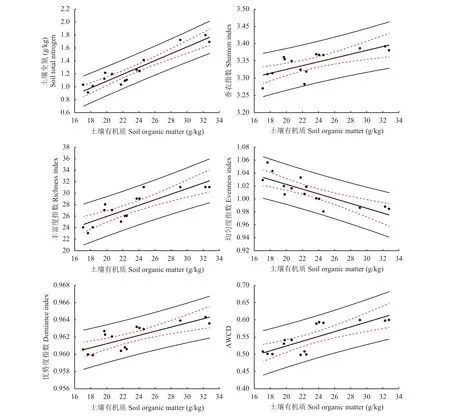
图 6 土壤全氮、香农指数、丰富度指数、均匀度指数、优势度指数及AWCD与土壤有机质含量回归分析Fig. 6 Regression of SOM with TN, shannon index, richness index, evenness index, dominance index and AWCD
土壤在植物、土壤、微生物三者交互作用的影响下达到动态平衡。在这个平衡状态,土壤有机质与土壤微生物功能多样性密切相关,本研究结果表明,土壤有机质与微生物碳代谢相关程度较高。土壤有机质含量越高,相应的香农指数、丰富度指数、优势度指数及AWCD值越大,而土壤有机质含量越高均匀度指数越低,原因可能是土壤有机质含量增加,对碳源的利用增强,但只是对某些碳源利用增强,并没有对全部的碳源都均匀地增加。
参 考 文 献:
[ 1 ]Choudhary K K, Dhar D W. Microbes in soil and their agricultural prospects [M]. New York: Nova Science Publishers, Inc. 2015.
[ 2 ]Paul E A. Soil microbiology, ecology and biochemistry [M]. London:Academic Press, 2014.
[ 3 ]Tamilselvi S M, Chinnadurai C, Ilamurugu K,et al. Effect of longterm nutrient managements on biological and biochemical properties of semi-arid tropical Alfisol during maize crop development stages[J]. Ecological Indicators, 2015, 48: 76–87.
[ 4 ]邢鹏飞, 武晓森, 高圣超, 等. 不同施肥处理对玉米-小麦轮作土壤微生物群落功能多样性的影响[J]. 微生物学杂志, 2016, 36(1):22–29.Xing P F, Wu X S, Gao S C,et al. Effects of different fertilization on soil microbial community and functional diversity in maize-wheat crop rotation[J]. Journal of Microbiology, 2016, 36(1): 22–29.
[ 5 ]李猛, 张恩平, 张淑红, 等. 长期不同施肥设施菜地土壤酶活性与微生物碳源利用特征比较[J]. 植物营养与肥料学报, 2017, 23(1):44–53.Li M, Zhang E P, Zhang S H,et al. Comparison of soil enzyme activities and microbial C metabolism in installed vegetable fields under long-term different fertilization[J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(1): 44–53.
[ 6 ]罗希茜, 郝晓晖, 陈涛, 等. 长期不同施肥对稻田土壤微生物群落功能多样性的影响[J]. 生态学报, 2009, 29(2): 740–748.Luo X Q, Hao X H, Chen T,et al. Effects of long-term different fertilization on microbial community functional diversity in paddy soil[J]. Acta Ecologica Sinica, 2009, 29(2): 740–748.
[ 7 ]罗佳, 刘丽珠, 王同, 等. 有机肥与化肥配施对黄瓜产量及土壤微生物多样性的影响[J]. 生态与农村环境学报, 2016, 32(5): 774–779.Luo J, Liu L Z, Wang T,et al. Effect of combined application of chemical fertilizer with organic manure on cucumber yield and soil microbial diversity[J]. Journal of Ecology and Rural Environment,2016, 32(5): 774–779.
[ 8 ]高明霞, 孙瑞, 崔全红, 等. 长期施用化肥对镂土微生物多样性的影响[J]. 植物营养与肥料学报, 2015, 21(6): 1572–1580.Gao M X, Sun R, Cui Q H,et al. Effect of long-term chemical fertilizer application on soil microbial diversity in anthropogenic loess soil[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(6):1572–1580.
[ 9 ]Lovell R D, Jarvis S C, Bardgett R D. Soil microbial biomass and activity in long-term grassland: effects of management changes[J].Soil Biology and Biochemistry, 1995, 27(7): 969–975.
[10]朱敏, 郭志彬, 曹承富, 等. 不同施肥模式对砂姜黑土微生物群落丰度和土壤酶活性的影响[J]. 核农学报, 2014, 28(9): 1693–1700.Zhu M, Guo Z B, Cao C F,et al. Impact of model of fertilization on microbial abundance and enzyme activity in lime concretion black soil[J]. Journal of Nuclear Agricultural Sciences, 2014, 28(9):1693–1700.
[11]周礼恺. 土壤酶学[M]. 北京: 科学出版社, 1987.Zhou L K. Soil enzymology [M]. Beijing: Science Press, 1987.
[12]García-Ruiz R, Ochoa V, Hinojosa M B,et al. Suitability of enzyme activities for the monitoring of soil quality improvement in organic agricultural systems[J]. Soil Biology and Biochemistry, 2008, 40(9):2137–2145.
[13]Hackett C A, Griffiths B S. Statistical analysis of the time-course of biolog substrate utilization[J]. Journal of Microbiological Methods,1997, 30(1): 63–69.
[14]孔滨, 杨秀娟. Biolog生态板的应用原理及碳源构成[J]. 绿色科技,2011, (7): 231–234.Kong B, Yang X J. Application principle and carbon source composition of Biolog EcoPlate[J]. Journal of Green Science and Technology, 2011, (7): 231–234.
[15]Choi K H, Dobbs F C. Comparison of two kinds of Biolog microplates (GN and ECO) in their ability to distinguish among aquatic microbial communities[J]. Journal of Microbiological Methods, 1999, 36(3): 203–213.
[16]Insam H, Goberna M, Kowalchuk G A,et al. Use of Biolog®for the community level physiological profiling (CLPP) of environmental samples [M]. 2004.
[17]王帅, 盛晓磊, 张雷, 等. 川东低山丘陵区农业旅游活动对土壤微生物群落结构的影响[J]. 土壤通报, 2017, 48(1): 101–109.Wang S, Sheng X L, Zhang L,et al. Agricultural tourism impact on soil ecological environment in hilly area Eastern Sichuan[J]. Chinese Journal of Soil Science, 2017, 48(1): 101–109.
[18]郭魏, 齐学斌, 李平, 等. 不同施氮水平下再生水灌溉对土壤细菌群落结构影响研究[J]. 环境科学学报, 2017, 37(1): 280–287.Guo W, Qi X B, Li P,et al. Impact of reclaimed water irrigation and nitrogen fertilization on soil bacterial community structure[J]. Acta Scientiae Circumstantiae, 2017, 37(1): 280–287.
[19]吴文卫, 刘昂, 谷照虎, 等. 采用PCR-DGGE技术研究处理农田退水组合人工湿地微生物群落特征[J]. 应用与环境生物学报, 2016,22(6): 978–985.Wu W W, Liu A, Gu Z H,et al. A PCR-DGGE study of bacteria community diversity in the constructed wetland treated with agricultural return flow[J]. Chinese Journal of Applied and Environmental Biology, 2016, 22(6): 978–985.
[20]金明. 土壤微生物多样性分析方法的研究进展[J]. 农业技术与装备, 2016, (4): 18–20.Jin M. Research progress on analytical methods used in soil microbial diversity[J]. Agricultural Technology and Equipment, 2016, (4):18–20.
[21]胡婵娟, 刘国华, 吴雅琼. 土壤微生物生物量及多样性测定方法评述[J]. 生态环境学报, 2011, 20(6): 1161–1167.Hu C J, Liu G H, Wu Y Q. A review of soil microbial biomass and diversity measurements[J]. Ecology and Environmental Sciences,2011, 20(6): 1161–1167.
[22]Guanghua W, Junjie L, Xiaoning Q,et al. Effects of fertilization on bacterial community structure and function in a black soil of Dehui Region estimated by Biolog and PCR-DGGE methods[J]. Acta Ecologica Sinica, 2008, 28(1): 220–226.
[23]Liu B, Li Y, Zhang X,et al. Effects of chlortetracycline on soil microbial communities: Comparisons of enzyme activities to the functional diversity via Biolog EcoPlatesTM[J]. European Journal of Soil Biology, 2015, 68: 69–76.
[24]Klimek B, Niklińska M, Jaźwa M,et al. Covariation of soil bacteria functional diversity and vegetation diversity along an altitudinal climatic gradient in the Western Carpathians[J]. Pedobiologia, 2015,58(2): 105–112.
[25]黄昌勇, 徐建明. 土壤学(第三版) [M]. 北京: 中国农业出版, 2012.Huang C Y, Xu J M. Soil science (Third edition) [M]. Beijing: China Agriculture Press, 2012.
[26]Kuzyakov Y, Friedel J K, Stahr K. Review of mechanisms and quantification of priming effects[J]. Soil Biology and Biochemistry,2000, 32(11): 1485–1498.
[27]Zhao S, Li K, Zhou W,et al. Changes in soil microbial community,enzyme activities and organic matter fractions under long-term straw return in north-central China[J]. Agriculture, Ecosystems &Environment, 2016, 216: 82–88.
