黄芩素对肝癌细胞HepG2放疗增敏作用的机制研究*
2018-04-24李星瑶蔡子墨党慧敏吴喜利
安 鹏,李星瑶,蔡子墨,党慧敏,吴喜利
西安交通大学第二附属医院( 西安 710004)
原发性肝癌年病死率也已经占到了我国肿瘤病死率的第二位。随着放疗技术发展,其己逐渐成为治疗肝癌的主要非手术方法之一[1-2]。黄芩是传统中药,其具有清热燥湿,泻火解毒,止血,安胎的功效。用于湿温、暑温胸闷呕恶,湿热痞满,泻痢,黄疸,肺热咳嗽,高热烦渴,血热吐衄,痈肿疮毒,胎动不安[3-4]。黄芩素是黄芩的主要提取物之一,研究表明黄芩素在体外抗肿瘤作用方面表现出活性,并且具有对常用抗癌药物的体外增效作用[5-6]。目前,国内外尚未有关于黄芩素体外放疗增敏的相关研究[7]。因此我们拟在体外进行黄芩素对肝癌细胞HepG2放疗增敏的实验研究,以探讨黄芩素在放疗增敏中的作用机制,从而为临床肝癌放疗增敏提供新的策略。
材料与方法
1 材 料 本组研究中人肝癌HepG2细胞株购买自ATCC细胞库,黄芩素购买自曼斯特有限公司,纯度大于99%,丝裂酶原购买自浙江海正药业,新生胎牛血清及DMEM购买自GIBCO公司,MTT、碘化丙啶及二甲基亚砜购买自Sigma公司,RT-PCR试剂盒购买自福麦斯有限公司。
2 方 法
2.1 细胞培养及分组:快速将所冻存细胞于37 ℃水浴摇床60转/min慢摇复苏,复苏后800转/min离心5 min,吸去上清加入10 ml含15%胎牛血清DMEM培养基,混匀后加入细胞培养板,每孔1 ml,共10孔,5% CO2温箱37 ℃培养。将所有细胞分为五组,即空白对照组:细胞+培养基、放疗组:细胞+培养基+放疗、药物组:药物+细胞+培养基、药物加放疗组:药物+细胞+培养基+放疗、肝细胞加药物组:肝细胞+药物+培养基,用MTT法实验观察黄芩素对细胞的生长抑制及杀伤作用,并检测各组细胞克隆形成数及克隆形成率。
2.2 Western Blotting法:各组细胞以细胞裂解液处理后,在冰上裂解静置30 min,后以BCA法测定蛋白质浓度。后行10%SDS聚丙烯酰胺凝胶电泳,再100 V湿转90 min,并将蛋白转移至PVDF膜上。以5% BSA封闭1 h,抗p53或β-actin抗体4℃孵育过夜,后用标记二抗孵育1 h,后使用天能凝胶成像系统检测蛋白水平。
2.3 QRT-PCR检测p53mRNA表达:通过SYBR荧光实时定量PCR法检测,观察不同组别HepG2细胞中p53mRNA表达情况,基因表达的相对定量基于比较CT (threshold cycle)值法,mRNA相对表达量结果以相对荧光值表示。PCR反应体系为20 μl,包含Power SYBR Green PCR Master Mix 10 μl,上游引物1 μl,下游引物1 μl,cDNA 2 μl; ddH2O 6 μl。反应条件:95 ℃预变性10 min, 1个循环, 95 ℃、变性30 s,退火40 s,72 ℃延伸40 s,共45个循环。每个样本的RNA含量均根据各自的β-actin含量进行标准化。
2.4 流式细胞术:通过FCM检测实验,使用AnnexinV-FITC及PI染色双染分析各组细胞凋亡率。
2.5 统计学方法:本组研究中使用SPSS 19.0存储并处理原始数据,使用均值±标准差及百分率表示计量及计数资料,使用方差分析及卡方检验分析组间数据差异,若P<0.05则认为差异存在统计学意义。
结 果
1 MTT法检测结果 见表1。本组研究结果显示,药物加放疗组HepG2细胞存活率显著低于其他组(P<0.05)。

表1 MTT法检测结果
2 细胞克隆形成 见表2。本组研究结果显示,药物加放疗组HepG2细胞克隆形成数及克隆形成率显著低于其他组(P<0.05),但仍显著高于肝细胞加药物组(P<0.05)。
3 蛋白表达水平 本组研究结果显示,药物加放疗组HepG2细胞p-53/β-actin蛋白水平显著高于其他组,见图1。
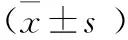
表2 细胞克隆形成结果
4 mRNA表达水平 本组研究结果显示,药物加放疗组HepG2细胞p-53/β-actin mRNA水平显著高于其他组, 见图2。
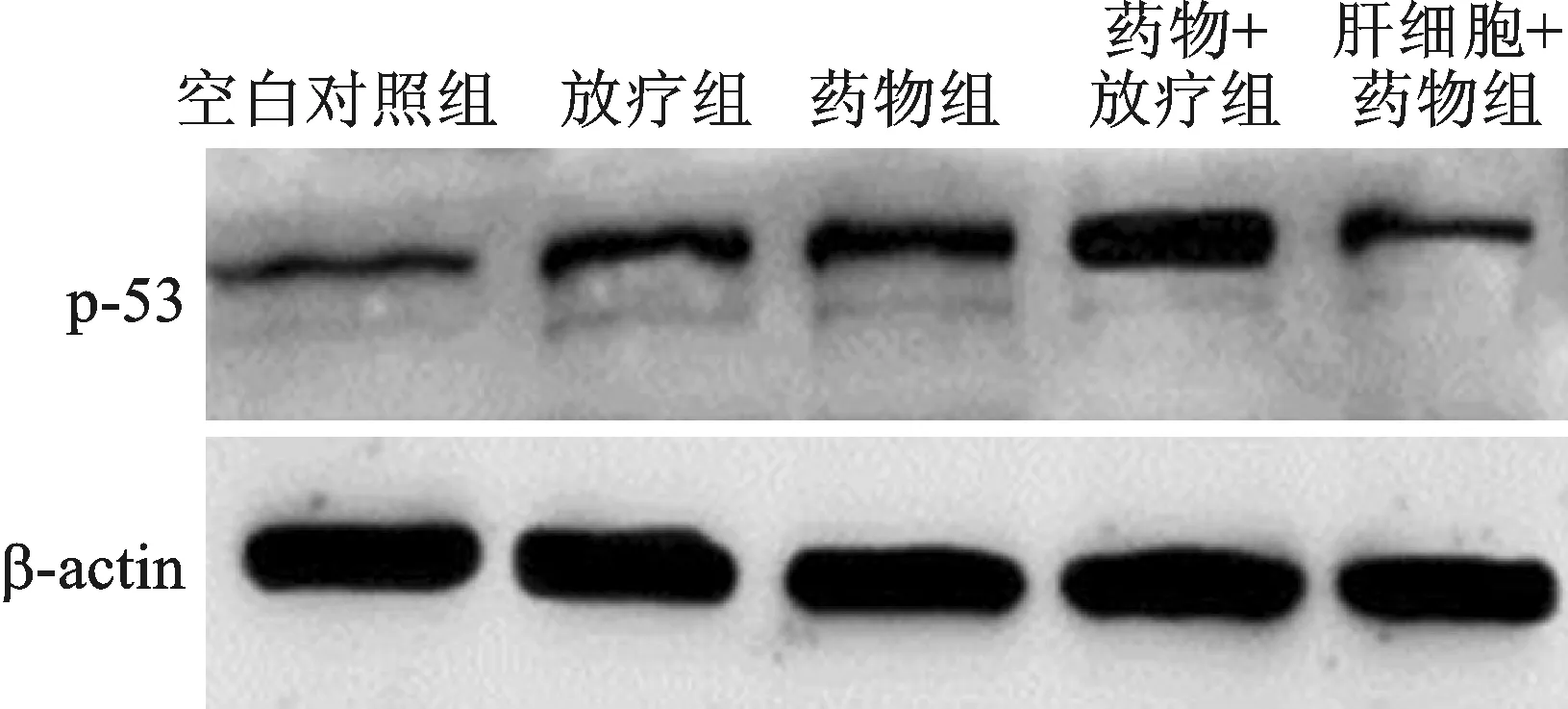
图1 Western Blotting检测结果
5 细胞凋亡检测结果 本组研究结果显示,药物加放疗组HepG2细胞凋亡率显著高于其他组,见图3。

图2 mRNA水平检测结果
讨 论
全球每年新发原发性肝癌约26万例,而我国的原发性肝癌占42.5%。每年因肝癌死亡的人数约占全球的45%[8]。外科手术依然是早期肝癌治疗的首选,但临床就诊患者多属中晚期病人,手术切除率低。即使早期切除,术后5 年复发率也在60%以上。随着放疗技术的发展,放射治疗己成为治疗肝癌的主要非手术方法[9-10]。p53是重要的抑制肿瘤基因一直备受关注,而生理性诱导产生P53依然是在缺氧环境下,有国外学者认为,缺氧环境下可以产生不同的P53,分别是突变型P53和野生型P53两种,这两种P53进而在细胞凋亡及血管生长过程中发挥重要作用[11]。体外培养细胞与整体动物细胞在相同的低氧环境下,体外培养细胞中突变型P53较整体动物细胞能够促进组织血管的生长,并且更迅速地占据主导作用[12-13]。
本组研究结果显示,药物加放疗组HepG2细胞存活率、细胞克隆形成数及克隆形成率显著低于其他组,且药物加放疗组HepG2细胞凋亡率显著高于其他组,HepG2细胞p-53/β-actin蛋白及mRNA水平显著高于其他组。现代药理实验证实黄芩具有抗炎、抗病毒、镇静、抗凝血、降血脂、抗氧化和抗肿瘤等药理作用。黄芩素是一种黄酮类化合物,是唇形科植物黄芩中提取、分离出来的主要有效成分之一,祖国医学认识黄芩具有清热解毒、止血安胎的作用,现代药理学也发现黄芩素具有利胆保肝、抗菌抗炎及抗肿瘤的作用。尤其对抗肿瘤的作用机制缺乏更加深入的研究[14]。有研究发现,黄芩素、黄芩苷在体外实验中对抑制肝癌细胞侵袭及转移都有显著的作用,其机制可能与黄芩素及黄芩苷影响Rho家族基因的表达有关[15]。有实验表明人白血病HL-60细胞通过使用小剂量黄芩素可使其停滞于S或G2/M期,而大剂量黄芩素可诱导人白血病HL-60细胞凋亡[16]。另有实验研究发现,黄芩的水提取物可明显改善小鼠全身性缺氧和心肌缺氧状态,
综上所述,黄芩素一方面在抗肿瘤方面的作用确切,另一方面黄芩具有改善组织缺氧乏氧的作用。那么是否可以通过黄芩改善肿瘤乏氧环境的方式达到肿瘤放疗增敏的作用。根据实验结果表明黄芩素可有效提高肝癌细胞HepG2放疗增敏作用,改善HepG2中p53蛋白及mRNA水平,但其具体机制有待于后续深入研究。
[1] Marques L A, Semprebon S C, Sartori D,etal. Comparison of the effects of monastrol and oxomonastrol on human hepatoma cell line HepG2/C3A[J]. Anticancer Research, 2017, 37(3):1197.
[2] 田 丹, 王 彦, 王 芹,等. LGK-974对人肝癌细胞系HepG2的辐射增敏作用[J]. 辐射研究与辐射工艺学报, 2016, 34(6):29-37.
[3] Huang X, Ma J, Xu J,etal. Simvastatin induces growth inhibition and apoptosis in HepG2 and Huh7 hepatocellular carcinoma cells via upregulation of Notch1 expression[J]. Molecular Medicine Reports, 2015, 11(3):2334-2340.
[4] Zhang Q, Lu C, Fang T,etal. Notch3 functions as a regulator of cell self-renewal by interacting with the β-catenin pathway in hepatocellular carcinoma[J]. Oncotarget, 2015, 6(6):3669-3679.
[5] 朱传东, 王礼学, 王国相,等. 新型纳米金材料的合成及其对HepG2细胞放射增敏的影响[J]. 中华放射医学与防护杂志, 2016, 36(12):881-887.
[6] Grzegorczyk-Karolak I, lukaszKu ma, Wysoki ska H. Study on the chemical composition and antioxidant activity of extracts from shoot culture and regenerated plants of Scutellariaaltissima, L[J]. Acta Physiologiae Plantarum, 2015, 37(1):1736.
[7] Peng Y, Guo C, Yang Y,etal. Baicalein induces apoptosis of human cervical cancer HeLa cells in vitro.[J]. Molecular Medicine Reports, 2015, 11(3):2129.
[8] 杨忠霞, 刘小军. 乳酸脱氢酶-A抑制剂草氨酸钠对肝癌细胞增殖和凋亡的影响[J]. 兰州大学学报:医学版, 2016, 42(2):17-20.
[9] Yang X, Hao J, Zhu C H,etal. Survival benefits of western and traditional Chinese medicine treatment for patients with pancreatic cancer[J]. Medicine, 2015, 94(26):e1008.
[10] Xie S B, He X X, Yao S K. Matrine-induced autophagy regulated by p53 through AMP-activated protein kinase in human hepatoma cells[J]. International Journal of Oncology, 2015, 47(2):517.
[11] 蔡 阳, 朱传东, 王礼学,等. C225-GNPs对人肝癌SMMC-7721细胞放射增敏作用的实验研究[J]. 中华放射肿瘤学杂志, 2017, 26(1):95-97.
[12] Ueki S, Murakami Y, Yamada S,etal. microRNA-mediated resistance to hypoglycemia in the HepG2 human hepatoma cell line[J]. Bmc Cancer, 2016, 16(1):732.
[13] 孙力人, 何士方, 王 锐. 人参皂苷Rg3对鼻咽癌肿瘤干细胞放疗增敏的作用研究[J]. 实用癌症杂志, 2016, 31(7):1053-1055.
[14] Hua Z, Tang J, Xu J,etal. Selenoprotein genes exhibit differential expression patterns between hepatoma HepG2 and normal Hepatocytes LO2 cell lines[J]. Biological Trace Element Research, 2015, 167(2):236-241.
[15] 王艳俊, 蒋永新, 刘 珊,等. 肿瘤放疗增敏药物新靶点[J]. 国际肿瘤学杂志, 2017, 44(2):129-132.
[16] Nobre L S, Jeremias H, Romao C C,etal. Examining the antimicrobial activity and toxicity to animal cells of different types of CO-releasing molecules[J]. Dalton Transactions, 2015, 45(4):1455-1466.
