益肾散结法对UUO大鼠肾脏间质纤维化的影响*
2018-04-24毛加荣刘建红于小勇张晓凤赵英勇程小红
毛加荣, 徐 薇,刘建红,于小勇, 张晓凤,赵英勇,程小红△
1.陕西省中医药研究院 陕西省中医医院(西安 710003),2.西北大学生命科学院(西安 710069)
肾脏间质纤维化是所有慢性肾脏病发展到后期的共同病理学特征[1],是多种肾脏疾病发展至终末期肾功能衰竭的共同通路[2],我们将中医整体辨证与肾脏局部病理改变的微辨证有机结合起来,以益肾散结立法组方,在已取得临床疗效的基础上,通过实验研究观察其对肾功能及肾脏间质纤维化的影响,以期为整体辨证与微观辨证有机结合防治慢性肾脏疾病提供客观依据。
材料与方法
1 实验材料与药物
1.1 实验动物:清洁健康雄性SD大鼠72只,体重180±20 g,购自西安交通大学实验动物中心,动物使用许可证号:SCXK(陕)2012-003。适应性喂养1周,随机分为假手术组、模型组、治疗组、对照组,每组18只。各组均采用分养法,动物室温度保持在26~28 ℃,湿度68%~72%,自由饮水和自然昼夜节律光照。
1.2 实验用药:肾复康Ⅱ号胶囊为陕西省中医医院院内制剂,由山萸肉、菟丝子、姜黄、莪术等组成(陕药管字[2001]第1168号);百令胶囊(国药准字Z10910036,杭州中美华东制药有限公司生产)。
1.3 主要实验仪器:莱卡切片机(LeiCASM2000R)、国产石蜡包埋机(YABO,江苏常州)、日本奥林帕斯显微镜(OlympusBX 41)、图像采集与分析系统(北京中科 HMIAS-2000)由陕西省中医医院肾病实验室提供,日立全自动生化分析仪(7180)由陕西省中医医院检验科提供。
2 实验方法
2.1 动物模型的制备:以10%水合氯醛腹腔注射以麻醉大鼠,模型组、治疗组、对照组大鼠剖开腹腔后用眼科镊子分离左侧输尿管,于左肾下极处用丝线结扎输尿管,然后缝合腹腔。假手术组仅游离左侧输尿管,但不结扎。术后伤口外涂红霉素软膏防止感染。
2.2 给药方法:造模术后第一天开始,治疗组以肾复康Ⅱ号胶囊颗粒405 mg/(kg·d)水溶混悬液灌胃;对照组以百令胶囊颗粒270 mg/(kg·d)水溶混悬液灌胃;假手术组及模型组以药物同等体积的生理盐水灌胃,灌胃容积为1 ml/100g。
2.3 标本的采集与观察指标:分别于灌胃后第7天、第14天、第21天三个时间点,各组处死6只大鼠,腹主动脉取血3 ml以备检测血清肌酐、血尿素氮;剖取左侧肾脏以10%的甲醛溶液固定,留作病理检查标本。
结 果
1 生化指标测定结果 与正常对照组相比,UUO模型组大鼠血清肌酐在造模后第1、2、3周均显著升高;UUO+治疗组大鼠血清肌酐与模型组比较明显降低,且在第1周和第3周有统计学显著差异;对照组仅对第1周UUO大鼠的血清肌酐有显著影响(图1A)。与正常对照组相比,UUO模型组大鼠血清尿素氮在第1、2、3周均显著升高; UUO+治疗组大鼠血清尿素氮与模型组比较明显下降,且在第1、2、3周均有统计学显著差异(图1B);对照组对大鼠血清尿素氮也有不同程度的降低。
2 肾脏形态改变 肉眼观察假手术组两侧肾脏组织情况,外形均无明显异常,各时间观察点双肾呈红褐色,包膜紧致而有光泽。模型组于造模后第2 周,左侧肾脏体积较对侧明显増大,可见水肿、表面凹凸不平、肾孟高度扩张;肾复康Ⅱ号胶囊组和对照药百令胶囊组大鼠肾脏体积増大程度、肾盂扩张等改变均较模型组为轻。

(A)正常对照组、UUO模型组、UUO+肾复康Ⅱ号胶囊和UUO+百令胶囊组灌胃治疗组第1、2、3周大鼠血清肌酐含量。(B)正常对照组、UUO模型组、UUO+肾复康Ⅱ号胶囊和UUO+百令胶囊组灌胃后第1、2、3周大鼠血清尿素氮的含量。模型组与正常对照组比较,#P<0.05,##P<0.01;肾复康Ⅱ号胶囊组或百令胶囊组与模型组比较,*P<0.05,**P<0.01
图1 大鼠血清生化指标的结果
3 肾脏病理学改变
3.1 肾组织HE染色和PAS染色病理改变
3.1.1 HE染色方法:①脱蜡至水;②Harris 苏木素染7 min;③水洗,蒸馏水洗;④0.5%盐酸酒精分化数秒(涮2下);⑤水洗,蒸馏水洗;⑥1%氨水返蓝数秒;⑦水洗,蒸馏水洗;⑧ 0.5%醇溶伊红染核数秒(涮1下);⑨脱水、透明、封片。显微镜下20倍视野观察病理变化。
3.1.2 PAS染色方法:①脱蜡至水,1%高碘酸水溶液染10 min;②蒸馏水冲洗;③将切片擦干放在墨盒中,滴加Schiff试剂,盖上盒盖反应30 min,待组织颜色变红,将切片放染缸中流水冲洗10 min,冲完蒸馏水洗2次;④Harris苏木素染核5 min;⑥0.5%盐酸酒精分化数秒,水洗,蒸馏水洗;⑦1%氨水返蓝数秒,水洗,蒸馏水洗;⑧脱水、透明、封片。显微镜下20倍视野观察病理变化。
3.1.3 病理改变:假手术组各时间点肾脏组织无明显病理改变,肾小管上皮细胞胞排列整齐,肾间质无水肿及炎细胞浸润;模型组于造模后1周,左侧肾组织部分肾小管上皮细胞空泡变性,肾间质灶状水肿及少量炎细胞浸润; 随着梗阻时间的逐步延长,肾小管上皮细胞出现部分脱落、扁平与再生改变,小灶状或灶状肾小管萎缩,并可见代偿扩张,肾间质轻度水肿及少量炎性细胞浸润; 造模后2周,上述改变进一步加重,肾小管萎缩及肾脏间质纤维化面积增大;3周后肾小管萎缩和肾脏间质纤维化程度更为明显,而治疗组和对照组各时间观测点各种病变程度都明显轻于模型组(图 2、图3)。
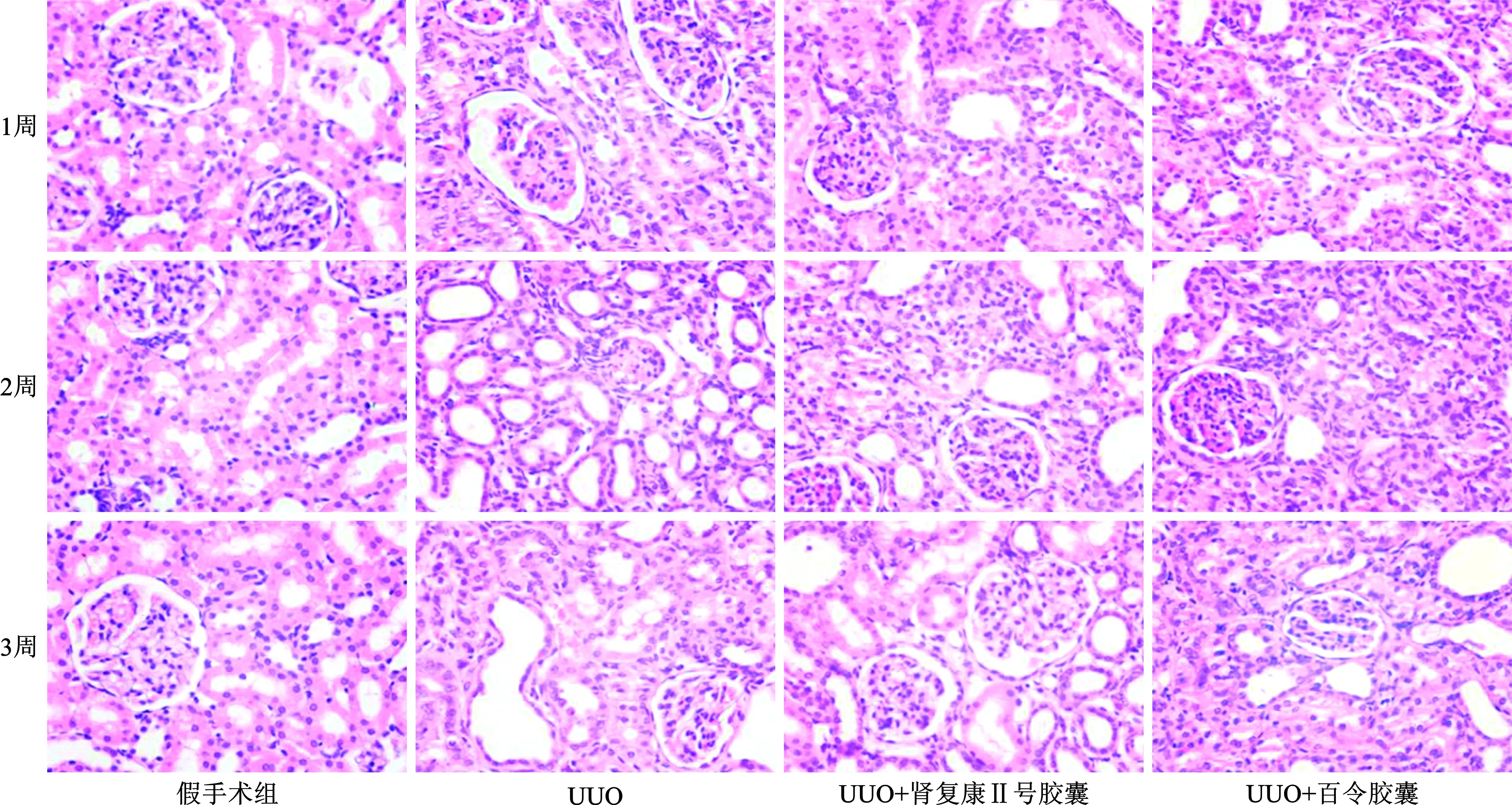
图2 正常对照组、UUO模型组、UUO+肾复康Ⅱ号胶囊和UUO+百令胶囊组灌胃后第1、2、3周SD大鼠肾组织HE染色分析(HE染色×20)
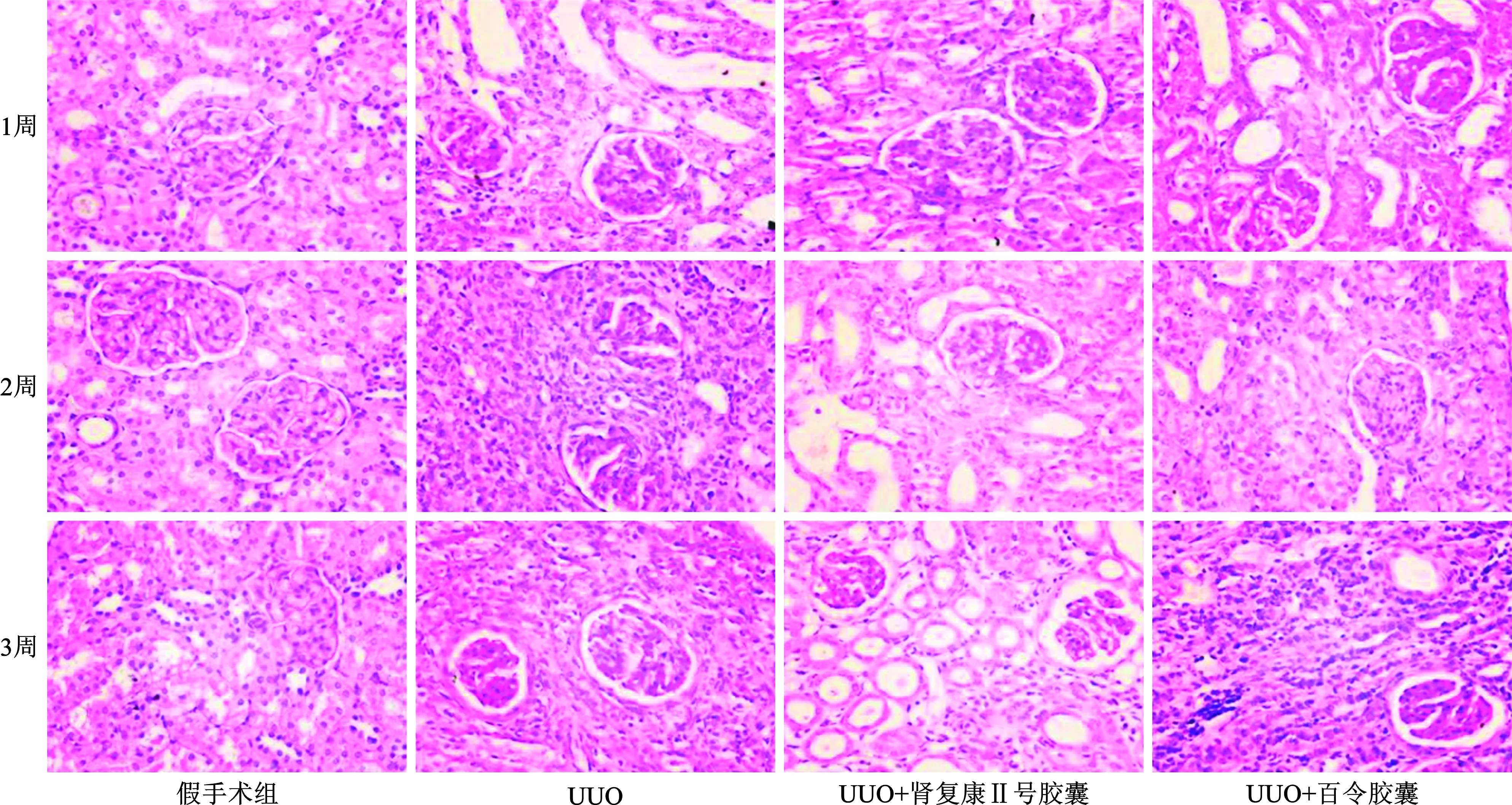
图3 正常对照组、UUO模型组、UUO+肾复康Ⅱ号胶囊和UUO+百令胶囊组
3.2 肾组织Masson染色病理改变
3.2.1 染色方法:①脱蜡至水,二甲苯Ⅰ、Ⅱ各5 min,酒精1 min;②10%重铬酸钾与10%三氯醋酸1:1的比例混合染15 min;③水洗、蒸馏水洗;④1%天青石兰染8 min;⑤水洗、蒸馏水洗;⑥Mager苏木素染5~7 min;⑦水洗、蒸馏水洗;⑧在1%的冰醋酸中放置1~2 min,取出擦干组织周围的冰醋酸放在湿盒中;⑨将1%的酸性品红与1%的丽春红以2∶1的比例混合滴在组织上染22~23 min;⑩用1%的冰醋酸将切片的品红、丽春红洗干净后在磷钼酸中涮几下,滴染亮绿5 min;用1%的冰醋酸洗干净亮绿,擦干组织周围的冰醋酸,直接以100%酒精快速脱水、透明、封片。显微镜下20倍视野观察病理变化。
3.2.2 病理改变:见图4。治疗组和对照组各时间观测点各种病变程度都明显轻于模型组。
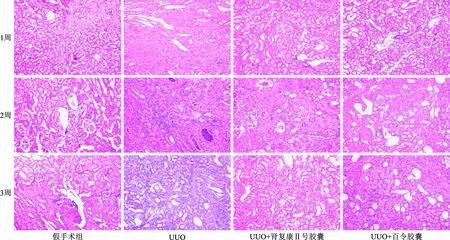
图4 正常对照组、UUO模型组、UUO+肾复康Ⅱ号胶囊和UUO+百令胶囊组灌胃
假手术组在第1、2、3周Masson染色未见明显改变;UUO模型组随着梗阻时间的延长,肾脏间质纤维化面积逐渐增大。单侧输尿管梗阻后第1周,可见肾小管上皮细胞空泡变性,未见明显间质增宽和胶原纤维沉积; 单侧输尿管梗阻后第2周,肾间质胶原纤维沉积,局部纤维化; 单侧输尿管梗阻后第3周,间质胶原纤维进一步增多,纤维化面积进一步增大,纤维化程度进行性加重。
讨 论
无论何种原因导致的肾小球疾病、肾小管间质疾病或肾血管疾病,随着疾病的进展,均可导致肾小管萎缩和肾脏间质纤维化。其特征为肾脏间质中大量细胞外基质积聚,导致肾脏逐步减退[3]。因此,肾功能的恶化,很大程度上取决于肾脏间质纤维化的程度[4]。肾脏间质纤维化、肾组织瘢痕形成的病理改变具有固定不移、经久不愈的特点,与“瘀血”致病特征相似[5],肾络成积是其微观辨证的基本病机[6]。由于肾小管萎缩,肾小管浓缩功能障碍,临床表现为夜尿增多、小便清长等症状,常出现中医肾气不足证候。随着肾脏间质纤维化程度的加重,肾脏间质纤维成分增多,肾脏小动脉管壁玻璃样变,逐步导致肾小球硬化,且临床表现千变万化,与中医“痰”之致病特征相关[5]。将显微镜下微观的病理变化与中医辨证有机结合,全身表现为肾气不足表现,肾脏局部痰、瘀互结,具有“不动难破”特征,因此肾脏间质纤维化的中医病机可概括为肾气不足、痰瘀互结,以益肾散结立法,由山萸肉、炒杜仲、仙灵脾、醋鳖甲、王不留行、姜黄、僵蚕、莪术等组成方剂,并研发为“肾复康Ⅱ胶囊”用于临床取得了较好疗效。
为了证实其临床疗效的可靠性,并阐明其作用机制,我们开展了实验研究。单侧输尿管梗阻(UUO) 模型的主要病理改变以肾脏间质纤维化为特征,且呈进行性加重过程,是目前公认的肾脏间质纤维化模型[7],多在造模后第2周左右出现较为明显的纤维化改变[8-9]。本研究采用UUO模型研究益肾散结法制剂-肾复康Ⅱ号胶囊对肾功能的影响及其抗大鼠肾脏间质纤维化的效果。研究结果显示,进行单侧输尿管结扎后,梗阻侧肾盂积水,肾间质水肿,肾小管上皮细胞空泡变性、崩解脱落,因而肾小球受压,肾小囊压力升高,肾小球滤过功能下降,血肌酐、尿素氮升高。UUO+治疗组大鼠血清肌酐、尿素氮在不同时点与模型组比较均明显下降,说明益肾散结法及其制剂对肾功能具有保护作用,其机制可能与肾复康Ⅱ号胶囊抑制小管上皮细胞的转分化有关[10]。随着输尿管梗阻时间的延长,肾小管萎缩,肾脏间质纤维化形成。单侧输尿管梗阻后第1周,病理改变以肾小管上皮细胞空泡变性为主,梗阻后第2周肾脏间质胶原纤维沉积,局部纤维化;单侧输尿管梗阻后第3周,肾脏间质胶原纤维进一步增多,纤维化面积进一步增大,纤维化程度进行性加重,造模后肾脏病理改变及纤维化形成过程与文献报道基本相拟[8-9]。研究证实,治疗组和对照组在各时间观测点肾脏各种病变程度都明显轻于模型组(图4),说明肾复康Ⅱ号胶囊对肾脏间质纤维化具有抑制作用,同时说明整体辨证与微观改变有机结合的认识与组方原则有其内在的科学依据,也是取得临床较好疗效的内在基础。
[1] Qstendorf T,Boor P,Van Roeyen CR,etal. Platelelet-derived growth factors (PDGFs) in glomerular and tubulointerstitial fibrosis [J]. Kidney Int Suppl,2014,4(1):65-69.
[2] Iwano M,Neilson EG.Mechanisms of tubulointerstitial fibrosis[J]. Curr OPin Nephrol Hypertens,2004,13(3):279-284.
[3] Grande MT, Sanchez-Laorden B, Lopez-Blau C,etal. Snaillinduced partial epithelial-to-mesenchymal transition drives renal fibrosis in mice and can be targeted to reverse established disease [J] . Nat Med, 2015,21(9):989-997.
[4] Nangaku M.Mechanisms of tubulointerstitial injury in the kidney:final common pathways to end-stage renal failure[J].Intern Med,2004,43(1):9-17.
[5] 程小红,于小勇,毛加荣.IgA肾病的病理改变与中医微观辨证[J].中国中西医结合肾病杂志,2014,15(2):185-186.
[6] 刘玉宁,程小红.肾小球疾病不同病理变化的中医病机探讨[J].中国中西医结合肾病杂志,2011,12(1):81-82.
[7] Klahr S,Morrissey J.Obstructive nephropathy and renal fibrosis [J].Am J Physiol Renal Physiol,2002,283(5) :F861-F875.
[8] Ohashi R,Shimizu A,Masuda Y,etal.Peritubular capillary regression during the progression of experimental obstuctive nephropathy[J].J Am Soc Nephrol,2002,13(7) :795-1805.
[9] Efrati S,Berman S,Chachashvili A,eral.Rosiglitazone treatment attenuates renal tissue inflammation generated by urinary tract obstruction[J].Nephrology(Carlton),2009,14(2):189-197.
[10] 史 健,杨洪涛,胡 锐,等. 肾复康Ⅱ号抗肾间质纤维化及对人肾上皮小管细胞转分化的作用[J].陕西中医,2014,35(1):103-105.
