益肾散结法对大鼠肾脏间质纤维化组织TGF-β1和PAI-1表达的影响*
2018-04-24程小红刘建红赵英勇毛加荣张晓凤于小勇
程小红,邢 斌,刘建红,赵英勇,毛加荣, 张晓凤,于小勇
1.陕西省中医药研究院 陕西省中医医院(西安 710003),2.西北大学生命科学院(西安 710069)
各种慢性肾脏疾病随着病情的进展,均可出现程度不同的肾脏间质纤维化改变[1]。根据肾脏间质纤维化形成后的形态学特征与病理属性特点,结合全身临床表现,我们以益肾散结立法组方研制出院内制剂-肾复康Ⅱ号胶囊,应用于临床10余年。本研究采用单侧输尿管梗阻方法复制大鼠肾脏间质纤维化模型,观察益肾散结法中药制剂-肾复康Ⅱ号胶囊对纤维化肾组织转化生长因子β1(TGF-β1)和纤溶酶原激活物抑制剂-1(PAI-1)表达的影响,以探讨其部分作用机理。
材料与方法
1 实验材料
1.1 实验动物:清洁健康SD大鼠72只,雄性,2~3月龄,体重(200±20) g,购于西安交通大学医学院动物中心,使用许可证号为SCXK(陕)2012-003。适应性喂养1周,随机分为假手术组、模型组、治疗组、对照组,每组18只。
1.2 研究用药:肾复康Ⅱ号胶囊为院内制剂,由陕西省中医医院制剂中心提供,批号:陕药管字[2001]第1168号;百令胶囊(国药准字Z10910036,杭州中美华东制药有限公司生产)。
1.3 主要实验用仪器试剂:LeiCASM2000R型切片机、江苏常州YABO石蜡包埋机、OlympusBX 41显微镜、北京中科 HMIAS-2000图像采集与分析系统等由陕西省中医医院肾病实验室提供。TGF-β1抗体及PAI-1抗体试剂盒(兔抗人、鼠多抗)、生物素藕联羊抗兔IgG、链霉卵白素标记的辣根过氧化物酶(HRP)工作液、DAB染色剂:均购自武汉博士德生物制剂公司。
2 实验方法
2.1 动物模型的制备:大鼠肾间质纤维化模型的复制采用目前公认而成熟的输尿管结扎方法[2]。
2.2 实验分组及给药方法:将72只雄性SD大鼠随机分为4组,平均每组18只。
治疗组:以肾复康Ⅱ号胶囊颗粒405 mg/(kg·d)灌胃;对照组:以百令胶囊颗粒270 mg/(kg·d)灌胃;假手术组、模型组:均以生理盐水灌胃。
将上述剂量的肾复康Ⅱ号胶囊颗粒和百令胶囊颗粒以温开水溶解制成混悬液,于造模后一天开始给各组大鼠以1 ml/100g灌胃,假手术组及模型组大鼠同一时间以等体积的生理盐水灌胃。
2.3 标本采集:分别于灌胃后第2周、3周、4周时每组处死6只动物,剖取左脏以10%甲醛固定,留作病理检查标本。
2.4 观测指标
2.4.1 肾脏间质纤维化相对面积:将肾脏组织切片进行Masson染色,用日本奥林帕斯光学显微镜观察肾脏间质纤维化情况,以图像采集系统在光镜20倍下采集肾皮质中10个不含肾小球且互不重叠的视野,以图像分析系统计算每例切片、每个视野肾脏间质的绿染面积,计算平均数作为肾脏间质纤维化的面积[3]。
2.4.2 普通光学显微镜下观察肾纤维化组织TGF-β1、PAI-1免疫组化染色表达情况:将石蜡包埋的肾脏组织切片,根据试剂盒说明书介绍的方法及步骤进行TGF-β1、PAI-1免疫组化染色,用日本奥林帕斯光学显微镜观察TGF-β1及PAI-1表达情况。
结 果
1 各组肾脏间质纤维化情况 将肾组织切片进行Masson染色。厚度为3μm的石蜡切片脱蜡至水,二甲苯Ⅰ、Ⅱ各5 min,酒精1 min;10%重铬酸钾与10%三氯醋酸1∶1的比例混合染15 min;水洗、蒸馏水洗;1%天青石兰染8 min;水洗、蒸馏水洗;Mager苏木素染6 min;水洗、蒸馏水洗;在1%的冰醋酸中放置2 min,取出擦干组织周围的冰醋酸放在湿盒中;将1%的酸性品红与1%的丽春红以2∶1的比例混合滴在组织上染22 min;用1%的冰醋酸将切片的品红、丽春红洗干净后在磷钼酸中涮几下,滴染亮绿5 min;用1%的冰醋酸洗干净亮绿,擦干组织周围的冰醋酸,直接以100%酒精快速脱水、透明、封片。显微镜下20倍视野观察病理变化,各时间点各组大鼠肾小管及肾脏间质病理变化情况见图1。假手术组大鼠肾小管及肾间质结构正常;随着时间的延长,模型组肾脏间质纤维化程度逐渐加重;与模型组比较,治疗组及对照组肾脏间质纤维化程度较轻。结果见表1。
假手术组 UUO UUO+肾复康Ⅱ号胶囊 UUO+百令胶囊

图1 各组肾组织Masson染色病理改变(Masson染色×20)
注:与假手术组比较,△P<0.05;与模型组比较,*P<0.05;治疗组与对照组比较,☆P>0.05
表1可见,模型组及药物组、对照组肾脏间质均有不同程度的纤维化,与假手术组相比具有显著差异 (P<0.05)。在14 d、21 d、28 d三个不同观测时点,治疗组及对照组肾脏间质纤维化面积增加程度均明显较模型组为轻,纤维化面积较模型组明显减少(P<0.05);但治疗组和对照组之间无显著差异(P>0.05),说明治疗药物-肾复康Ⅱ号胶囊和对照药物-百令胶囊均对肾脏间质纤维化的形成有一定抑制作用。
2 肾组织TGF-β1、PAI-1免疫组化染色表达情况
2.1 肾组织TGF-β1、PAI-1免疫组化染色方法:将各组3~4 μm肾组织石蜡切片,脱蜡、水化、灭活、微波修复抗原。滴加5% BSA封闭液,室温20 min,分别加PAI-1抗体(兔抗人、鼠多抗)稀释度1∶300、TGF-β1抗体(兔抗人、鼠多抗)稀释度1∶50,37度烤箱孵育1 h,加生物素化山羊抗小鼠IgG,室温下孵育15~20 min,加链霉卵白素标记的辣根过氧化物酶(HRP)工作液室温下孵育15~20 min,DAB显色15 min,苏木素中复染细胞核2 min,二甲苯透明,中性树脂封片。显微镜下20倍视野观察染色表达情况。
2.2 肾组织免疫组化染色TGF-β1表达情况:见图2。
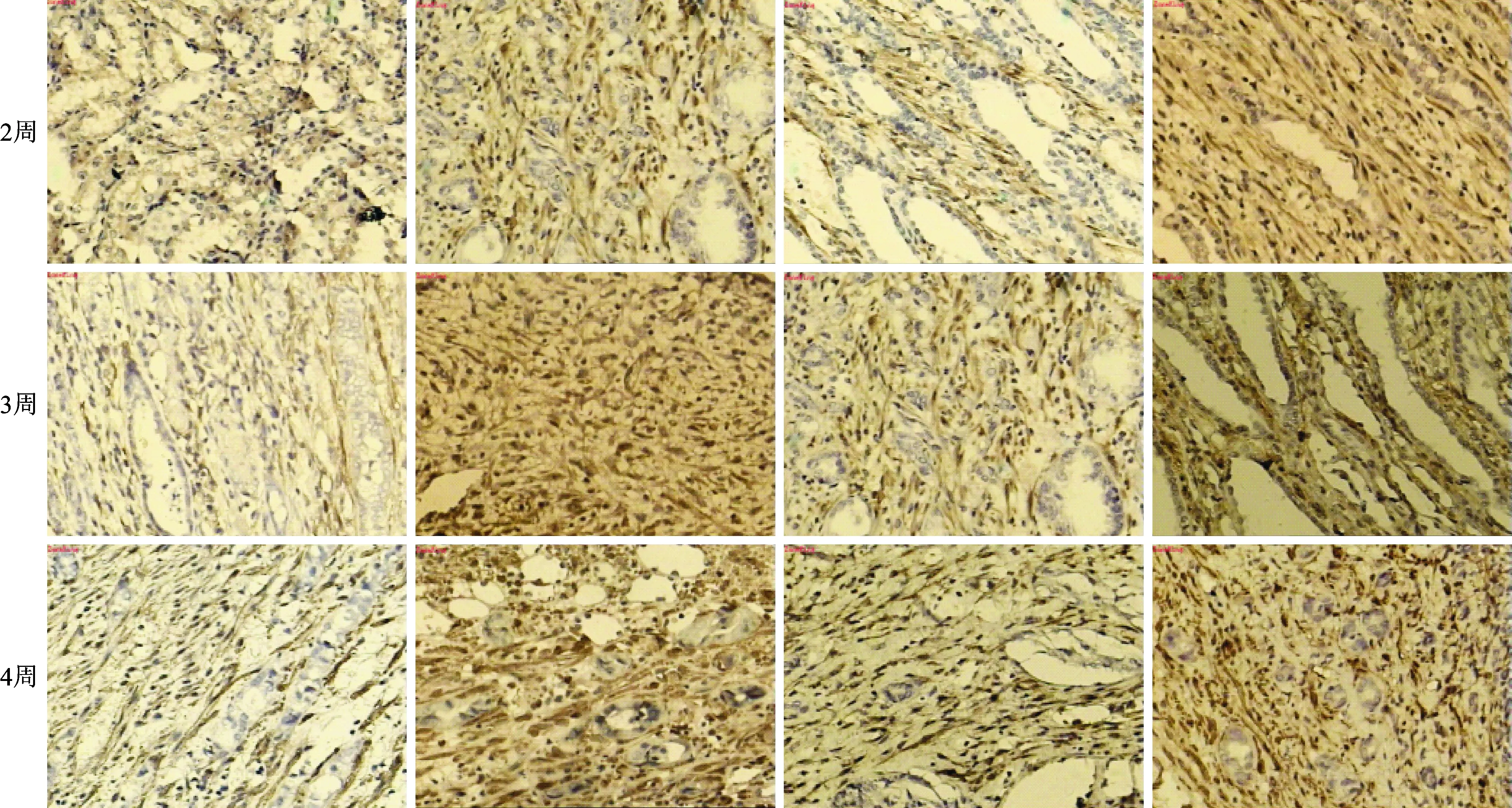
假手术组 UUO UUO+肾复康Ⅱ号胶囊 UUO+百令胶囊
图2 各组肾组织免疫组化染色TGF-β1表达情况(免疫组化染色× 20)
图2可见,在假手术组,第2周和第3周TGF-β1均无表达,第4周时仅有少量表达;在模型组,各时间观测点TGF-β1均明显表达,且随时间延长而更加显著; 治疗组及对照组,在各时间观测点TGF-β1表达均较模型组减弱,说明治疗药物肾复康Ⅱ号胶囊和对照药物百令胶囊均能抑制TGF-β1在肾间质中的过度表达。
2.3 肾组织免疫组化染色PAI-1表达情况:见图3。肾复康Ⅱ号胶囊和百令胶囊均能抑制PAI-1的表达。

假手术组 UUO UUO+肾复康Ⅱ号胶囊 UUO+百令胶囊
图3 各组肾组织免疫组化染色PAI-1表达情况(免疫组化染色×20)
图3可见,在假手术组,各时间观测点PAI-1均无表达;在模型组,各时间观测点PAI-1均明显表达,且随时间延长而更加显著; 治疗组及对照组,在各时间观测点PAI-1表达均明显较模型组为弱,说明治疗药物-肾复康Ⅱ号胶囊和对照药物-百令胶囊均能抑制PAI-1在肾间质中的表达。
讨 论
在肾组织中,所有固有细胞均可表达和分泌TGF-β1[4]。TGF-β1能刺激成纤维细胞以增加细胞外基质
(ECM)成分合成,抑制多种ECM降解酶活性从而抑制ECM降解,可促使肾小管上皮细胞向肌成纤维细胞转分化[5]。PAI-1能抑制ECM降解,导致或促进组织器官硬化或纤维化。PAI-1也是一个重要的促纤维化因子[6],各种原因所致肾损伤时均有不同程度的表达[7]。
单侧输尿管梗阻导致肾脏间质纤维化模型的特点是进行性的小管萎缩和肾间质纤维化,肾脏间质纤维化即肾组织瘢痕形成后,病理改变具有固定不移、经久不愈的特点,与“瘀血”致病特征相似[8],肾小管功能障碍为主要临床表现,常出现夜尿增多、乏力等脾肾气虚证候,故“益肾散结”是微观辨证与整体辨证有机结合而确立的治法。既往研究证明,“益肾散结”中药制剂-复康Ⅱ号胶囊能减轻肾脏间质纤维化的程度[9-10]。研究结果显示:UUO组、治疗组及对照组大鼠肾纤维化组织中TGF-β1、PAI-1表达显著高于假手术组,也证明TGF-β1、PAI-1是促进肾脏间质纤维化的主要因子。但治疗组和对照组与模型组比较,TGF-β1、PAI-1表达明显减弱,表明肾复康Ⅱ号胶囊抑制肾脏间质纤维化形成的部分机制,是通过抑制肾脏组织TGF-β1和PAI-1表达而实现的。尽管肾复康Ⅱ号胶囊和对照药物百令胶囊均对肾脏局部的病理改变有相似的作用,但针对全身表现而“益肾”、针对肾脏局部病理改变而“散结”是其优势所在。
[1] Qstendorf T,Boor P,van Roeyen CR,etal. Platelelet-derived growth factors (PDGFs) in glomerular and tubulointerstitial fibrosis [J]. Kidney Int Suppl,2014,4(1):65-69.
[2] Diamond JR , Ricardo SD , Klahr S. Mechanisms of interstitial fibrosis in obstructive nephropathy[J]. Semin Nephrol, 1998, 18:594-602.
[3] 董健平,陈香美,师锁柱,等.金属蛋白酶组织抑制剂1在大鼠肾小管间质损害中的表达及其意义[J]. 中华肾脏病杂志,2002,18(2):275-279.
[4] 王晓莹,王继明.肾小管间质纤维化与细胞因子调控异常相关性研究[J].吉林医学,2007,28(17):1913.
[5] Sato M,Muragaki Y,Saika S,etal. Targeted disruption of TGF-betal/Smad3 signaling protecst against renal tubulointerstitial fibrosis induced by unilateral obstruction [J].J Clin Invest,2003,112(10):1486-1494.
[6] Zhang G,Kernan KA,Collins SJ,etal.Plasmin ( ogen) promotes renal interstitial fibrosis bypromoting epithelial-to-mesenchymal transition: role of plasmin-activatedsignals[J].J Am Soc Nephrol,2007,18(3): 846-859.
[7] 程 晖,丁国华,陈 铖,等.尿激酶型纤溶酶原激活物对糖尿病大鼠肾脏系膜基质的影响[J].中华糖尿病杂志,2011,3(4):324-327.
[8] 程小红,于小勇,毛加荣.IgA肾病的病理改变与中医微观辨证[J].中国中西医结合肾病杂志,2014,15(2):185-186.
[9] 史 健,刘建红,程小红. 肾复康Ⅱ号胶囊对大鼠肾间质纤维化的影响[J].陕西中医,2012,33(9):1238-1240.
[10] 史 健,杨洪涛,胡 锐,等. 肾复康Ⅱ号抗肾间质纤维化及对人肾上皮小管细胞转分化的作用[J].陕西中医,2014,35(1):103-105.
