不同生态环境中铜绿丽金龟幼虫肠道细菌产消化酶活性比较
2018-04-24薛志静庄桂芬黄振东万晴张瑞玲张忠
薛志静,庄桂芬,黄振东,万晴,张瑞玲,张忠
1.泰山医学院基础医学院,山东 泰安 271016; 2. 山东省新发传染病溯源与防控协同创新中心,山东 泰安 271016
蛴螬是金龟子的幼虫,是我国农作物、果树、林木的重要地下害虫,我国记录的有1 800余种[1],其中危害农、林、牧草的有110余种[2]。在黄淮海地区主要以铜绿丽金龟(Anomalacorpulentamotschulsky)、华北大黑鳃金龟(Holotrichiaoblitafaldermann)和暗黑鳃金龟(H.parallelamotschulsky)3种为主[3]。多数蛴螬以植物根茎为食或营腐生生活,需要降解植物和土壤中的纤维素、蛋白质、淀粉等物质,以获得生长发育所需要的营养和能量[4]。已有研究表明,铜绿丽金龟幼虫后肠膨大,形成富含细菌的特殊发酵腔结构,生活着种类多样的微生物,这些肠道微生物可以产生消化酶,消化酶活性的高低决定了蛴螬对营养物质消化吸收能力和生长发育速度[5-7]。在已确定不同生态环境中铜绿丽金龟幼虫肠道细菌组成的基础上[7],本文采用两种方法研究了肠道细菌的产消化酶活性,为筛选产消化酶高活性菌株用于微生态制剂开发奠定基础。
1 材料与方法
1.1菌株 所有菌株均为本实验室自两个不同生境(野外废弃的菜园和花生田)的铜绿丽金龟幼虫分离并鉴定得到。
1.2仪器和试剂 主要仪器设备:752sp紫外可见光分光光度计、电冰箱、光照培养箱、SW-CJ-2D型净化工作台、HNY-2102C摇床、高精度数显恒温水浴锅、FA/JA电子天平、电热恒温鼓风干燥箱、离心机(赛默飞世尔科技公司)、智能人工气候箱、立式压力蒸汽灭菌器、碱式滴定管、Milli-Q超纯水系统(Millipore公司)等。主要试剂:羧甲基纤维素钠、橄榄油、聚乙烯醇、碘伏、刚果红、溴甲酚紫、L-酪氨酸、福林、三氯乙酸、可溶性淀粉、葡萄糖、3,5-二硝基水杨酸(DNS)等。
1.3方法
1.3.1酶液的制备 从筛选培养基上挑取能产生透明圈的菌株于5 mL LB液体中,37℃、110 r/min摇床过夜培养,10 000 r/min离心10 min使菌体沉淀得到酶液。
1.3.2平板透明圈法 参照薛志静等[7]和高绘菊等[8]。记录筛选培养基中透明圈直径(D)和菌落直径(d),通过比较D/d的值来判断菌株产酶能力大小,该值越大,菌株产酶能力越强。
1.3.3分光光度计法
1.3.3.1蛋白酶活性的测定 采用福林-酚法[9-10]。首先制作酪氨酸标准曲线。以酪素作为酶的底物,测定管中加入酶液,对照管中加入煮沸15 min的酶液,使酶失活,加入底物,37℃水浴20 min,加入三氯乙酸终止反应,然后1 000 r/min离心,去除沉淀,取上清液于另一试管,加入福林试剂和碳酸钠混匀,37℃水浴显色15 min,在波长680 nm处进行比色,以对照管调零,读取测定管的吸光度值。从绘制的酪氨酸标准曲线方程,得出酪氨酸的浓度,求出蛋白酶活性值。蛋白酶活性单位定义:在37℃条件下,每毫升酶液1分钟水解酪蛋白产生的酪氨酸的浓度。蛋白酶活性=c/(t·v),式中c为酪氨酸的浓度(μg/mL),t为反应时间,v为酶液体积。
1.3.3.2淀粉酶活性的测定 采用淀粉-碘法[9-10]。首先制作可溶性淀粉标准曲线。以可溶性淀粉作为反应底物,测定管中加入酶液,37℃水浴预热5 min,再加入碘应用液,37℃水浴10 min,蒸馏水稀释至50 mL。对照组不加酶液,混匀。在波长660 nm处进行比色,以对照管调零,读取测定管吸光度值。淀粉酶活性单位定义:在37℃条件下,每毫升酶液1分钟内水解淀粉后剩余的可溶性淀粉的浓度。淀粉酶活性=c/(t·v),式中c为可溶性淀粉的浓度(μg/mL),t为反应时间,v为酶液体积。
1.3.3.3纤维素酶活性的测定 采用3,5-二硝基水杨酸法[9-10]。首先制作葡萄糖标准曲线。以羧甲基纤维素钠作为反应底物,测定管中加入酶液,对照管中加入煮沸15 min的酶液,37℃水浴恒温糖化30 min,取出立即水浴煮沸15 min,终止反应。然后加入DNS显色液,水浴中煮沸显色15 min后,冷却至室温,再加蒸馏水定容至25 mL,混匀。以对照管调零,在波长540 nm处进行比色。纤维素酶活性单位定义:在37℃条件下,每毫升酶液1分钟内水解CMC产生的葡萄糖的浓度。纤维素酶活性=c/(t·v),式中c为葡萄糖的浓度(μg/mL),t为反应时间,v为酶液体积。
1.3.3.4脂肪酶活性的测定 采用聚乙烯醇橄榄油乳化液水解法[9]。以聚乙烯醇橄榄油乳化液作为反应底物,对照管中加入95%乙醇,测定管和对照管分别加入酶液,37℃水浴20 min,用95%乙醇终止反应。再加1%酚酞指示剂,用0.05 M标准氢氧化钠溶液滴定至微红色,记录滴定用去NaOH溶液的体积。脂肪酶活性单位定义:在37℃条件下,每分钟内每毫升酶液滴定消耗的NaOH溶液的体积。脂肪酶活性=(A-B)/(t·v),式中A为样品耗碱液体积(mL),B为对照组耗碱液体积(mL),t为反应时间,v为酶液体积。
1.4统计学方法 采用IBM SPSS Statistics 20统计软件对不同生态环境中的铜绿丽金龟幼虫肠道细菌产消化酶活性进行方差分析,并根据方差分析的检验统计结果对两种方法测得的不同生境中铜绿丽金龟幼虫肠道细菌产消化酶活性进行差异显著性分析。
2 结 果
2.1蛋白酶活性 经过方差分析,平板透明圈法测得的不同生境蛋白酶活性之间的差异无统计学意义,F=1.089,P=0.415>0.05;福林-酚法测得的各菌株的蛋白酶活性之间差异有统计学意义,F=461.565,P<0.05,其中粘质沙雷菌、霍氏肠杆菌和蜡样芽胞杆菌的产蛋白酶活性显著高于其他几种产蛋白酶菌株(表1)。因此,测定产蛋白酶菌株的产酶活性,福林-酚法的灵敏度要优于平板透明圈法。同时,不管是在花生田还是废弃菜园铜绿丽金龟幼虫体内分离到细菌的蛋白酶活性,福林-酚法得到数据的变异系数均低于平板透明圈法,说明福林-酚法的可重复性和精密度更好(表2)。
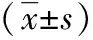
表1 两种不同生境中铜绿丽金龟幼虫肠道细菌产蛋白酶活性比较
注:同一列字母相同,表明方差分析在0.05水平上差异无统计学意义;*表示数据间差异有统计学意义(P<0.05)。
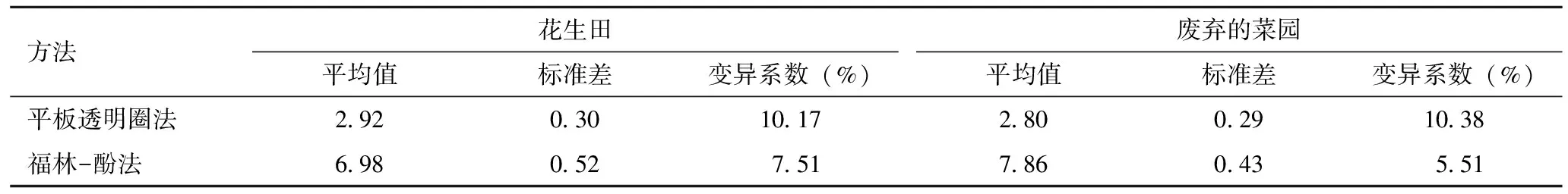
表2 两种方法测定细菌产蛋白酶活性变异系数分析
2.2淀粉酶活性 经过方差分析,平板透明圈法测得的菌株的淀粉酶活性之间差异无统计学意义(F=0.4963,P=0.5200);淀粉-碘法测得的菌株产淀粉酶活性差异有统计学意义(F=42.349,P=0.003),其中蜡样芽胞杆菌的淀粉酶活性显著高于多食鞘氨醇杆菌(表3),说明淀粉-碘法的灵敏度要优于平板透明圈法。测定不同生态环境铜绿丽金龟幼虫体内分离到细菌的蛋白酶活性时,淀粉-碘法得到数据的变异系数均低于平板透明圈法,说明淀粉-碘法的可重复性和精密度更好(表4)。
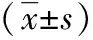
表3 两种不同生境中铜绿丽金龟幼虫肠道细菌的产淀粉酶活性比较
注:a表示两数据间差异有统计学意义,F=42.349,P=0.003。

表4 两种方法测定细菌产淀粉酶活性变异系数分析
2.3纤维素酶活性 经过方差分析,平板透明圈法测得的各菌株的纤维素酶活性之间差异有统计学意义(F=8.5721,P=0.011),其中粘质沙雷菌的产酶活性显著高于其他菌株;3,5-二硝基水杨酸法测得的各菌种的纤维素酶活性之间差异也有统计学意义(F=18.7673,P=0.005),其中多食鞘氨醇杆菌和粘质沙雷菌的产纤维素酶活性显著高于其他菌株,说明3,5-二硝基水杨酸法的灵敏度要高于平板透明圈法(表5)。同时,3,5-二硝基水杨酸法得到数据的变异系数均低于平板透明圈法,说明3,5-二硝基水杨酸法的可重复性和精密度更好(表6)。
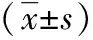
表5 两种不同生境中铜绿丽金龟幼虫肠道细菌的产淀粉酶活性比较
注:同一列字母相同者表明方差分析在0.05水平上差异无统计学意义;*表示两数据间差异有统计学意义(P<0.05)。
2.4脂肪酶活性 产脂肪酶的细菌仅分离自废弃菜园的铜绿丽金龟幼虫体内,菌株为非脱羧勒克菌。分别用平板透明圈法和聚乙烯醇橄榄油乳化液水解法测定了其产脂肪酶活性。结果表明,聚乙烯醇橄榄油乳化液水解法比平板透明圈法的变异系数大,说明该方法精密度较低(表7)。测定肠道细菌脂肪酶活性的首选方法是平板透明圈法。
3 讨 论
3.1结果分析与国内外相关研究比较 铜绿丽金龟幼虫肠道细菌可以分泌淀粉酶、蛋白酶、纤维素酶、脂肪酶等多种酶类消化食物。一般认为,动物体内消化酶活力的高低可以直接影响营养物质的消化与吸收能力,并与摄入的营养物质类型及含量有关[11]。比较不同生境的消化酶活性可知,废弃菜园的野生蛴螬蛋白酶活性比花生田高,可能是由于野生蛴螬以腐殖质为主要食物来源,为有效降解土壤中的蛋白质,其肠道细菌的产蛋白酶活性较高;而花生田的蛴螬产纤维素酶的活性比废弃的菜园高,可能是由于花生田中蛴螬多以取食花生的根为生,需要降解其中大量的纤维素,因此其肠道中细菌产纤维素酶活性较高。本研究采用两种方法测定铜绿丽金龟幼虫肠道细菌的产消化酶活性,通过结果分析可知,测定铜绿丽金龟幼虫肠道细菌的产蛋白酶、淀粉酶和纤维素酶活性时最好选择分光光度计法,而在测定脂肪酶活性时,首选平板透明圈法。国内外对蛴螬肠道细菌的组成已有研究[4,7,12-15],且部分研究也关注到其肠道中产纤维素酶的共生细菌[12],但这些研究均未涉及到肠道细菌产消化酶的活性研究,无法筛选出高产酶活性的菌株。
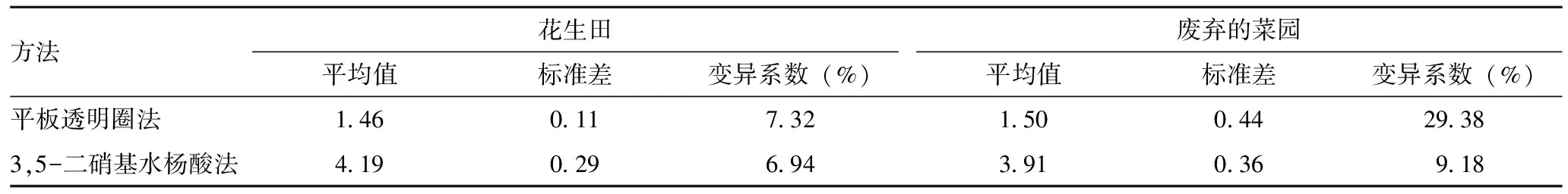
表6 两种方法测定细菌产纤维素酶活性变异系数分析

表7 两种方法测定非脱羧勒克菌的脂肪酶活性
3.2研究的意义与不足 昆虫肠道共生细菌产消化酶活性的研究多以平板透明圈法为主,方法简单,结果直观,易于操作,但精度较低;以分光光度计法测定细菌产消化酶活性,灵敏度高,但操作复杂,受仪器限制较多。本研究以铜绿丽金龟幼虫肠道细菌为研究对象,比较了两种方法在测定细菌产消化酶活性方面的优劣,得到了适用于不同消化酶细菌活性测定的方法。在此基础上,比较了不同细菌的产酶活性,筛选出高产酶活性菌株,这些菌株可用于功能性微生态制剂的开发,既可用于特种动物饲料加工,还可用于农业废弃物的快速发酵,提高废弃物的利用效率[12]。
但由于分光光度计法和平板透明圈法均难以实现高通量,筛选过程中仍未建立大规模的快速筛选,因此还需要进一步探索高通量测定细菌产消化酶活性的新方法。
[1] WEI Hongjun, HUANG Wenqin. A general account of the development of studies on the subterranean insects in China[J]. J Appl Entomol, 1992(3): 168-170. (in Chinese)
魏鸿钧, 黄文琴. 中国地下害虫研究概述[J]. 应用昆虫学报, 1992(3): 168-170.
[2]LUO Chen, GUO Xiaojun, ZHANG Zhili. Species identification of white grubs in lawns around Beijing and their damage characteristics[J]. Insect Sci, 2008, 15(1): 108-112. (in Chinese)
罗晨, 郭晓军, 张芝利. 京郊草坪蛴螬的种类和为害特点[J]. 昆虫学报, 2008, 51(1): 108-112.
[3]SUN Haoyu, LIU Shusen, XI Jinghui, et al. Effects ofHeterorhabditisbacteriophorainfection on enzymes activities and energy substances content in white grubs[J]. Chin J Biol Ctrl, 2014, 30(1): 65-72. (in Chinese)
孙昊雨, 刘树森, 席景会, 等. 蛴螬感染嗜菌异小杆线虫后酶活性和能源物质含量变化[J]. 中国生物防治学报, 2014, 30(1): 65-72.
[4]HUANG Shengwei. Molecular diversity of bacterial community in the gut ofHolotrichiaparallela(Coleoptera: Scarabaeidae)[D]. Wuhan: Huazhong Agricultural University, 2009. (in Chinese)
黄胜威. 暗黑鳃金龟肠道共生菌分子多态性研究[D]. 武汉: 华中农业大学, 2009.
[5]Huang SW, Zhang HY, Marshall S, et al. The scarab gut: A potential bioreactor for biofuel production[J]. Insect Sci, 2010, 17(3): 175-183.
[6]Zheng WW, Zhao YS, Zhang HY. Morphology and ultrastructure of the hindgut fermentation chamber of a melolonthine beetleHolotrichiaparallela(Coleoptera: Scarabaeidae) during larval development[J]. Micron, 2012, 43(5): 638-642.
[7]XUE Zhijing, ZHUANG Guifen, HUANG Zhendong, et al. Screening and identification of the digestive enzyme-producing bacteria from the intestine ofAnomalacorpulentalarvae[J]. Chin J Microecol, 2017, 29(8): 878-883. (in Chinese)
薛志静, 庄桂芬, 黄振东, 等. 铜绿丽金龟蛴螬肠道产消化酶细菌的分离与鉴定[J]. 中国微生态学杂志, 2017, 29(8): 878-883.
[8]GAO Huiju, LU Guobing, CHA Chuanyong, et al. Isolation and screening of the enzyme-producing bacteria in the intestine of silkworm[J]. Sci Seric, 2007, 33(2): 228-233. (in Chinese)
高绘菊, 路国兵, 查传勇, 等. 家蚕肠道产酶菌的分离与筛选[J]. 蚕业科学, 2007, 33(2): 228-233.
[9]白燕, 王维新. 刺参肠道蛋白酶、淀粉酶、脂肪酶与纤维素酶活性的测定方法[J]. 饲料工业, 2012(20): 28-32.
[10] WANG Baihai, WANG Jungang, LEI Chaoliang. Inquisition of the midgut digestive enzyme activity difference between lab reared and feralPeriplanetaamericana[J]. Chin J Vector Biol Ctrl, 2007, 18(2): 95-97. (in Chinese)
王柏海, 王俊刚, 雷朝亮. 人工饲养和野生美洲大蠊消化酶活性差异研究[J]. 中国媒介生物学及控制杂志, 2007, 18(2): 95-97.
[11] TANG Qingfeng, WU Zhenting, JINTao, et al. The activities of major digestive enzymes in the midgut ofEupolyphagasinensis[J]. J Appl Entomol, 2005, 42(5): 557-561. (in Chinese)
唐庆峰, 吴振廷, 金涛, 等. 中华真地鳖中肠主要消化酶的活性研究[J]. 应用昆虫学报, 2005, 42(5): 557-561.
[12] HUANG Shengwei. Study on microbiota diversity and cellulolytic bacterial community in the hindgut ofHolotrichiaparallelalarvae(Coleoptera: Scarabaeidae)[D]. Wuhan: Huazhong Agricultural University, 2012. (in Chinese)
黄胜威. 暗黑鳃金龟幼虫肠道微生物分子多态性及纤维素降解菌多样性研究[D]. 武汉: 华中农业大学, 2012.
[13] TIAN Xiaoyan, SONG Fuping, ZHANG Jie, et al. Diversity of gut bacteria in larvalProtaetiabrevitarsis(Coleoptera: Scarabaedia) fed on corn stalk[J]. Acta Entomologica Sinica, 2017, 60(6): 632- 641. (in Chinese)
田小燕, 宋福平, 张杰, 等. 饲喂玉米秸秆的白星花金龟幼虫肠道细菌多样性[J]. 昆虫学报, 2017, 60(6): 632- 641.
[14] ZHU Lin, LIU Yusheng, LIU Ning, et al. The isolation and identification of intestinal bacteria from larvalHolotrichiaparallelaMotschalsky(Coleoptera: Scarabaeidae)[J]. Chin J Microecol, 2012, 24 (7): 602-605. (in Chinese)
朱琳, 刘玉升, 刘宁, 等. 暗黑鳃金龟甲幼虫肠道细菌分离及鉴定[J]. 中国微生态学杂志, 2012, 24(7): 602-605.
[15] WANG Feifei, LIU Yusheng, JI Xiaoxu, et al. The isolation and identification of intestinal microflora of adultPotosiabrevitarsis[J]. Chin J Microecol, 2009, 21(9): 798-800.
王菲菲, 刘玉升, 姬小雪, 等. 白星花金龟成虫肠道细菌的分离鉴定[J]. 中国微生态学杂志, 2009, 21(9): 798-800.
