关节腔内应用与静脉应用氨甲环酸在初次单侧全膝关节置换术中疗效比较的 Meta 分析
2018-04-24陈朦村王金龙杨述华刘先哲
陈朦村 王金龙 杨述华 刘先哲
全膝关节置换术 ( total knee arthroplasty,TKA )作为中晚期及终末期膝关节炎最有效的治疗方法之一,已被证明能够纠正关节畸形,缓解关节持续性的疼痛并长期维持关节的稳定性[1]。中国乃至世界范围内的 TKA 手术需求一直在稳步增加。然而,由于 TKA 围术期失血明显,并且常伴有不可忽视的隐匿性失血,输血是 TKA 患者的不可避免的问题[2]。虽然术中控制性低血压,自体血回输和止血带的应用可以有效减少术中失血和术后输血率[3],然而,其应用的实际效果和并发症仍然不能让外科医师满意。
作为赖氨酸的合成衍生物,氨甲环酸 ( tranexamic acid,TXA ) 是纤溶酶原激活的竞争性抑制剂,能够与纤维蛋白上的赖氨酸残基竞争纤维蛋白溶酶原的结合,从而抑制纤维蛋白溶解和稳定凝块[4]。相对其它抗纤维蛋白溶解药物如氨基苯酸,其应用更具成本效益[5]。在应用于骨科领域之前,TXA 已广泛应用于不同的环境,如心脏手术,上消化道出血,产后出血和原位肝移植,其应用效价得到了广泛认可。
膝关节外科医生期望抑制围术期增强的纤维蛋白溶解活性以减少围术期失血。Benoni[6]在 1995 年首先提出在全膝置换中静脉滴注 TXA 能减少术后出血,TXA 在随后的膝关节置换手术中得到了广泛的临床应用和推广,已有数个大型临床研究[7-8]和几个荟萃分析[9-10]证实,静脉内 ( intravenous,IV ) 应用TXA 能够有效减少 TKA 术中的失血和术后输血,同时并不增加深静脉血栓 ( deep vein thrombosis,DVT )的风险。然而,仍然存在一些研究人员质疑静脉使用 TXA 的有效性和安全性,认为其使用不能显著减少失血量,并与升高的 DVT 形成发生率相关[11]。
与静脉应用 TXA 相比,关节腔内 ( intraarticular,IA ) 应用 TXA 的逐渐得到人们的重视,其优势是 TXA 直接靶向应用于关节腔内的出血来源,同时,局部应用使得全身对 TXA 的吸收减少 70%,降低血浆水平浓度,降低血栓栓塞相关并发症 ( 例如动静脉血管血栓形成或栓塞事件 ) 的可能性,并且,关节腔内应用 TXA 在术后应用药物的要求较少,是一种更安全也更有效的替代方案[12]。在这样的条件下,最佳的 TXA 应用仍然存在一定争议。为此,笔者对文献进行荟萃分析,以比较关节腔内应用和静脉应用 TXA 时的临床有效性和安全性,为临床工作提供指导和帮助。
资料与方法
一、检索策略
搜索数据库包括 PubMed,CENTRAL ( Cochrane Central Register of Controlled Trial ),ScienceDirect,Embase 以及 CNKI。同时手工检索图书馆馆藏期刊,并追溯纳入文献的参考文献。所有数据库检索起止时间均从建库至 2016 年 10 月。检索关键词为:“全膝关节置换术 ( total knee arthroplasty OR total knee replacement OR TKA OR TKR )”以及“氨甲环酸 ( tranexamic acid )”以获取最大化敏感性和特异性的搜索结果。对数据库中检索出的文献目录( 包括相关综述和 Meta 分析 ) 进行手动搜索,找出潜在的合格的文献或病例报告。在出版日期或语言方面没有限制。
二、文献纳入标准与排除标准
1. 纳入标准:( 1 ) 随机对照试验 ( randomized controlled trials,RCT );( 2 ) 试验参与人员为初次,单侧接受 TKA 手术;( 3 ) 研究包括局部 ( 关节腔 )和静脉应用 TXA 的干预措施;( 4 ) 研究包含观察指标:a. 失血结果:包括总失血量,最大术后血红蛋白 ( Hb ) 下降以及总术后引流量;b. 患者输血需求;c. 血栓栓塞并发症发生率,包括 DVT 和肺栓塞( pulmonary embolism,PE )。
2. 排除标准:( 1 ) 使用尸体和模拟模型的研究;( 2 ) 参与者患有出血性或血液系统相关性疾病的研究;( 3 ) 未报告上述任何一项临床效果指标的研究。
三、数据提取
排除重复后,数据提取工作由 2 位作者各自独立筛选论文的标题和摘要,并作出取舍,对根据摘要难以取舍的论文,则由此 2 位作者共同审查全文予以取舍。
提取以下数据:( 1 ) 参与者的人口统计学数据:包括年龄,性别,TKA 手术指征;( 2 ) TXA 的给药途径及给药方法,输血标准,术后预防措施等信息;( 3 ) 接受输血的患者数量,失血结果包括总失血量,最大术后 Hb 下降绝对值和术后引流量;( 4 )术后血栓栓塞相关并发症 ( DVT 和 PE ) 的发生率。
四、质量控制
2 位评审员独立评定合格研究的质量。研究质量按照 Jadad 评分量表对纳入分析的文献进行质量分析及控制,根据随机序列产生是否恰当 ( 0~2 分 ),随机化隐藏是否合理 ( 0~2 分 )、盲法实施是否恰当 ( 0~2 分 )、参与者撤出与退出是否明确( 0~1 分 ),共计 7 分,1~3 分视为低质量,4~7 分视为高质量。综合上述指标,得出文献的证据质量,并决定是否纳入文献。差异在讨论后以协商方式解决,如有必要,咨询第 3 名审查员。
五、统计学处理
所有数据由 2 位独立作者采用 RevMan5.3 软件分别进行分析评估 Meta 分析的结果。所有连续型变量 [ 总引流量,总失血量、血红蛋白 ( Hb ) 下降值 ]通过平均数差值 (MD) 和相应的 95% 可信区间 (CI)表示,计数资料 ( 输血率,血栓栓塞并发症发生率 )表示为具有 95% 置信度 (CI) 的相对危险度 (RR)。显著性差异设置为P=0.05 以判断试验中的最终结果是否差异有统计学意义。
使用χ2检验和I2统计来检验纳入文献的异质性。当χ2<0.1 或I2统计值>50% 时,被认为研究文献间存在明显的统计异质性。根据异质性检验结果,当没有异质性的统计学证据时,采用固定效应模型;否则,应进行敏感性分析找出产生异质性的原因,若具有临床同致性,则最终决定选择进行亚组分析或选择随机效应模型。对临床试验提供的数据无法进行合并分析时,则只进行描述性分析。
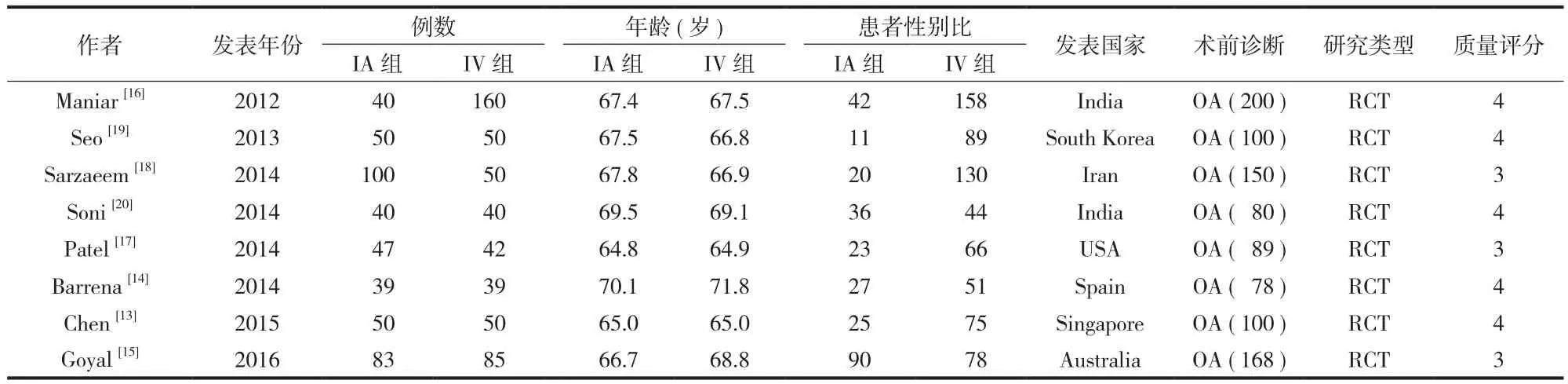
表1 纳入文献患者基本情况Tab.1 The basic information of patients included in the literature
结 果
一、文献的筛选与纳入
本研究共查得 602 篇文献,通过排除重复文献,阅读题目、摘要,剩得 21 篇文献,阅读全文后筛除 13 篇文献,最终纳入 8 篇随机对照临床试验文献,包括 965 例患者[13-20]( 图 1,表1 )。纳入的8 项研究共涉及 12 组不同剂量和使用时机的静脉与关节腔内应用 TXA 的对比 ( 表2 )。
二、 输血率
有 11 篇文献 ( 797 例 ) 提供了输血率数据。组间并不存在显著的统计异质性 (P=0.39,I2=6% ),采用固定效应模型。各组间输血率差异无统计学意义(RR=1.00,95%CI=0.68~1.45,P=0.99 ) ( 图 2 )。
三、最大 Hb 下降值
有 7 篇文献 ( 665 例 ) 提供了最大 Hb 下降值数据。对于最大 Hb 下降值,各组间差异无统计学意义 (MD=0.43,95%CI=-0.08~0.95,P=0.10 )。然而,由于组间存在显著的统计异质性 (P<0.001,I2=93% ) ( 图 3 )。采用随机效应模型,这些结果应谨慎解释。
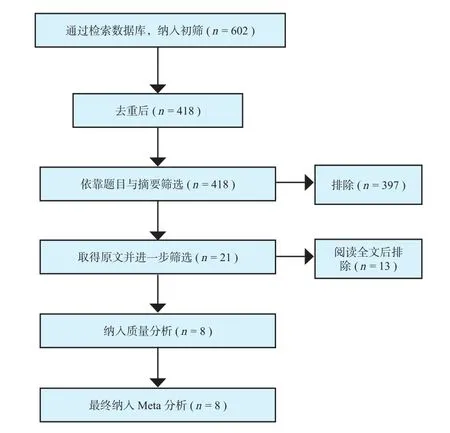
图1 文献纳入和排除研究筛选流程图Fig.1 Flowchart of literature inclusion / exclusion review
四、总失血量
有 9 篇文献 ( 628 例 ) 提供了总失血量数据。对于总失血量,各组间差异无统计学意义 (MD=-5.65,95%CI=-198.36~187.05,P=0.95 )。然而,由于存在显著的统计异质性 (P<0.001,I2=98% ) ( 图 4 )。采用随机效应模型,这些结果应谨慎解释。
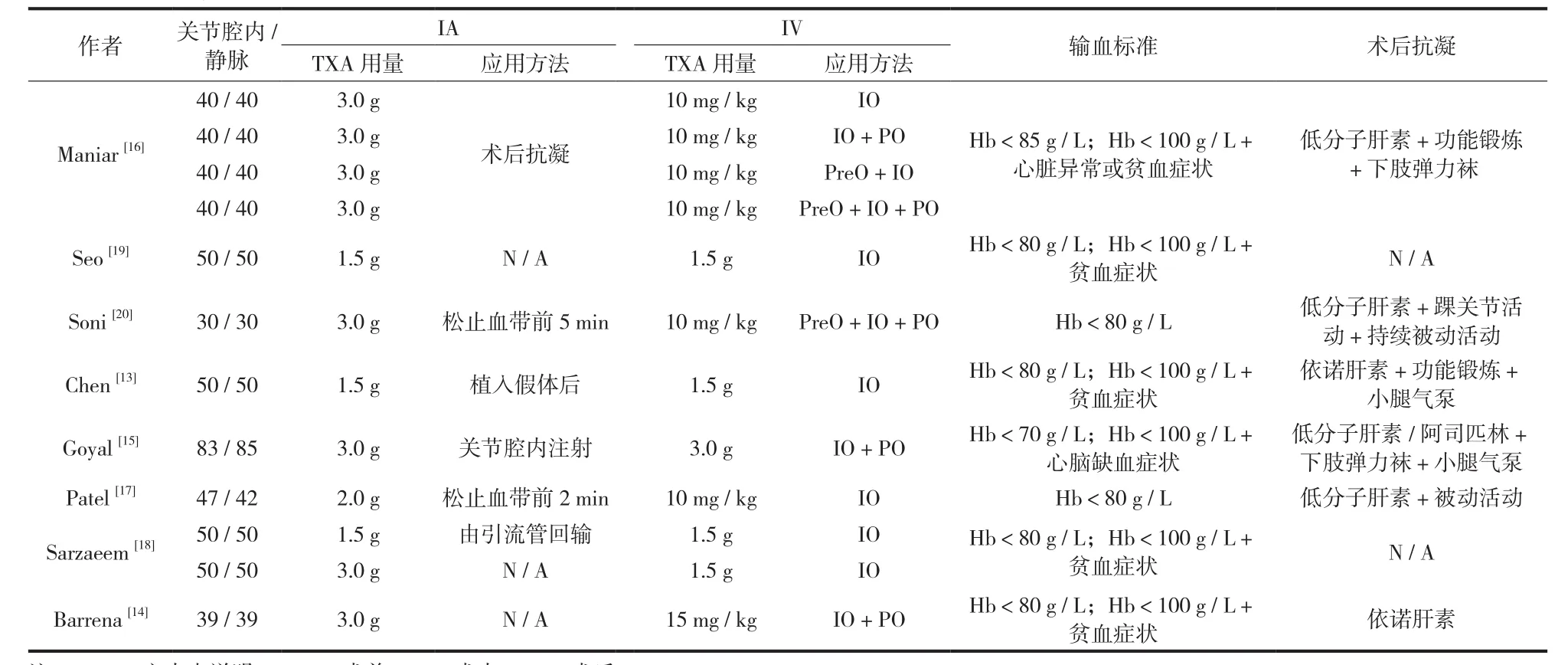
表2 观测指标数据统计Tab.2 Summary of observation data

图2 关节腔内组与静脉组输血率比较森林图Fig.2 Forest map of blood transfusion rate between intra-articular and intravenous TXA

图3 关节腔内组与静脉组术后最大 Hb 下降值比较森林图Fig.3 Forest map of maximal drop of Hb between intra-articular and intravenous TXA
五、总引流量
有 8 篇文献 ( 547 例 ) 提供了总引流量数据。对于总引流量,各组间差异无统计学意义 (MD=40.73,95%CI=-16.83~98.28,P=0.17 )。然而,由于存在显著的统计异质性 (P<0.001,I2=81% ) ( 图 5 )。采用随机效应模型,这些结果应谨慎解释。
六、血栓相关性并发症发生率 ( PE 及 DVT )
有 8 篇文献 ( 689 例 ) 提供了血栓相关性并发症发生率数据。组间并不存在显著的统计异质性 (P=0.68,I2=0% ),可采用固定效应模型。各组间输血率差异无统计学意义 (RR=1.11,95%CI=0.47~2.65,P=0.81 ) ( 图 6 )。
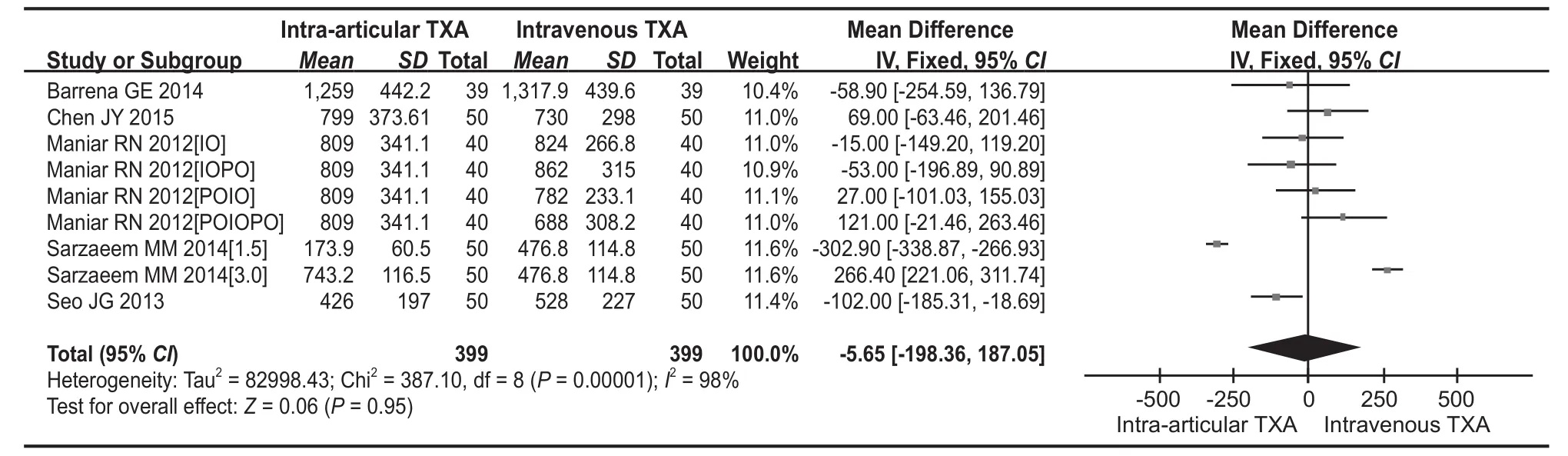
图4 关节腔内组与静脉组术后总失血量比较森林图Fig.4 Forest map of total blood loss between intra-articular and intravenous TXA
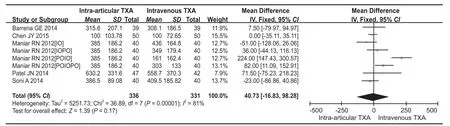
图5 关节腔内组与静脉组术后总引流量比较森林图Fig.5 Forest map of total drainage amount between intra-articular and intravenous TXA
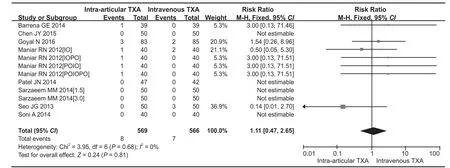
图6 关节腔内组与静脉组血栓栓塞发生率比较森林图Fig.6 Forest map of thromboembolic complication rate between intra-articular and intravenous TXA
讨 论
本研究结果显示,患者进行初次单侧 TKA 手术中,关节腔内应用 TXA 和静脉应用 TXA 后,患者在术中、术后的失血,输血需求和血栓栓塞并发症差异无统计学意义。
由于 TKA 手术范围较广,松质骨暴露面积大,骨面止血困难,以及手术创伤较大导致的局部纤维蛋白溶解活化等原因,TKA 可能导致显著的围术期出血。而在手术结束前,止血带释放导致进一步的局部纤维蛋白溶解[21]。TKA 围术期出血可达 1000~1500 ml,并且经常需要输血。失血和输血要求是TKA 的重要危险因素[22]。术后贫血可能是导致术后患者发生不良反应的重要问题,包括病死率和并发症发生率的增加[23],而输血通常可能伴有多种并发症甚至传播疾病。
TKA 围术期应用 TXA 的目的是减少术后出血和输血率。当静脉输注 TXA 时,TXA 可迅速而广泛的分布到整个细胞外基质和细胞内[24]。TXA 随后可迅速扩散到滑膜囊,直到 TXA 在滑液中的浓度达到血清浓度[25]。TXA 的常规生物活性半衰期为 3 h,在 24 h 内,90% 的关节液内的 TXA 将通过肾小球滤除[25],其在骨科手术中的应用已有报道。然而,越来越多的学者和手术医师开始关节腔内使用 TXA,与静脉应用相比,局部应用 TXA 的具有较少的吸收和较好的局部效应,提供最大化局部浓度和最小的全身吸收,并且给药次数更少,更易于术中、术后管理,并降低术后血栓发生率[13]。然而,仍然没有系统性数据表明,这种最小的全身吸收能降低血栓栓塞的发生率。
本研究结果显示,局部与静脉内应用 TXA 对失血量的影响类似,均可对围术期失血起到一定程度的控制作用。然而,评估失血量的各项数据始终存在显著的异质性,必须相对谨慎地对结果进行解释。除此之外,虽然并不存在显著性差异,最大 Hb下降值两组间差异 (P=0.10 ) 有向静脉组倾斜的趋势,这可能和已知的 TXA 具有剂量依赖性效应相关,不同的剂量,给药时间及频次可能是导致不同结果的原因[20,26]。对此,不同研究的随机对照试验也得出了不同的结论。Maniar 等[16]认为 PreO-IOPO 的 3 剂量 IV 方案产生最大有效减少引流量和总失血量。然而,Soni 等[20]进行的 RCT 发现了不同的结果。他们得出结论,局部 TXA 在 TKA 术中在减少失血方面与 3 次静脉内给药方案同样有效。为了澄清这个问题,仍然需要进一步获得更大样本的研究以确定 PreO-IO-PO 的静脉内应用方案是否优于局部应用。
对输血率指标而言,尽管数据同质性好,然而输血指征本身存在较大的变异性,因此报告的结果可能有所不同[15]。在纳入本研究的报告中,Maniar等[16]明确指出,共 38 例已达到该试验设计的输血指证,然而高达 12 例 ( 31.6% ) 患者拒绝接受输血。仍然认为评估 TXA 应用途径和剂量对围术期失血的疗效更应通过最大 Hb 下降值或总失血量指标,输血率由于其变异性大,对临床指导意义有限[15]。
理论上,TXA 具有增加血栓形成的风险,虽然这在临床上尚未得到证实,本研究结果未显示 DVT或 PE 的风险有所不同。本研究中,局部应用 TXA组共有 8 例 DVT 病例,静脉组中,也有 7 例报道。然而,由于 DVT 和 PE 筛查手段的不同,每组中均存在病例的不确定性。笔者认为,TKA 术后应常规评估所有患者双下肢 DVT 情况,必要时筛查 PE事件,然而绝大多数研究只评估了症状性 DVT 和PE。此外,由于所涉及的患者总数较少,也难以得出准确的结论。考虑到上述因素,对结果的解释仍须谨慎。
本研究存在明显的局限性。首先,在评估失血量的数据中始终存在显著的异质性。其次,由于缺乏相关数据,本研究不能解决最终患者生存质量的结果测量。尽管大多数试验已排除高风险患者 ( 例如:心血管疾病和肾功能障碍的患者 ),然而有学者认为 TXA 应用与心血管疾病相关[27],排除既往存在血栓性病史的患者也无法得出关于 TXA 安全性的结论。因此,应该谨慎地解释结果。
对现有证据的荟萃分析表明,与静脉 TXA 相比,局部 ( 关节腔内 ) 应用 TXA 的局部应用在减少失血和输血率方面具有类似的效果。若考虑到两种方案之间的类似效果和局部给药的优点,局部施用可能是更合理的选择。然而,仍需大样本量和更好设计的试验来建立 TXA 在初次单侧 TKA 应用的最佳方案。
[1]Huang ZY, Pei FX, Ma J, et al. Comparison of three different tourniquet application strategies for minimally invasive total knee arthroplasty: a prospective non-randomized clinical trial[J]. Arch Orthop Trauma Surg, 2014, 134(4):561-570.
[2]Callaghan JJ, O’Rourke MR, Liu SS. Blood management:issues and options[J]. J Arthroplasty, 2005, 20(4 Suppl 2):S51-54.
[3]Aglietti P, Baldini A, Vena LM, et al. Effect of tourniquet use on activation of coagulation in total knee replacement[J]. Clin Orthop Relat Res, 2000, (371):169-177.
[4]Alshryda S, Mason J, Vaghela M, et al. Topical (intra-articular)tranexamic acid reduces blood loss and transfusion rates following total knee replacement: a randomized controlled trial (TRANK)[J]. J Bone Joint Surg Am, 2013, 95(21):1961-1968.
[5]Henry DA, Carless PA, Moxey AJ, et al. Anti-fibrinolytic use for minimising perioperative allogeneic blood transfusion[J].Cochrane Database Syst Rev, 2011, (3):Cd001886.
[6]Benoni G, Carlsson A, Petersson C, et al. Does tranexamic acid reduce blood loss in knee arthroplasty[J]? Am J Knee Surg,1995, 8(3):88-92.
[7]Dahuja A, Dahuja G, Jaswal V, et al. A prospective study on role of tranexamic acid in reducing postoperative blood loss in total knee arthroplasty and its effect on coagulation profile[J].J Arthroplasty, 2014, 29(4):733-735.
[8]Camarasa MA, Olle G, Serra-Prat M, et al. Efficacy of aminocaproic, tranexamic acids in the control of bleeding during total knee replacement: a randomized clinical trial[J]. Br J Anaesth, 2006, 96(5):576-582.
[9]Kagoma YK, Crowther MA, Douketis J, et al. Use of antifibrinolytic therapy to reduce transfusion in patients undergoing orthopedic surgery: a systematic review of randomized trials[J]. Thromb Res, 2009, 123(5):687-696.
[10]Zhang H, Chen J, Chen F, et al. The effect of tranexamic acid on blood loss and use of blood products in total knee arthroplasty: a meta-analysis[J]. Knee Surg Sports Traumatol Arthrosc, 2012, 20(9):1742-1752.
[11]Raveendran R, Wong J. Tranexamic acid reduces blood transfusion in surgical patients while its effects on thromboembolic events and mortality are uncertain[J]. Evid Based Med, 2013, 18(2):65-66.
[12]Wong J, Abrishami A, El Beheiry H, et al. Topical application of tranexamic acid reduces postoperative blood loss in total knee arthroplasty: a randomized, controlled trial[J]. J Bone Joint Surg Am, 2010, 92(15):2503-2513.
[13]Chen JY, Chin PL, Moo IH, et al. Intravenous versus intraarticular tranexamic acid in total knee arthroplasty: A doubleblinded randomised controlled noninferiority trial[J]. Knee,2016, 23(1):152-156.
[14]Gomez-Barrena E, Ortega-Andreu M, Padilla-Eguiluz NG,et al. Topical intra-articular compared with intravenous tranexamic acid to reduce blood loss in primary total knee replacement: a double-blind, randomized, controlled,noninferiority clinical trial[J]. J Bone Joint Surg Am, 2014,96(23):1937-1944.
[15]Goyal N, Chen DB, Harris IA, et al. Intravenous vs intraarticular tranexamic acid in total knee arthroplasty: a randomized, double-blind trial[J]. J Arthroplasty, 2017, 32(1):28-32.
[16]Maniar RN, Kumar G, Singhi T, et al. Most effective regimen of tranexamic acid in knee arthroplasty: a prospective randomized controlled study in 240 patients[J]. Clin Orthop Relat Res, 2012, 470(9):2605-2612.
[17]Patel JN, Spanyer JM, Smith LS, et al. Comparison of intravenous versus topical tranexamic acid in total knee arthroplasty: a prospective randomized study[J]. J Arthroplasty,2014, 29(8):1528-1531.
[18]Sarzaeem MM, Razi M, Kazemian G, et al. Comparing efficacy of three methods of tranexamic acid administration in reducing hemoglobin drop following total knee arthroplasty[J].J Arthroplasty, 2014, 29(8):1521-1524.
[19]Seo JG, Moon YW, Park SH, et al. The comparative efficacies of intra-articular and IV tranexamic acid for reducing blood loss during total knee arthroplasty[J]. Knee Surg Sports Traumatol Arthrosc, 2013, 21(8):1869-1874.
[20]Soni A, Saini R, Gulati A, et al. Comparison between intravenous and intra-articular regimens of tranexamic acid in reducing blood loss during total knee arthroplasty[J].J Arthroplasty, 2014, 29(8):1525-1527.
[21]Benoni G, Lethagen S, Fredin H. The effect of tranexamic acid on local and plasma fibrinolysis during total knee arthroplasty[J]. Thromb Res, 1997, 85(3):195-206.
[22]Bierbaum BE, Callaghan JJ, Galante JO, et al. An analysis of blood management in patients having a total hip or knee arthroplasty[J]. J Bone Joint Surg Am, 1999, 81(1):2-10.
[23]Carson JL, Terrin ML, Jay M. Anemia and postoperative rehabilitation[J]. Can J Anaesth, 2003, 50(6 Suppl):S60-64.
[24]Nilsson IM. Clinical pharmacology of aminocaproic and tranexamic acids[J]. J Clin Pathol Suppl (R Coll Pathol), 1980,14:41-47.
[25]Ahlberg A, Eriksson O, Kjellman H. Diffusion of tranexamic acid to the joint[J]. Acta Orthop Scand, 1976, 47(5):486-488.
[26]Jang B, Kao M, Bohm MT, et al. Intra-articular injection of tranexamic acid to reduce blood loss after total knee arthroplasty[J]. J Orthop Surg (Hong Kong), 2014, 22(2):146-149.
[27]Martin K, Wiesner G, Breuer T, et al. The risks of aprotinin and tranexamic acid in cardiac surgery: a one-year follow-up of 1188 consecutive patients[J]. Anesth Analg, 2008, 107(6):1783-1790.
