中性粒细胞在肿瘤免疫中的研究进展*
2018-04-20何流漾戚春建
孙 晓 夏 蕾 何流漾 戚春建
(南京医科大学附属常州市第二人民医院中心实验室肿瘤研究所,常州 213000)
中性粒细胞是存在于肿瘤微环境中的免疫细胞之一,肿瘤的发生与发展,与肿瘤微环境密切相关。近年来越来越多的研究表明,中性粒细胞具有抗肿瘤和促肿瘤的双重作用,肿瘤微环境中的中性粒细胞可以分泌多种蛋白酶、活性氧及细胞因子,在肿瘤的发生发展、增殖、转移和血管生成等几个方面发挥着重要的作用。本文就近几年来中性粒细胞在肿瘤免疫中的作用、相关机制和研究进展进行综述。
1 中性粒细胞的来源及调控机制
中性粒细胞(Neutrophil)又被称之为多形核细胞(Polymorphonuclear leukocytes,PMNs),是机体中最多的白细胞,约占外周血白细胞总数的50% ~ 70%。作为机体固有免疫系统的重要组成部分,中性粒细胞是保护机体免受微生物感染、消除病原体的主要免疫细胞[1],是机体免于感染或炎症的首道防线[2]。中性粒细胞来源于骨髓中的造血干细胞,在骨髓中分化发育后进入血液或组织。中性粒细胞的主要功能表现为非特异性细胞免疫[3]。CD11b/LY6G是小鼠成熟中性粒细胞的生物学标记[4],当机体发生感染时,血液中的中性粒细胞在病原微生物的刺激下,局部释放细胞因子和趋化因子,使其聚集在炎症部位,发生脱颗粒,并释放出多种水解酶类,同时快速上调CD11b、CD16和CD45等膜受体[5],起到抗感染的效应。
2 中性粒细胞在肿瘤微环境中的生物学特性
越来越多的证据表明,在肿瘤发展的不同时期,中性粒细胞的表型和功能可以发生不同的极化(Polarization)。肿瘤发生的早期阶段,在不同细胞因子的作用下,肿瘤内中性粒细胞显示出抗肿瘤表型(N1型),其通过分泌细胞因子(IL-1β、TNF-α、IL-6和IL-12等)和免疫活化作用(作用于受损细胞的活性氧来产生炎症),非特异性的杀伤肿瘤细胞,从而抑制肿瘤的发生和发展[6,7]。如果在肿瘤早期使用抗LY6G的单克隆抗体清除肿瘤微环境中性粒细胞,可促进肿瘤细胞生长,抗体介导肿瘤免疫治疗的疗效显著降低[8];随着肿瘤进展,在肿瘤发生的中晚期阶段,中性粒细胞聚集于肿瘤基质,在肿瘤微环境细胞产生的生长因子作用下,发生表型和功能的改变,表现为促进肿瘤细胞增殖、迁移、侵袭和血管生成[9]。转化生长因子β (Transforming growth factor-β,TGF-β) 通过上调精氨酸酶1(Arginase1,ARG1)、趋化因子配体2[Chemokine (C-C motif)2,CCL2]、趋化因子配体5[Chemokine(C-C motif)5,CCL5]等表达,抑制其杀伤肿瘤细胞的效应,可以诱导肿瘤微环境中抗肿瘤的N1型中性粒细胞向N2 型极化,促进肿瘤生长及转移[10]。
3 中性粒细胞的抗肿瘤作用
有研究发现小鼠肺癌模型中,敲除TGF-β组相较对照组,N1型中性粒细胞大量浸润肿瘤组织,肿瘤生长缓慢,活化细胞毒性T淋巴细胞(Cytotoxic T lymphocytes,CTLs),抗肿瘤效应明显,表现为抗肿瘤的N1型[11]。中性粒细胞分泌髓过氧化物酶(Myeloperoxidase,MPO)和活性氧(Reactive oxygen species,ROS)、次氯酸(Hypochlorous acid,HOCl)等一些具有细胞毒性作用的介质[12],可直接杀伤肿瘤细胞。中性粒细胞也是抗体介导的肿瘤免疫治疗的重要效应细胞[13],抗体Fc段能与中性粒细胞表面的Fc受体(Fc receptor,FcR)相结合,诱导中性粒细胞释放细胞毒性介质,起到杀伤肿瘤细胞的作用[14]。在肺癌术后患者中,从癌旁组织分离的肿瘤相关中性粒细胞刺激T细胞增殖和干扰素-γ(Interferon-γ,IFN-γ)释放,中性粒细胞和活化T细胞之间的作用导致前者表面上的CD54、CD86、OX40L和4-1BBL共刺激分子显著上调,这一正反馈回路中增强了T细胞增殖,进而抑制肿瘤细胞的生存[15]。中性粒细胞可以与不同的细胞群体相互作用,通过直接的细胞毒活性针对肿瘤细胞发挥抗肿瘤活性,并通过广泛的释放介质(例如细胞因子、趋化因子和生长因子)募集和激活细胞适应性免疫系统,也可通过诱导单核细胞来源的树突状细胞(Dendritic cells,DC)和自然杀伤细胞(Natural killer cell,NK)的成熟,增强免疫应答[16]。综上所述,N1型中性粒细胞能够减弱肿瘤细胞的侵袭能力,减少肿瘤细胞的增殖作用[17],从而控制肿瘤生长和转移[18]。
4 中性粒细胞促肿瘤作用
近年来研究发现,中性粒细胞可以参与致癌过程的不同阶段,包括增强肿瘤细胞的增殖、迁移和侵袭[19],促进肿瘤血栓形成、介导肿瘤免疫抑制。表现为促肿瘤的N2型。
目前推测肿瘤微环境中N2型中性粒细胞促进肿瘤相关进展的可能机制包括以下几个方面。
4.1N2型中性粒细胞参与肿瘤的发生发展 N2型中性粒细胞可以通过释放活性氮(Reactive nitrogen species,RNS)、ROS或蛋白酶等促进肿瘤的发生[20]。弹性蛋白酶(Neutrophil elastase,NE)是N2型中性粒细胞颗粒蛋白分泌的一种丝氨酸蛋白酶。正常状态下,中性粒细胞释放的NE较少;当机体受到感染时,一氧化氮合酶(inducible nitric oxide synthase,iNOS)、TNF-α、IL-8等一些细胞因子可刺激中性粒细胞大量释放NE[21]。另外,钙调蛋白(Cadherin) 也可增强脂多糖(Lipopolysaccharide,LPS)诱导的NE释放,进而促进癌症的发生[22]。来自N2型中性粒细胞的NE与胰岛素受体底物-1(Insulin receptor substrate-1,IRS-1)结合后被内吞到肺癌细胞中,NE能够降解磷脂酰肌醇3-激酶(Phosphatidylinositol 3-kinase,PI3K)的抑制剂IRS-1,与PI3K 的调节亚基p85相结合激活PI3K,促进AKT磷酸化,激活该信号通路,进一步促进肿瘤细胞的增殖与生存[23]。N2型中性粒细胞可分泌趋化因子IL-8,IL-8通过募集中性粒细胞脱颗粒进入肿瘤微环境,诱导信号级联反应导致CD8+T细胞抗肿瘤效应降低[24-26]。N2型中性粒细胞还能通过产生ROS破坏DNA引起肿瘤细胞的无限增殖,中性粒细胞衍生的氧和氮衍生物负责DNA点突变并促进遗传不稳定性[27],来自中性粒细胞的髓过氧化物酶(Myeloperoxidase,MPO)催化氯离子和H2O2形成次氯酸(HOCl)激活基质金属蛋白酶(Matrix metalloproteinase,MMP)并灭活金属蛋白酶组织抑制剂(Tissue inhibitor of metalloproteinase,TIMP),导致肺上皮细胞DNA 损伤和突变,从而促进胞外基质(Extracellular matrix,ECM)重塑以及肺癌的发生[28]。
4.2N2型中性粒细胞参与肿瘤细胞的转移 N2型中性粒细胞分泌的趋化因子IL-8与肿瘤细胞表面的C-X-C 趋化因子受体2(C-X-C motif chemokine receptor 2,CXCR2)结合后,既能募集中性粒细胞进入肿瘤微环境,又能够促进肿瘤血管生成[29]。在小鼠肺微环境中移植具有不同肺转移潜力的人肾细胞癌(Renal cell carcinoma,RCC)细胞后,小鼠肺间质隔室的基因表达谱显示出富集中性粒细胞特异性功能的特征。该实验结果表明肿瘤微环境中,中性粒细胞分泌趋化因子募集中性粒细胞至肺组织,N2型中性粒细胞可促进肺组织中肿瘤细胞转移的发生[18]。体外实验表明,在头颈鳞癌(Head and neck cancer,HNSCC)模型中,磷酸化皮层蛋白(Cortactin)释放可溶性因子,募集N2型中性粒细胞到达肿瘤细胞中并促进其迁移。中性粒细胞浸润与Cortactin的表达相关,Cortactin是一种与细胞迁移和侵袭有关的肌动蛋白结合蛋白,Cortactin磷酸化也与来自喉癌患者肿瘤组织中的中性粒细胞浸润显著相关[30]。另有文章指出[31],通过延时视频显微镜观察N2型中性粒细胞对体外生长的胰岛素的胰腺癌细胞,显示中性粒细胞诱导胰腺肿瘤细胞的黏附。这种黏附是由于中性粒细胞释放的NE 能够介导E-钙黏蛋白(E-cadherin,E-cad)的降解,下调细胞中特异性siRNA的表达,显著增加了胰腺肿瘤细胞的迁移能力,导致中性粒细胞有助于侵袭性肿瘤生长。在对卵巢癌组织的检测中,也得到类似的结果,即NE诱导E-cad 蛋白表达下调,中性粒细胞促进肿瘤侵袭[32]。N2型中性粒细胞与胰腺癌和乳腺癌细胞-细胞的直接相互作用已被证明涉及肿瘤细胞上的细胞表面细胞间黏附分子-1(Intercellular adhesion molecule-1,ICAM-1)和中性粒细胞上的β-2-整联蛋白,中性粒细胞结合肿瘤细胞相关整合素并诱导肿瘤细胞上的ICAM-1聚集,激活肿瘤细胞迁移至肝脏[33]。在黑色素瘤模型中,亦发现N2型中性粒细胞上调表达β-2-整联蛋白,其与黑素瘤细胞表面表达的ICAM-1相互作用,通过中性粒细胞将肿瘤细胞携带到转移部位[34]。
4.3N2型中性粒细胞参与肿瘤血管生成 N2型中性粒细胞在肿瘤血管生成中具有重要作用[35],其介导多种血管生成因子的表达,如血管内皮生长因子-A(Vascular endothelial growth factor-A,VEGF-A)、前动力蛋白-2(Prokineticin-2,PROK-2)和MMP-9等[9]。有实验证实,肝癌相关中性粒细胞释放的MMP-9通过活化从ECM中释放VEGF-A,继而促进肿瘤新生血管形成[36]。N2型中性粒细胞分泌的趋化因子IL-8参与肿瘤血管的形成,促进肿瘤生长[18],在纤维肉瘤和前列腺癌的鼠模型中,阻断CXCL8/IL-8募集N2型中性粒细胞显著减少肿瘤血管生成、抑制肿瘤生长。肿瘤异种移植鼠模型中,在肿瘤细胞和基质细胞G-CSF影响下,N2型中性粒细胞释放的促血管生成分子Bv8能明显促进受损血管生成和肿瘤生长[37]。Galdiero等[37]还发现肝癌细胞刺激N2型中性粒细胞分泌肝细胞生长因子(HGF),HGF修饰肿瘤微环境,参与肿瘤血管生成,使肿瘤细胞变得更具侵袭性[7]。
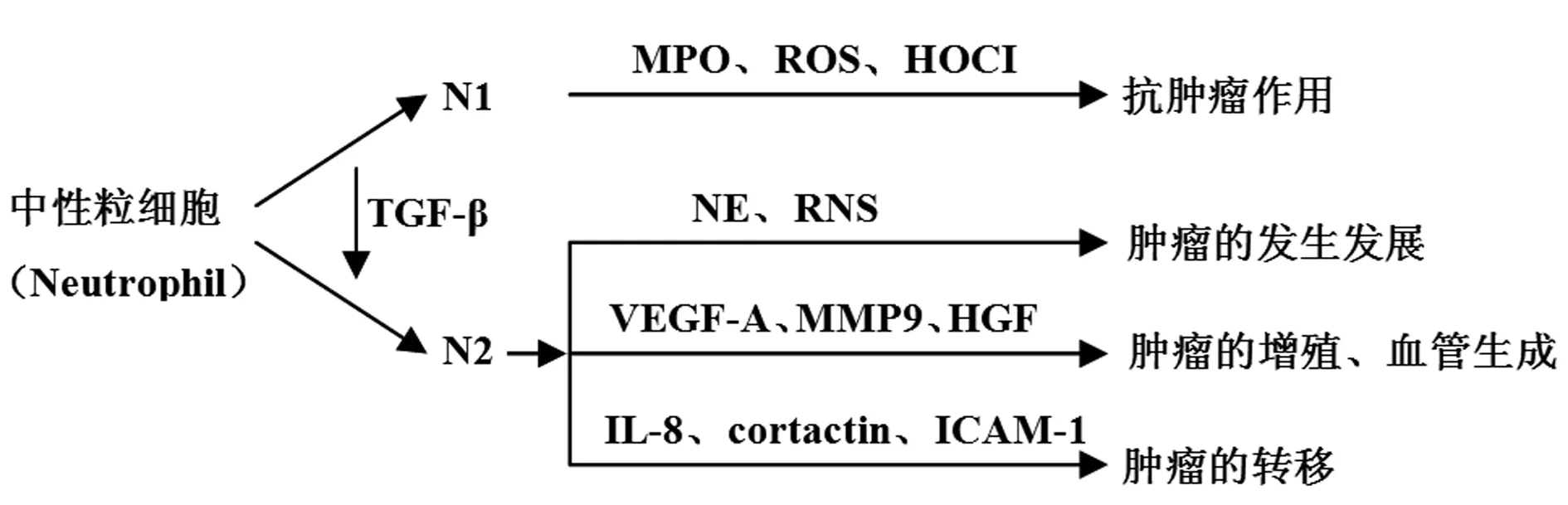
图1 中性粒细胞在肿瘤免疫中的作用Fig.1 Role of neutrophils in tumor immunology
5 结语
中性粒细胞在肿瘤微环境中具有双重作用。N1型中性粒细胞具有细胞毒性作用,产生抗肿瘤效应;N2型中性粒细胞可通过分泌各种细胞因子和趋化因子、NE、MMP-9及ROS等生物活性物质来促进肿瘤细胞发生发展,参与血管生成,增强肿瘤细胞侵袭与转移能力,产生促肿瘤效应(图1)。由于目前越来越多的研究表明中性粒细胞在肿瘤发生过程中具有两面性,但其具体的机制尚不清楚。更全面认识中性粒细胞可塑性的分子机制及两种类型的功能和标志,可以为抗肿瘤免疫和分子诊疗提供新靶标。总之,中性粒细胞是肿瘤发生发展的参与者,随着研究的不断深入,中性粒细胞及其相关因子有望为肿瘤治疗提供新的思路和方法。
参考文献:
[1] Jani PK,Schwaner E,Kajdacsi E,etal.Complement MASP-1 enhances adhesion between endothelial cells and neutrophils by up-regulating E-selectin expression [J].Mol Immunol,2016,75:38-47.
[2] Ling MR,Chapple IL,Matthews JB.Peripheral blood neutrophil cytokine hyper-reactivity in chronic periodontitis [J].Innate Immun,2015,21(7):714-725.
[3] Ella K,Csepanyi-Komi R,Kaldi K.Circadian regulation of human peripheral neutrophils [J].Brain Behav Immun,2016,57:209-221.
[4] Carlsen ED,Jie Z,Liang Y,etal.Interactions between neutrophils and leishmania braziliensis amastigotes facilitate cell activation and parasite clearance [J].J Innate Immun,2015,7(4):354-363.
[5] Vernon PJ,Paredes RM,Sooter AJ,etal.Severe hemorrhagic shock induces acute activation and expansion of IL-8+/IL-10+neutrophils with enhanced oxidative reactivity in non-human primates [J].Shock,2016,46(3 Suppl 1):129-136.
[6] 刘义庆,卢冰如,张炳昌,等.中性粒细胞的功能及其与自身免疫性疾病关联性研究进展 [J].中国免疫学杂志,2014,30(5):712-716.
Liu YQ,Lu BR,Zhang BC,etal.Research progresses of functions of neutrophils and the relationship between neutrophils and autoimmune diseases[J].Chin J Immunol,2014,30(5):712-716.
[7] Uribe-Querol E,Rosales C.Neutrophils in cancer:two sides of the same coin [J].J Immunol Res,2015,2015:983698.
[8] Albanesi M,Mancardi DA,Jonsson F,etal.Neutrophils mediate antibody-induced antitumor effects in mice [J].Blood,2013,122(18):3160-3164.
[9] Mishalian I,Bayuh R,Levy L,etal.Tumor-associated neutrophils (TAN) develop pro-tumorigenic properties during tumor progression [J].Cancer Immunol Immunother,2013,62(11):1745-1756.
[10] Piccard H,Muschel RJ,Opdenakker G.On the dual roles and polarized phenotypes of neutrophils in tumor development and progression [J].Crit Rev Oncol Hematol,2012,82(3):296-309.
[11] Fridlender ZG,Sun J,Kim S,etal.Polarization of tumor-associated neutrophil phenotype by TGF-beta:"N1" versus "N2" TAN [J].Cancer Cell,2009,16(3):183-194.
[12] Kadota K,Nitadori JI,Ujiie H,etal.Prognostic impact of immune microenvironment in lung squamous cell carcinoma:tumor-infiltrating CD10+Neutrophil/CD20+lymphocyte ratio as an independent prognostic factor [J].J Thorac Oncol,2015,10(9):1301-1310.
[13] Ning C,Li YY,Wang Y,etal.Complement activation promotes colitis-associated carcinogenesis through activating intestinal IL-1beta/IL-17A axis [J].Mucosal Immunol,2015,8(6):1275-1284.
[14] Wang W,Erbe AK,Hank JA,etal.NK cell-mediated antibody-dependent cellular cytotoxicity in cancer immunotherapy [J].Front Immunol,2015,6:368.
[15] Eruslanov EB,Bhojnagarwala PS,Quatromoni JG,etal.Tumor-associated neutrophils stimulate T cell responses in early-stage human lung cancer [J].J Clin Invest,2014,124(12):5466-5480.
[16] Sceneay J,Chow MT,Chen A,etal.Primary tumor hypoxia recruits CD11b+/Ly6Cmed/Ly6G+immune suppressor cells and compromises NK cell cytotoxicity in the premetastatic niche [J].Cancer Res,2012,72(16):3906-3911.
[17] Abe H,Morikawa T,Saito R,etal.In Epstein-Barr virus-associated gastric carcinoma a high density of CD66b-positive tumor-associated neutrophils is associated with intestinal-type histology and low frequency of lymph node metastasis [J].Virchows Arch,2016,468(5):539-548.
[18] Lopez-Lago MA,Posner S,Thodima VJ,etal.Neutrophil chemokines secreted by tumor cells mount a lung antimetastatic response during renal cell carcinoma progression [J].Oncogene,2013,32(14):1752-1760.
[19] Swierczak A,Mouchemore KA,Hamilton JA,etal.Neutrophils:important contributors to tumor progression and metastasis [J].Cancer Metastasis Rev,2015,34(4):735-751.
[20] Antonio N,Bonnelykke-Behrndtz ML,Ward LC,etal.The wound inflammatory response exacerbates growth of pre-neoplastic cells and progression to cancer [J].Embo J,2015,34(17):2219-2236.
[21] Tanaka Y,Ito S,Isobe K.Vancomycin-sensitive bacteria trigger development of colitis-associated colon cancer by attracting neutrophils [J].Sci Rep,2016,6:23920.
[22] Liang W,Ferrara N.The complex role of neutrophils in tumor angiogenesis and metastasis [J].Cancer Immunol Res,2016,4(2):83-91.
[23] Houghton AM,Rzymkiewicz DM,Ji H,etal.Neutrophil elastase-mediated degradation of IRS-1 accelerates lung tumor growth [J].Nat Med,2010,16(2):219-223.
[24] Zea AH,Rodriguez PC,Atkins MB,etal.Arginase-producing myeloid suppressor cells in renal cell carcinoma patients:a mechanism of tumor evasion [J].Cancer Res,2005,65(8):3044-3048.
[25] Rodriguez PC,Zea AH,Culotta KS,etal.Regulation of T cell receptor CD3zeta chain expression by L-arginine [J].J Biol Chem,2002,277(24):21123-21129.
[26] Rotondo R,Barisione G,Mastracci L,etal.IL-8 induces exocytosis of arginase 1 by neutrophil polymorphonuclears in nonsmall cell lung cancer [J].Int J Cancer,2009,125(4):887-893.
[27] Gungor N,Knaapen AM,Munnia A,etal.Genotoxic effects of neutrophils and hypochlorous acid [J].Mutagenesis,2010,25(2):149-154.
[28] Satpathy SR,Jala VR,Bodduluri SR,etal.Crystalline silica-induced leukotriene B4-dependent inflammation promotes lung tumour growth [J].Nat Commun,2015,6:7064.
[29] 王 健,韩忠燕,周 娜.CXCL8及其受体CXCR1、CXCR2在慢性乙肝患者外周血PMNs中的表达 [J].中国免疫学杂志,2015,31(3):375-379.
Wang J,Han ZY,Zhou N. Expression of CXCL8 and its receptors (CXCR1 and CXCR2) in peripheral blood neutrophils of chronic hepatitis B[J].Chin J Immunol,2015,31(3):375-379.
[30] Dumitru CA,Bankfalvi A,Gu X,etal.Neutrophils activate tumoral CORTACTIN to enhance progression of orohypopharynx carcinoma [J].Front Immunol,2013,4:33.
[31] Gaida MM,Steffen TG,Gunther F,etal.Polymorphonuclear neutrophils promote dyshesion of tumor cells and elastase-mediated degradation of E-cadherin in pancreatic tumors [J].Eur J Immunol,2012,42(12):3369-3380.
[32] Mayer C,Darb-Esfahani S,Meyer AS,etal.Neutrophil granulocytes in ovarian cancer-induction of epithelial-to-mesenchymal-transition and tumor cell migration [J].J Cancer,2016,7(5):546-554.
[33] Strell C,Lang K,Niggemann B,etal.Neutrophil granulocytes promote the migratory activity of MDA-MB-468 human breast carcinoma cells via ICAM-1 [J].Exp Cell Res,2010,316(1):138-148.
[34] Huh SJ,Liang S,Sharma A,etal.Transiently entrapped circulating tumor cells interact with neutrophils to facilitate lung metastasis development [J].Cancer Res,2010,70(14):6071-6082.
[35] Tazzyman S,Niaz H,Murdoch C.Neutrophil-mediated tumour angiogenesis:subversion of immune responses to promote tumour growth [J].Semin Cancer Biol,2013,23(3):149-158.
[36] Deryugina EI,Zajac E,Juncker-Jensen A,etal.Tissue-infiltrating neutrophils constitute the major in vivo source of angiogenesis-inducing MMP-9 in the tumor microenvironment [J].Neoplasia,2014,16(10):771-788.
[37] Galdiero MR,Garlanda C,Jaillon S,etal.Tumor associated macrophages and neutrophils in tumor progression [J].J Cell Physiol,2013,228(7):1404-1412.