XBP1/CHOP/Puma信号转导通路对高糖心肌细胞凋亡的作用研究
2018-04-20杨莉莉李俊毅邵海峰
王 丽 李 强 杨莉莉 李俊毅 邵海峰
(齐齐哈尔医学院附属第三医院心血管一科,齐齐哈尔 161000)
近年来,以糖尿病为主的代谢综合征成为影响人类健康的主要慢性疾病之一,据统计,预计到2030年全球糖尿病患者将达到4.5亿左右,其中糖尿病心肌病(Diabetic cardiomyopathy,DCM)的人数也相当可观[1,2]。糖尿病心肌病是指糖尿病患者在无其他因素引起心脏异常的情况下出现的心脏能量代谢或结构异常的一类疾病,其病理特征主要为心肌肥大、局灶性坏死和纤维化、小动脉内膜增厚等,发病率和死亡率在糖尿病心脏并发症中位于第二位[3]。心肌细胞的增殖、凋亡广泛参与DCM等心脑血管疾病的病理生理过程[4-6]。内质网应激是新近发现的细胞凋亡信号转导通路,X盒结合蛋白1(X-box binding protein 1,XBP1)是内质网应激的关键信号因子、参与蛋白质折叠和内质网合成的结构蛋白[7]。本实验通过RNA干扰XBP1的表达,探讨XBP1对高糖环境下心肌细胞增殖、凋亡的影响和作用机制,以期为DCM的治疗和诊断提供理论依据。
1 材料与方法
1.1实验材料 H9C2心肌细胞由齐齐哈尔医学院实验室保存,DMEM培养基、胎牛血清(Fatal bovine serum,FBS)均购自美国Gibco公司,XBP1 siRNA由上海吉玛制药技术有限公司合成并鉴定,转染试剂脂质体2000(Lipofectamine 2000)购自美国Invitrogen公司,CCK-8检测试剂盒、Annexin V/PI试剂盒、BCA蛋白浓度测定试剂盒均购自上海碧云天生物技术有限公司,一抗、辣根过氧化物酶标记的二抗均购自美国公司Santa Cruz等。
1.2方法
1.2.1细胞培养与处理 细胞培养:心肌细胞培养于DMEM培养基中,加入10%的FCS、100 U/ml青霉素、100 mg/ml链霉素,置于37℃、5%CO2的恒温培养箱中培养,待细胞融合度为70%~90%时使用0.25%的胰酶消化传代培养,取生长状态良好的细胞用于后续实验。
细胞处理:取对数期的细胞,胰酶消化成单细胞悬液,接种于六孔板上,每孔加入1×105个细胞,待细胞融合度达到80%~90%时,离心,弃去培养基,PBS缓冲液清洗,每孔加入10 μl脂质体Lipofectamine 2000,细胞中分别加入siRNA-XBP1(siRNA-XBP1组)、siRNA-NC(对照组),以β-actin为内参,蛋白免疫印迹(Western blot)检测XBP1蛋白的相对表达量。
高糖干预实验分为4组:低糖对照组(使用5.5 mmol/L 葡萄糖作用于细胞,LG组)、高糖刺激组(使用33.3 mmol/L葡萄糖作用于细胞,HG组)、高糖加siRNA-NC(使用XBP1 siRNA-NC预处理细胞24 h,使用33.3 mmol/L葡萄糖作用于细胞,HG+NC组)、高糖加XBP1-siRNA组(使用XBP1 siRNA预处理细胞24 h,使用33.3 mmol/L葡萄糖作用于细胞,HG+siRNA),各组细胞在培养箱中培养48 h。
1.2.2CCK-8检测细胞增殖情况 收集对数期细胞,每孔加入100 μl培养基调整细胞浓度为1×105个/孔,37℃、5%CO2孵育48 h,至细胞单层铺满孔底,每组5个复孔。每孔加入10 μl CCK-8溶液,细胞培养箱中继续孵育4 h,在450 nm测定吸光值(OD值),试验重复3次,计算细胞存活率。
1.2.3流式细胞术检测细胞凋亡率 胰酶处理细胞,转移至离心管内,离心,PBS缓冲液重悬细胞密度为(5~10)×105个/ml,取1 ml细胞置于新的离心管中,加入5 μl膜联蛋白-V(Annexin V)-FITC混合液和10 μl碘化丙啶(PI)染色液,轻轻振动混匀,避光,置于流式细胞仪中进行检测。
1.2.4Western blot 检测细胞中XBP1、CHOP、Puma、Caspase-3蛋白的表达 当细胞融合度达到80%~90%时,PBS缓冲液清洗细胞,离心,取上清,加入预冷的5 μl磷酸酶抑制剂、5 μl PMSF、1 μl蛋白酶抑制剂,静置30 min,15 000 r/min离心10 min,上清即为蛋白提取物,BCA法进行蛋白定量。配置10%的分离胶和5%的浓缩胶进行SDS-PAGE凝胶电泳,按照纤维垫-滤纸-凝胶-硝酸纤维素膜-滤纸-纤维垫的顺序安装转印夹层,进行转膜。转膜结束后,将硝酸纤维素膜置于5%脱脂奶粉封闭液中,室温下振荡2 h。加入一抗反应液,4℃孵育过夜,TBST洗膜液清洗3次,每次10 min;加入二抗,室温振荡2 h,TBST洗膜液清洗3次,每次10 min,反应结束后加入ECL化学发光显色,室温反应1 min,暗室中曝光1~2 min,分别浸入显影液和定影液中30 s,试验重复3次,使用Quantity One 软件进行统计分析,蛋白的相对含量为目的蛋白OD值/β-actin OD值。

2 结果
2.1Western blot检测XBP1蛋白的表达量 Western blot检测转染后细胞中XBP1 蛋白的表达量,结果如图1、表1所示,对照组和siRNA-XBP1组细胞中XBP1蛋白的表达量分别为(0.859±0.091)、(0.283±0.059)。与对照组相比,siRNA-XBP1组细胞中XBP1蛋白的表达量明显下降(t=9.199,P<0.05),说明XBP1 siRNA能够有效降低XBP1的表达。
2.2CCK-8检测细胞增殖情况 各组细胞的增殖情况如表2所示,LG组、HG组、HG+NC组、HG+siRNA组细胞的存活率分别为(100.25±10.036)%、(60.413±7.526)%、 (62.891±7.796)%、 (80.107±6.058)%;与LG组相比, HG组、HG+NC组、HG+siRNA组细胞的存活率均显著降低(t1=5.500,P1=0.005,t2=5.092,P2=0.007,t3=2.976,P3=0.041);与HG组相比,HG+NC组细胞的存活率无显著差异(t=0.396,P=0.712),但HG+siRNA组细胞的存活率明显升高(t=3.531,P=0.024)。
2.3流式细胞术检测细胞的凋亡情况 各组细胞的凋亡情况如图2、表3所示,LG组、HG组、HG+NC组、HG+siRNA组细胞的凋亡率分别为(9.963±1.534)%、(48.563±5.398)%、(46.279±6.243)%、(20.489±3.421)%;与LG组相比,HG组、HG+NC组、HG+siRNA组细胞的凋亡率均显著升高(t1=11.914,P1=0.000,t2=9.784,P2=0.001,t3=4.863,P3=0.008);与HG组相比,HG+NC组细胞的凋亡率无显著差异(t=0.479,P=0.657),但HG+siRNA组细胞的凋亡率明显降低(t=7.609,P=0.002)。
2.4Western blot 检测细胞中XBP1、CHOP、Puma、Caspase-3蛋白的表达 结果如表4、图3所示,LG组、HG组、HG+NC组、HG+siRNA组细胞中XBP1蛋白的表达量分别为(0.246±0.051)、(0.859±0.047)、(0.843±0.086)、(0.423±0.072);C/EBP同源蛋白(C/EBP homologous protein,CHOP)的表达量分别为(0.195±0.056)、(0.762±0.083)、(0.724±0.060)、(0.480±0.061);p53上调凋亡调控因子(p53 upregulated modulator of apoptosis,Puma)的表达量分别为(0.153±0.025)、(0.642±0.051)、(0.651±0.073)、(0.450±0.058);半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)蛋白的表达量分别为(0.134±0.042)、(0.601±0.013)、(0.620±0.042)、(0.306±0.060)。与LG组相比,HG组、HG+NC组、HG+siRNA组细胞中XBP1(t1=15.309,P1=0.000,t2=10.342,P2=0.001,t3=3.475,P3=0.026)、CHOP(t1=9.809,P1=0.001,t2=11.164,P2=0.000,t3=5.961,P3=0.004)、Puma(t1=14.912,P1=0.000,t2=11.179,P2=0.000,t3=8.145,P3=0.001)、Caspase-3(t1=18.398,P1=0.000,t2=14.172,P2=0.000,t3=4.068,P3=0.015) 的表达量均显著增加;与HG组相比,HG+NC组细胞中XBP1、CHOP、Puma、Caspase-3的表达量没有明显变化(t1=0.282,P1=0.791,t2=0.643,P2=0.555,t3=0.175,P3=0.870,t4=0.749,P4=0.796),但HG+siRNA组细胞中XBP1、CHOP、Puma、Caspase-3的表达量显著降低(t1=8.783,P1=0.001,t2=4.742,P2=0.009,t3=4.306,P3=0.013,t4=8.323,P4=0.001)。

图1 siRNA干扰细胞中XBP1蛋白的表达量Fig.1 Expression of XBP1 protein in siRNA interfe-ring cells
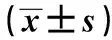
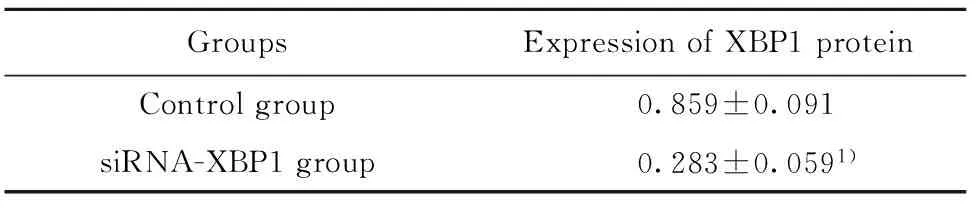
GroupsExpressionofXBP1proteinControlgroup0.859±0.091siRNA-XBP1group0.283±0.0591)
Note:Compared with the control group,1)P<0.05.
表2XBP1siRNA对高糖处理的心肌细胞存活率的影响
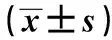
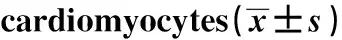
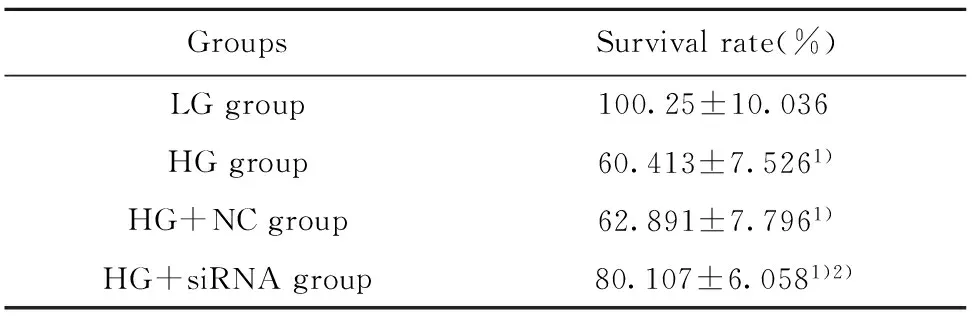
GroupsSurvivalrate(%)LGgroup100.25±10.036HGgroup60.413±7.5261)HG+NCgroup62.891±7.7961)HG+siRNAgroup80.107±6.0581)2)
Note:Compared with the LG group,1)P<0.05;compared with the HG group,2)P<0.05.
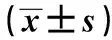

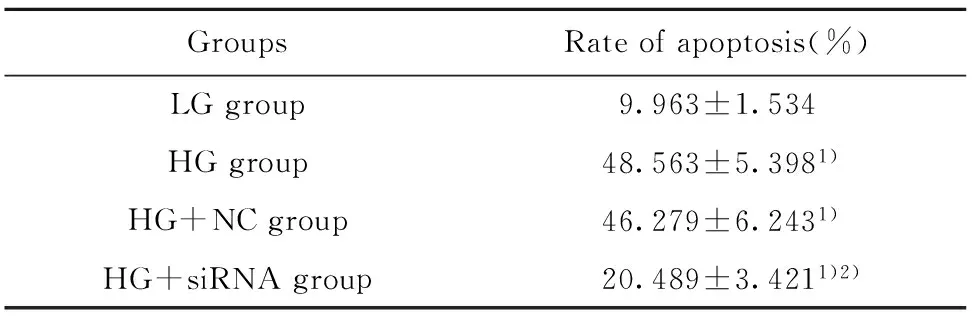
GroupsRateofapoptosis(%)LGgroup9.963±1.534HGgroup48.563±5.3981)HG+NCgroup46.279±6.2431)HG+siRNAgroup20.489±3.4211)2)
Note:Compared with the LG group,1)P<0.05;compared with the HG group,2)P<0.05.
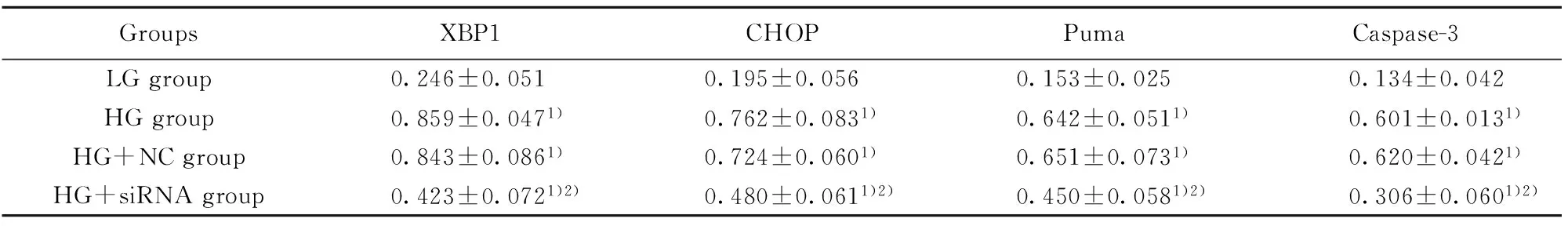
GroupsXBP1CHOPPumaCaspase-3LGgroup0.246±0.0510.195±0.0560.153±0.0250.134±0.042HGgroup0.859±0.0471)0.762±0.0831)0.642±0.0511)0.601±0.0131)HG+NCgroup0.843±0.0861)0.724±0.0601)0.651±0.0731)0.620±0.0421)HG+siRNAgroup0.423±0.0721)2)0.480±0.0611)2)0.450±0.0581)2)0.306±0.0601)2)
Note:Compared with the LG group,1)P<0.05;compared with the HG group,2)P<0.05.
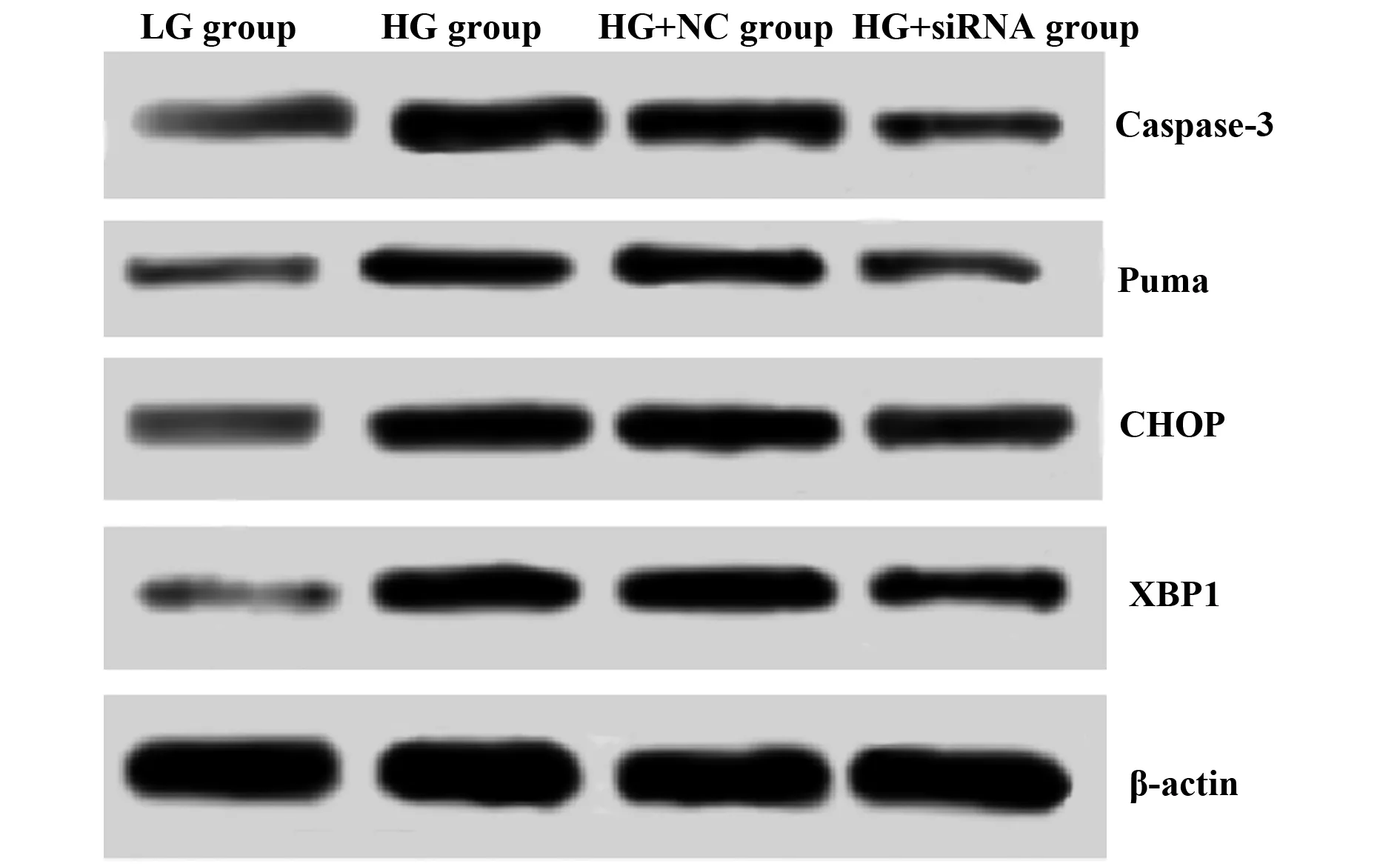
图3 心肌细胞XBP1、CHOP、Puma、Caspase-3蛋白的表达Fig.3 Expression of XBP1,CHOP,Puma and Caspase-3 proteins in cardiomyocytes
3 讨论
糖尿病心肌病已被认为是一个独立的、特异的心肌疾病。在糖尿病各种并发症中,细胞的增殖、凋亡异常将导致心功能严重受损[8]。高血糖症是诱发糖尿病并发心血管疾病的重要因素之一。有研究表明,67.1%的糖尿病并发心血管患者均伴有血脂异常[9]。因此有必要研究高糖状态下心肌细胞凋亡的分子机制。内质网应激(Endoplasmic reticulum stress,ERS)和未折叠蛋白质反应(Unfolded protein response,UPR)是细胞内重要的凋亡信号通路[10]。XBP1是ERS的重要调节因子,当受到应激时即被活化,激活多条信号通路发挥作用[11]。文献报道,当细胞受到应激时,激活UPR信号通路,从而使XBP1被活化转移至细胞核中,调控UPR下游靶基因及多种信号因子的表达,调节疾病的发生、发展[12]。研究表明下调XBP1的表达量会导致相关下游靶基因的表达量降低,参与新血管生成、能量代谢、细胞的增殖和凋亡等过程[13]。在DCM的病程中,高血糖、氧化应激等因素均可诱发ERS和UPR,从而导致心肌细胞的增殖受到抑制,凋亡率增加。然而在这一过程中,XBP1对心肌细胞增殖、凋亡的影响及作用机制的相关报道较少。所以本实验通过RNA干扰XBP1在高糖环境下的心肌细胞的表达量,观察其表达量对心肌细胞增殖和凋亡的影响。结果显示siRNA-XBP1可降低心肌细胞中XBP1的表达量;高糖环境可抑制细胞的增殖,诱导其凋亡,但XBP1的表达量降低可缓解高糖促进细胞凋亡的作用。
CHOP也称为GADD153,是ERS调控的凋亡信号通路中的关键因子之一,当发生ERS反应时,受转录因子调控,表达水平增加,从而调节凋亡相关基因表达介导细胞凋亡[10]。研究发现,当细胞α-细辛醚处理细胞时可激活ERS,调节ERS下游靶基因CHOP的表达从而诱导细胞的凋亡[14]。有文献报道在心肌细胞中,CHOP的表达量升高激活心肌细胞凋亡途径抑制其增殖[15]。Puma是促凋亡基因,对细胞凋亡、增殖起重要作用。有研究表明,Puma为CHOP下游靶基因,发挥促进细胞凋亡的作用[16]。在线粒体内膜上,Puma与Bcl-2或者Bax结合,增强线粒体膜的通透性,释放细胞因子,诱导Caspase级联反应,促进细胞凋亡。研究证明,丙烯醛可提高Puma的表达量,裂解Bid,从而诱导Caspase-3的活化,促进细胞凋亡[17]。Caspase-3是Caspase蛋白家族的成员之一,是细胞凋亡过程中的剪切酶。
Caspase-3可通过与底物结合,降解下游底物,从而促进细胞凋亡。研究报道当机体受到异常刺激时,通过升高Caspase-3的表达量,从而促进细胞的凋亡,抑制其增殖[18-20]。本实验检测了siRNA干预XBP1和高糖环境下心肌细胞中XBP1、CHOP、Puma、Caspase-3的含量,发现高糖环境可使XBP1、CHOP、Puma、Caspase-3蛋白表达量升高,但XBP1表达量降低可抑制高糖促进XBP1、CHOP、Puma、Caspase-3蛋白表达量升高,且CHOP、Puma的表达量随着XBP1的降低而降低,表明高糖环境下,激活ERS,但XBP1表达量降低可降低高糖激活ERS的作用,其作用机制是通过调控XBP1/CHOP/Puma信号通路从而促进心肌细胞的凋亡。
总之,RNA干扰XBP1的表达可抑制高糖环境下心肌细胞的凋亡,促进其增殖,防止糖尿病心肌病的恶化,其作用机制是通过调节XBP1/CHOP/Puma信号通路发挥作用。
参考文献:
[1] Liew A,O′Brien T.The potential of cell-based therapy for diabetes and diabetes-related vascular complications[J].Current Diabetes Rep,2014,14(3):1-11.
[2] Bugger H,Abel ED.Molecular mechanisms of diabetic cardiomyopathy[J].Diabetologia,2014,57(4):660-671.
[3] Trachanas K,Sideris S,Aggeli C,etal.Diabetic cardiomyopathy:from pathophysiology to treatment[J].Hellenic J Cardiol,2014,55(5):411.
[4] Zhou W,Yuan J.Necroptosis in health and diseases[J].Semin Cell Developmental Biol,2014,35(1):14-23.
[5] Zhao H,Jaffer T,Eguchi S,etal.Role of necroptosis in the pathogenesis of solid organ injury[J].Cell Death Disease,2015,6(11):e1975.
[6] Luedde M,Lutz M,Carter N,etal.RIP3,a kinase promoting necroptotic cell death,mediates adverse remodelling after myocardial infarction[J].Cardiovascular Res,2014,103(2):206-216.
[7] 吴婷婷,魏庆庆,严宇鹏,等.缬沙坦通过下调X-盒结合蛋白1表达抑制糖尿病心肌病大鼠心肌细胞凋亡[J].中国循环杂志,2014,29(10):836-840.
Wu TT,Wei QQ,Yan YP,etal.Valsartan inhibits cardiomyocyte apoptosis in diabetic cardiomyopathy by down-regulating the expression of X-box binding protein 1[J].China Circulation J,2014,29(10):836-840.
[8] Berezin AE,Kremzer AA,Samura TA,etal.Predictive value of apoptotic microparticles to mononuclear progenitor cells ratio in advanced chronic heart failure patients[J].J Cardiol,2015,65(5):403-411.
[9] Yan L,Xu MT,Yuan L,etal.Prevalence of dyslipidemia and its control in type 2 diabetes:A multicenter study in endocrinology clinics of China[J].J Clin Lipidol,2016,10(1):150-160.
当然,女贪官腐败还有诸多其他动机,例如侥幸心理、补偿心理、攀比心理等。笔者认为,侥幸心理只是上述投机心理的别样称呼,基于不平衡心理而生的补偿心理只是一种自我报偿心理,仍不出“报偿”的范畴,而攀比心理看似 “趋寡”实为“追风”,只是对“从众”的表面偏离,仍属从众心理的范畴,故于此不再论述。
[10] 丁 娟,纪璐璐,徐亚廷,等.高糖诱导滋养层细胞内质网应激及凋亡[J].中国组织化学与细胞化学杂志,2016,25(1):13-17.
Ding J,Ji Y,Xu YT,etal.High glucose-induced trophoblast cell endoplasmic reticulum stress and apoptosis [J].Chin J Histochem Cytochem, 2016,25(1): 13-17.
[11] 王 琼,邵耀明,耿先龙,等.X盒结合蛋白 1 在高迁移率族蛋白 B1 诱导内皮细胞凋亡中的作用[J].中国动脉硬化杂志,2015,23(1):33-36.
Wang Q,Shao YM,Zhai XL,etal.The role of X-box binding protein 1 in the induction of endothelial cell apoptosis induced by high mobility group box protein B1[J].Chin J Arteriosclerosis,2015,23(1): 33-36.
[12] Wang S,Kaufman RJ.The impact of the unfolded protein response on human disease[J].J Cell Biol,2012,197(7):857-867.
[13] 倪守华,岳晓龙.XBP-1 在肿瘤发生发展中的研究进展[J].实用肿瘤学杂志,2017,31(1):65-68.
Ni SH,Yue XL,Wu J,etal.Research progress of XBP-1 in tumorigenesis and development[J].J Practical Oncol ,2017,31(1): 65-68.
[14] 王白燕,韩倩倩,朱艳琴,等.GRP78,CHOP 在 α-细辛醚诱导的 Eca109 细胞凋亡中的作用[J].郑州大学学报:医学版,2017,52(2):109-112.
[15] 李军汉,苏全生,孙君志,等.运动和饮食调整对内质网应激介导非酒精性脂肪肝大鼠模型肝细胞凋亡的影响[J].中国运动医学杂志,2017,36(1):36-43.
Li JH,Su QS,Sun JZ,etal.Effects of exercise and dietary adjustment on hepatocyte apoptosis induced by endoplasmic reticulum stress in a rat model of non-alcoholic fatty liver disease[J].Chin J Sports Med ,2017,36(1): 36-43.
[16] 王 琪,段冷昕.内质网应激中 GRP78 和 ATF4-CHOP-Puma 信号通路与帕金森病的关系及其治疗靶点的研究进展[J].神经药理学报,2013,3(3):19-26.
Wang Q,Duan LQ.Research progress in the relationship between GRP78 and ATF4-CHOP-Puma signal pathway and Parkinson′s disease and its therapeutic target in endoplasmic reticulum stress[J].J Neuropharmacol,2013,3(3):19-26.
[17] 刘 贺,曾常茜.透骨草提取物对人肺癌A549细胞凋亡及其PUMA/Bcl-2/Caspase-3蛋白表达的影响[J].中国中医药科技,2017,24(1):38-40.
Liu H,Zeng CB.Effects of extract of speranskia on apoptosis and expression of PUMA/Bcl-2/Caspase-3 protein in human lung cancer A549 cells[J].Chin Med Technol,2017,24(1):38-40.
[18] Kabeer FA,Sreedevi GB,Nair MS,etal.Isodeoxyele-phantopin from Elephantopus scaber ( Didancao) induces cell cycle arrest and caspase-3-mediated apoptosis in breast carcinoma T47D cells and lung carcinoma A549 cells[J].Chin Med,2014,9(1):14.
[19] Wang N,Wang W,Huo P,etal.Mitochondria-mediated apoptosis in human lung cancer A549 cells by 4-Methylsulfinyl-3-butenyl isothiocyanate from radish seeds[J].Asian Pac J Cancer Prev,2014,15(5):2133-2139.
[20] Jiang RY,Pei HL,Gu WD,etal.Autophagic inhibitor attenuates rapamycin-induced inhibition of proliferation in cultured A549 lung cancer cells[J].Europ Rev Med Pharmacological Sci,2014,18(6):806-810.