闽江河口芦苇与短叶茳芏空间扩展植物-土壤系统硫含量变化特征
2018-04-19孙志高李家兵范爱连
何 涛,孙志高,*,李家兵,高 会,范爱连
1 福建师范大学地理研究所,湿润亚热带生态地理过程教育部重点实验室,福州 350007 2 福建师范大学环境科学与工程学院,福州 350007
1 研究区概况与研究方法
1.1 研究区概况
闽江河口湿地地处中亚热带和南亚热带过渡区,气候暖热潮湿,雨热同期,年均气温19.3℃,年均降水量约1380mm。河口区地势低平,感潮段可延伸至福州市区,河口潮流涨落具有周期性变化,发育有良好的湿地生态系统。本研究选取的鳝鱼滩湿地是闽江河口最大的一块湿地(图1),土壤类型属滨海盐土,由于其特殊地理位置和区域环境,区内植物种类繁多。闽江河口共有维管束植物72科175属247种,包括沙生植被、浅水植被、沼泽植被等,其中湿地植被群落由陆向海整体呈条带状分布。
1.2 样地布设与样品采集
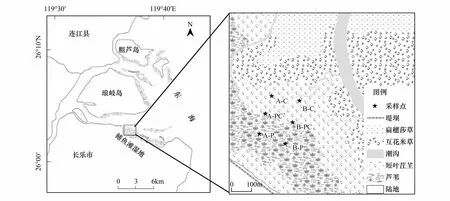
图1 湿地位置及采样点示意图Fig.1 Sketch of the marsh position and sampling sitesA,B分别表示两条样带; P:芦苇(P. Australis); PC:芦苇-短叶茳芏群落的交错带(P. Australis-C. Malaccensis); C:短叶茳芏(C. Malaccensis)
2015年7月,采用定位研究方法,在闽江入海口鳝鱼滩湿地的西北部,选择纯芦苇群落(P.australis,记为P)、纯短叶茳芏群落(C.malaccensis,记为C)以及两种植物空间扩展过程中形成的交错带群落(P.australis-C.malaccensis,记为PC;P′C和PC′分别表示交错带中的芦苇和短叶茳芏)为研究对象,选取水平相距100m的A、B两条样带作为重复样地(图1)。地上生物量采用收获法,在每个样地内随机选取3个50cm×50cm的样方,用剪刀沿地面割下植物地上部分,带回实验室。地下生物量采用挖掘法,将样方内植物根系全部挖出。采用土壤柱状采样器进行不同样地土壤样品的采集,采集深度为60cm(每10cm一层),每个样地采集3个柱状样作为重复,共108个样品。
1.3 样品处理与测定
将采集的植物样品在实验室内分离为根、茎、叶、鞘和立枯体,待清洗干净后放入烘干箱中杀青烘干,称量后磨碎装袋待测。将土壤样品于实验室自然风干,去除杂物研磨过100目筛后装袋待测。植物和土壤样品采集的同时,采用HACH—sensION3和ECTestr11+原位测定不同样地土壤的pH和电导率(Electrical Conductivity)。土壤和植物的TS(Total sulfur)及TN(Total nitrogen)含量采用Vario EL型元素分析仪测定,土壤有机质采用水合热重铬酸钾氧化—比色法[16],土壤粒度采用Master Sizer 2000激光粒度分析仪测定,按照国际制分类[17]。
1.4 相关指标计算
1.4.1植物硫累积系数(AFS:Accumulation Factor of sulfur)[7]:
AFS=PS/SS
式中,PS表示植物器官中的TS含量(mg/g),SS表示土壤中的TS含量(mg/g)。
1.4.2土壤硫储量TS(kg/m2)[7]:
式中,TSi表示第i层土壤硫库储量(kg/m2),dvi表示第i层土壤容重(g/cm3),Si表示第i层土壤剖面全硫含量(mg/g),hi表示土壤剖面深度(cm)。
1.5 数据处理与分析
运用Origin 9.0软件对土壤、植物和环境因子数据进行作图、计算和单因素方差分析,采用SPSS 17.0软件对土壤TS含量和环境因子数据进行主成分分析和逐步线性回归分析。
2 结果与分析
2.1 空间扩展过程中植被生态特征
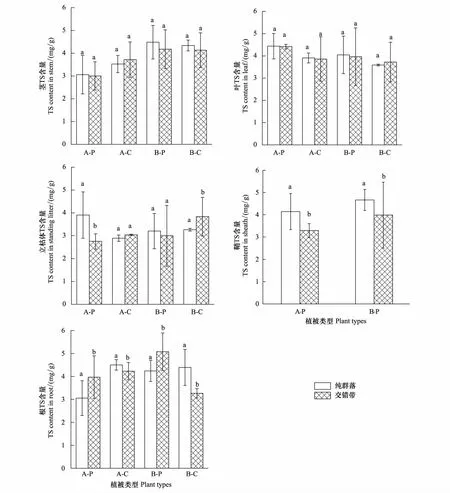
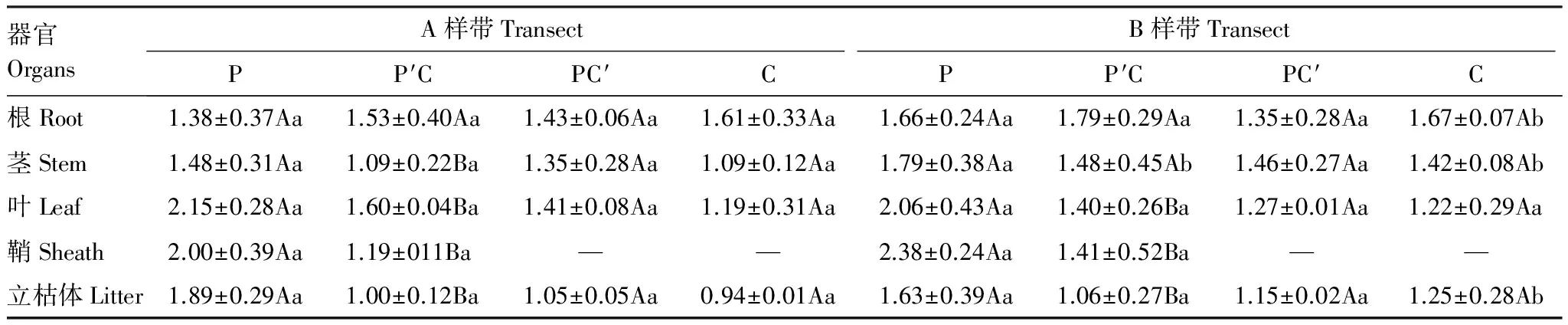
研究表明,芦苇与短叶茳芏的不同生态特征在空间扩展过程中均发生了明显改变(表1)。相对于纯芦苇群落,两条样带上交错带中芦苇群落的株高(PA-P=0.036)和生物量(PA-P=0.013;PB-P=0.020)均显著降低,而密度均显著增加(PA-P=0.022;PB-P=0.006),增幅分别为88.23%和56.52%。与之相比,交错带中短叶茳芏群落的株高较纯群落而言略有增加且其在B样带上存在显著差异(PB-P=0.027),而密度(PA-P=0.009;PB-P=0.002)和生物量(PA-P=0.014;PB-P=0.010)在两条样带上较纯群落均存在较大幅度降低。另外,A、B样带上交错带中芦苇群落及短叶茳芏群落的根冠比均高于相应的纯群落。两种植物在空间扩展过程中因竞争作用亦改变了二者的生物量分配格局(图2)。A、B样带上交错带中芦苇及短叶茳芏的茎生物量分配比均低于相应的纯群落,根分配比则较相应纯群落分别增加10.1%和48.89%。不同的是,两条样带上交错带中芦苇立枯体的分配比较纯群落增加明显(平均增幅达117.7%),而交错带中短叶茳芏立枯体的分配比较纯群落略有降低。
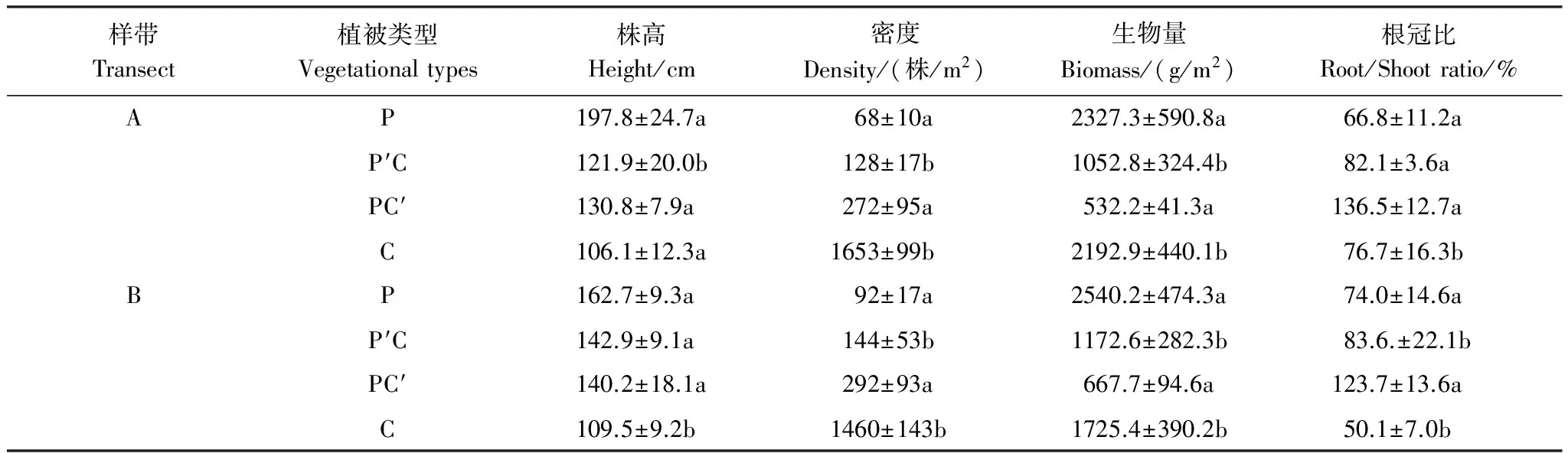
表1 芦苇与短叶茳芏空间扩展过程中植被生态特征
a,b表示同一样带相同植被生态指标在纯群落和交错带间的差异, 字母不同表示二者在P<0.05水平上差异显著; P:芦苇(P.Australis); P′C:芦苇—短叶茳芏群落中的芦苇(TheP.AustralisinP.Australis-C.Malaccensis); P′C:芦苇-短叶茳芏群落中的短叶茳芏(TheC.malaccensisinP.Australis-C.Malaccensis); C:短叶茳芏(C.Malaccensis)
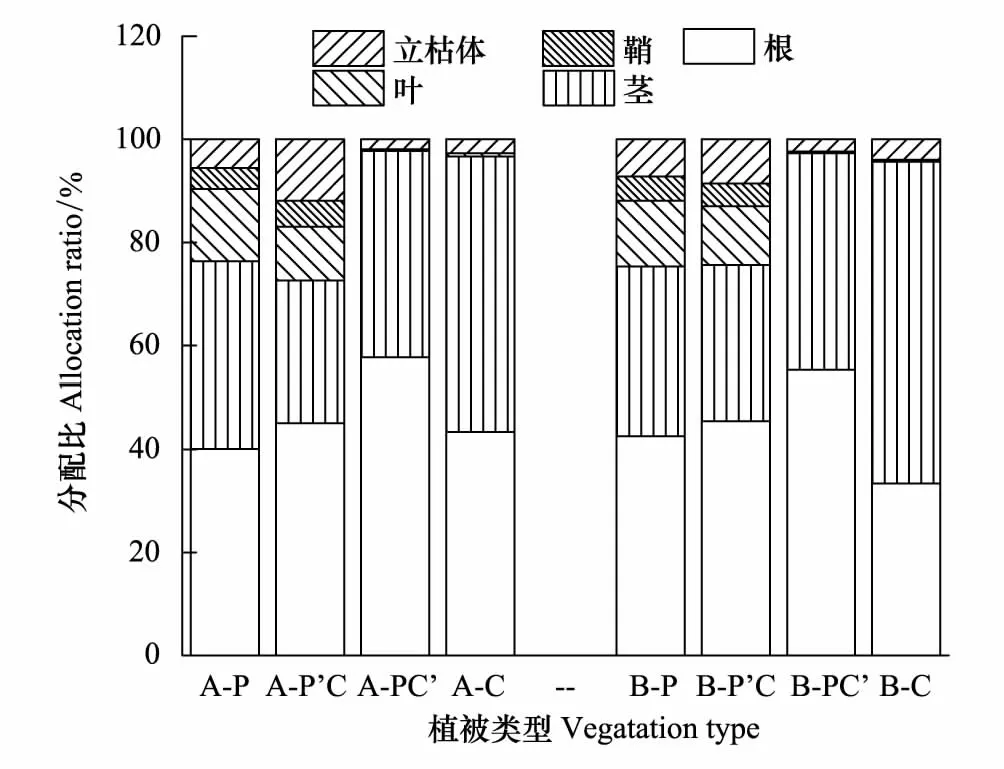
图2 不同湿地植被生物量分配比 Fig.2 Allocation ratios of plant biomass in different marshesA,B分别表示两条样带; P:芦苇(P. Australis); P′C:芦苇-短叶茳芏群落中的芦苇(The P. Australis in P. Australis-C. Malaccensis); P′C:芦苇-短叶茳芏群落中的短叶茳芏(The C. malaccensis in P. Australis-C. Malaccensis); C:短叶茳芏(C. Malaccensis)
2.2 空间扩展过程中土壤硫分布特征
2.2.1 土壤TS含量分布
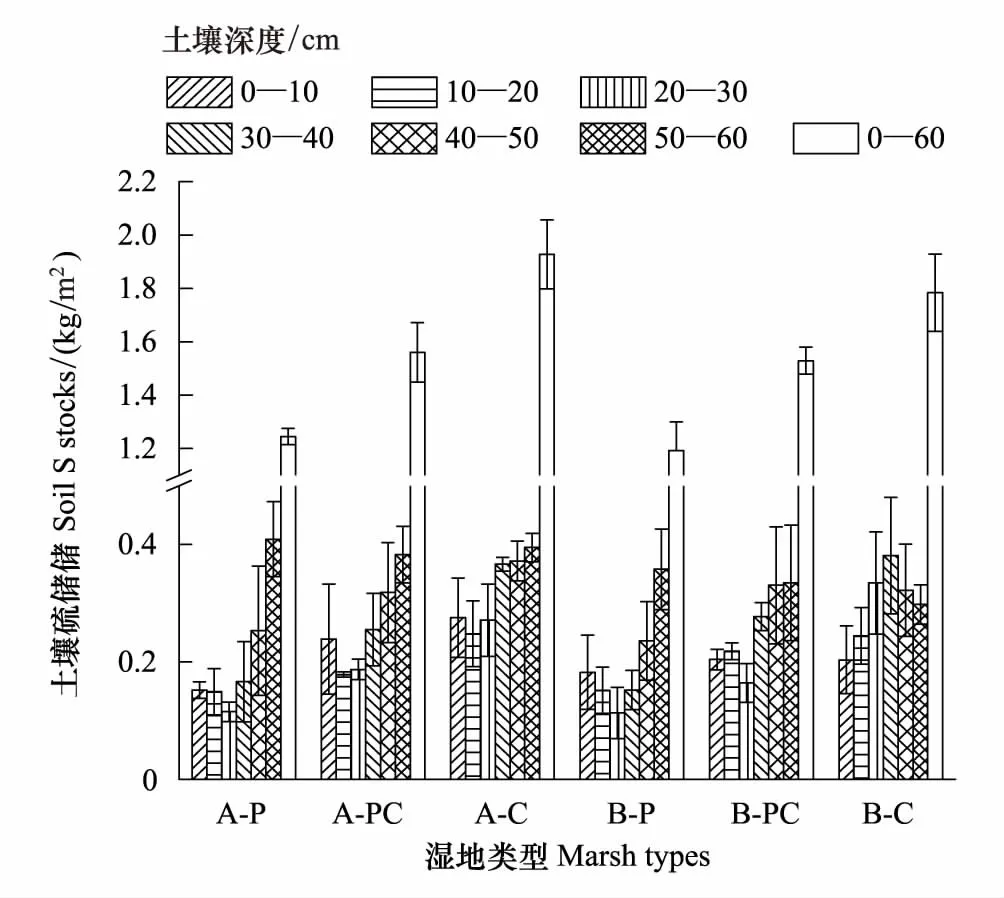
图3 不同湿地土壤总硫(TS)含量分布Fig.3 Distribution of TS (Total Sulfur) contents in the profile of different marshes
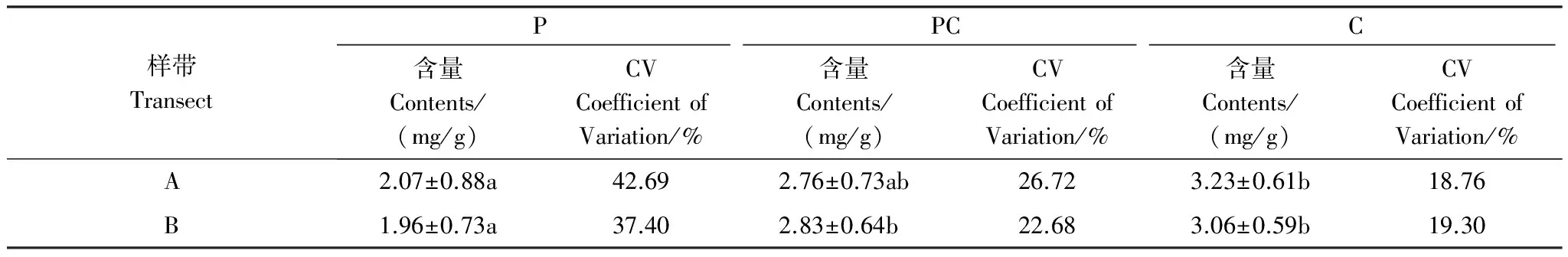
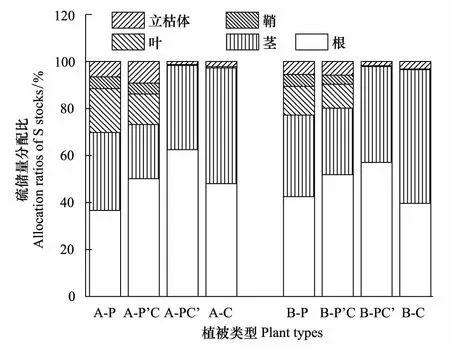
芦苇湿地、短叶茳芏湿地以及二者交错带湿地土壤的TS含量空间分异明显(图3)。水平方向上,A、B两条样带0—10cm土层的TS含量均表现为交错带湿地>短叶茳芏湿地>芦苇湿地,且芦苇湿地与交错带湿地的TS含量差异达到显著水平(PA=0.022;PB=0.037)。与之不同,10—40cm不同土层的TS含量在两条样带上均表现为短叶茳芏湿地>交错带湿地>芦苇湿地,且A、B样带上芦苇湿地与短叶茳芏湿地诸土层的TS含量(P=0.016)以及B样带上交错带湿地与短叶茳芏湿地20—30cm(P=0.009)和30—40cm(P=0.024)土层的TS含量均存在显著差异,但3种湿地10—20cm土层的TS含量并不存在显著差异(P>0.05)。40—60cm土层中,A样带上芦苇湿地与交错带湿地(P=0.026)以及芦苇湿地与短叶茳芏湿地(P=0.010)40—50cm土层的TS含量均存在显著差异,而B样带上芦苇湿地与交错带湿地40—50cm(P=0.018)和50—60cm(P=0.046)土层的TS含量均存在显著差异。尽管3种湿地不同土层的TS含量均属于中等变异(10% 表2 不同湿地土壤TS含量的水平变异 a,b表示同一土层不同湿地土壤TS(Total Sulfur)含量之间的差异, 有相同字母表示二者在P<0.05水平上无显著差异; P:芦苇(P.Australis); PC:芦苇-短叶茳芏群落的交错带(P.australis-C.Malaccensis); C:短叶茳芏(C.Malaccensis);CV:变异系数 垂直方向上,不同湿地土壤的TS含量在A、B样带上均表现为短叶茳芏湿地>交错带湿地>芦苇湿地(图3)。两条样带芦苇湿地及交错带湿地0—60cm土层的TS含量均随深度呈先降低后增加变化,而短叶茳芏湿地0—30cm土层的TS含量在A样带上随深度增幅不大,但在30—60cm土层则呈波动增加趋势。与之不同,B样带上短叶茳芏湿地土壤的TS含量在0—40cm土层随深度增幅明显,而在深层土壤中则出现小幅降低。方差分析表明,芦苇湿地和短叶茳芏湿地0—60cm土层的TS含量在两条样带间均存在显著差异(PA=0.011;PB=0.027)。比较而言,3种湿地0—60cm土层TS含量的垂直变异系数在两条样带间差别不大,均属于中等变异(表3)。相对于交错带湿地土壤,两条样带上短叶茳芏湿地土壤TS含量的垂直变异性均降低(分别降低42.43%和17.51%),而芦苇湿地土壤TS含量的垂直变异性均增加(分别增加59.76%和64.90%)。 表3 不同湿地土壤TS含量的垂直变异性 a, b表示同一样带不同湿地土壤TS含量之间的差异; 有相同字母表示二者在P<0.05水平上无显著差异 2.2.2 土壤硫储量分布 图4 不同湿地土壤硫储量分布Fig.4 Distribution of S stocks in soils of different marshes 除B样带短叶茳芏湿地外,两条样带各湿地中0—60cm土壤的硫储量整体呈先降低后增加变化(图4),且A样带上3种湿地0—60cm土层的硫储量均高于B样带上相同湿地土壤的硫储量。两条样带上芦苇湿地50—60cm土层的硫储量略高于交错带湿地和短叶茳芏湿地,而其他土层均表现为芦苇湿地<交错带湿地<短叶茳芏湿地。 2.3.1 植被TS含量分布 芦苇纯群落地上不同部分的TS含量在两条样带上均高于交错带中芦苇群落的相应部分,且两个群落立枯体(PA=0.015;PB=0.041)和鞘(PA=0.040;PB=0.022)的TS含量均存在显著差异(图5)。与之不同,A样带中除交错带中短叶茳芏叶的TS含量低于短叶茳芏纯群落外,其茎和立枯体的TS含量均高于后者(P>0.05),B样带交错带短叶茳芏茎TS含量明显低于纯群落,而其叶和立枯体TS高于纯群落。与地上部分不同,A、B两条样带上芦苇纯群落根的TS含量均显著低于交错带中的芦苇群落(PA=0.019;PB=0.027),后者分别为前者的1.31倍和1.22倍。两条样带上短叶茳芏纯群落根的TS含量均高于交错带中的短叶茳芏群落,且二者在B样带上存在极显著差异(P=0.008)。 2.3.2 TS累积与分配 两条样带上芦苇纯群落的茎(PA=0.042)、叶(PA=0.025;PB=0.018)、立枯体(PA=0.011;PB=0.034)和鞘(PA=0.019;PB=0.027)的AFS均显著高于交错带的芦苇群落(表4)。尽管两条样带上芦苇纯群落根部的AFS与交错带芦苇群落根部的AFS之间不存在显著差异(P>0.05),但前者的AFS要低于后者。与之不同,短叶茳芏地上器官的AFS值均表现为交错带群落高于纯群落,而根部的AFS值表现为交错带群落低于纯群落。 图5 湿地植被不同部分TS含量Fig.5 TS contents in different parts of marsh plants 就不同部分的硫分配比而言,相同植被在不同群落之间存在较大分异(图6)。与芦苇纯群落相比,A、B两条样带上交错带芦苇群落的根和立枯体的分配比均明显增加(增幅分别为35.41%、22.06%和38.46%、5.66%),茎和叶的分配比均大幅度降低(降幅分别为43.47%、21.40%和47.28%、19.41%),而鞘的分配比变化不大。与之不同,交错带中短叶茳芏群落根的硫分配比略低于纯群落,茎的硫分配比要明显高于纯群落(两条样带上的增幅分别为30.21%和21.48%),而叶和立枯体的硫分配比较纯群落变化不大。 表4 湿地植物不同部分AFS值 “—”表示短叶茳芏无相关数据; A,B表示同一样带相同湿地植被的AFS(Accumulation Factor of sulfur)在纯群落与交错带群落之间的差异; a, b表示不同样带上同种植被AFS之间的差异;字母不同表示二者在P<0.05水平上差异显著 图6 湿地植物不同部分硫储量分配比 Fig.6 Allocation ratios of S stocks in different parts of marsh plants 各理化因子取A,B两条样带相应指标的均值 为进一步明确影响两种植被空间扩展过程中土壤TS含量分布的主要因素,对影响3种湿地土壤TS含量的环境因子进行主成分分析(表6)。结果表明,芦苇湿地的第一主成分Z1与x3存在明显正相关,与x1存在明显负相关,可看作是土壤水盐状况的代表;第二主成分Z2与x2、x4、x6存在较大正相关,与x7存在较大负相关,可看作是土壤酸碱状况、有机组分及颗粒组成的代表。短叶茳芏湿地的第一主成分Z1与x1、x5、x6存在明显正相关,与存x3、x7在明显负相关,可看作是土壤颗粒组成和水盐状况的代表;第二主成分Z2与x2存在明显正相关,可看作是土壤酸碱状况代表。与之相比,交错带湿地第一主成分Z1与x4、x5、x6存在明显正相关,与x7存在明显负相关,可看作是土壤颗粒组成和有机组分的代表,第二主成分Z2与x3存在明显正相关,与x1存在明显负相关,可看作是土壤水盐状况的代表。逐步回归分析结果表明,短叶茳芏湿地中仅有土壤粘粒进入回归方程(y=-1.492x+0.925,R2=0.856,P=0.008),说明细颗粒组成特别是粘粒含量是影响其土壤TS含量分布的关键因素,解释效率可达85.6%。与之不同,芦苇湿地和交错带湿地中无任何因子进入方程,说明这两种湿地土壤的TS含量除受到细颗粒组成影响外,还可能受到其他环境因素(特别是有机质和水盐状况)复杂交互作用的影响(表6)。 本研究表明,芦苇与短叶茳芏空间扩展对两种植被的生态特征和硫养分吸收利用状况均产生了重要影响。相对于纯群落而言,交错带群落中芦苇密度明显增加,短叶茳芏的密度则大幅降低,说明芦苇具有更高的空间占据能力,原因可能主要有两方面:一是与两种植被的繁殖能力与繁殖特性的差异有关。已有研究表明,克隆植物种群在边缘地带或竞争区域的种子生产和萌发能力显著下降,由此可能导致其有性繁殖能力变弱[22]。尽管芦苇和短叶茳芏均为克隆植物,但前者可通过多年生根状茎的侧向伸展和大量分蘖(无性繁殖)进行生长空间的占据[23],而在竞争环境中短叶茳芏大多只能通过越冬地下根系进行相对较弱的克隆繁殖[24]。实际上,交错带中两种植被的密度差异也表明了芦苇具有更强的无性繁殖能力,其空间占据能力高于短叶茳芏。二是与交错带中两种湿地植被地上与地下养分联系的差异有关。研究发现,短叶茳芏地上器官TS的平均含量要高于芦苇,而这主要与两种植被对硫养分的吸收能力差异有关。由于芦苇为C3植物,具有明显的光合午休现象,其在光能竞争中处于劣势[25];而短叶茳芏为C4植物,具有更强的净光合速率[26]。与C3植物相比,C4植物的CO2补偿点低得多,叶绿体对CO2的亲和力要强于C3植物[27],而硫又是参与叶绿素形成,控制光合作用中碳水化合物代谢的重要营养元素,故其含量直接影响C4植物的光合作用[1]。另外,由于亚热带河口的高温时间长,而当温度达到一定范围时芦苇便出现“光合午休”现象,所以在与短叶茳芏的竞争过程中,芦苇对光能的利用能力较弱,进而使得其地上器官对硫的累积能力整体较低。 表6 特征值及主成分矩阵 Z1代表第一主成分, Z2代表第二主成分 本研究亦表明,相比纯群落而言,交错带芦苇地上各器官的TS含量及AFS均明显降低,而短叶茳芏地上器官的相应指标均明显升高,这主要与两种植被在空间扩展过程中所采取的不同竞争策略有关。已有研究表明,芦苇可利用快速克隆来促进地下生物量的增加并确立其竞争优势,当受到资源限制时,为保证种群的繁殖与扩张,地上部分的生长发育会在一定程度受阻[28]。因此,当芦苇与短叶茳芏空间扩展过程中的竞争作用产生时,芦苇可能会将硫养分优先分配于地下根系,从而使得其地上器官的硫含量和累积系数相对降低,交错带的芦苇可能以地下竞争为主,地上器官的竞争力较弱,其对养分的吸收能力相对较低。与之不同,短叶茳芏对合成叶绿素必需的硫养分需求量相对较大,这就使其在二者竞争中占据一定的资源优势,从而导致其地上器官的TS含量整体较高。本研究还表明,交错带中芦苇和短叶茳芏的根冠比均较纯群落有较大增加,原因可能与两种植被在空间扩展过程中对养分的竞争有关。已有研究表明,在养分限制的生境中,植物可通过将较多的生物量分配于地下以吸收养分,从而增加其地下占据空间来应对竞争[29]。王维奇等[30]研究表明,闽江口芦苇和短叶茳芏的生长主要受到氮养分限制,而这种限制程度可能在二者空间扩展形成的交错带湿地中表现的尤为突出。本研究中,芦苇湿地、交错带湿地以及短叶茳芏湿地土壤TN含量分别为(1.956±0.675)mg/g、(1.617±0.136)mg/g和(1.589±0.242)mg/g。相对于纯群落而言,交错带中的芦苇受到氮养分限制程度更高,且还受到来自短叶茳芏对氮养分的竞争。可能正是由于二者地上与地下生物量分布格局的变化使得其在扩大对氮养分吸收的同时亦改变了对硫养分的吸收能力。为了抗衡低养分逆境,两种植物可能均通过增加根系生物量以扩大对土壤养分的吸收能力,而这一结果与Brewer等对湿地短尾灯心草(Juncusgerardi)在低养分条件下通过增加其根部生物量确立其竞争优势的研究结论相一致[31]。本研究还发现,交错带中短叶茳芏根的TS含量及AFS均较纯群落有所下降,而芦苇根的相应指标均较纯群落有较大提高,这可能主要与两种植被通过改变自身地上与地下的硫养分分配格局来保持其相对竞争力有关。已有研究表明,C4植物地上部分的光合作用强烈,碳水化合物代谢频繁,根部会将大量养分转移至地上转移以满足其生长发育[25]。前述研究可知,交错带中短叶茳芏的株高相对纯群落而言有大幅度增加,说明前者可通过增加株高以获得充足阳光来保持其竞争力。因而,相对于短叶茳芏纯群落,其地上需求的硫养分更多,从而使得根部硫养分大量转移至地上而导致其硫含量和AFS降低。与之相反,芦苇更侧重于通过扩展地下空间来保持其竞争力,其主要通过增强根部对硫养分的吸收与利用来抗衡短叶茳芏带来的竞争,由此导致其根的硫含量及AFS增加明显。 (1)不同湿地表层土壤的TS含量表现为交错带湿地>短叶茳芏湿地>芦苇湿地,其差异主要与两种植被的空间扩展增加了交错带湿地土壤的细颗粒组成和有机组分,进而对硫的迁移及转化过程产生重要影响有关。 (2)受植物根系分布及枯体养分释放的影响,交错带湿地土壤TS含量的水平和垂直变异性均较芦苇或短叶茳芏纯群落发生较大改变,其土壤的TS含量垂直分布与芦苇根系分布紧密相关,且其含量和储量均在深层土壤中较高。 (3)芦苇与短叶茳芏的空间扩展改变了两种植被的株高、密度及生物量分配格局,二者在交错带中的地下生物量分配比均高于纯群落,但芦苇地下空间占据能力要高于短叶茳芏。 (4)芦苇与短叶茳芏的空间扩展是双向的,交错带湿地中芦苇通过增加根部对硫养分的累积能力来保持其竞争力,短叶茳芏则通过拓展地上空间及提高地上器官的硫养分累积能力来抗衡芦苇的空间扩展。 参考文献(References): [1] 陆景陵. 植物营养学(第二版). 北京: 中国农业大学出版社, 2003: 72- 76. [2] 丁秋祎, 白军红, 高海峰, 肖蓉, 崔保山. 黄河三角洲湿地不同植被群落下土壤养分含量特征. 农业环境科学学报, 2009, 28(10): 2092- 2097. [3] Luther III G W, Church T M, Scudlark J R,Cosman M. Inorganic and organic sulfur cycling in salt-marsh pore waters. Science, 1986, 232(4751):746-749.[4] 李新华. 三江平原小叶章湿地土壤硫的形态分布和转化过程研究[D].长春:中国科学院研究生院,2007. [5] Valeur I, Nilsson S I, Andersson S, Sjöberg G. Net sulphur mineralization in forest soils as influenced by different lime application rates. Soil Biology and Biochemistry, 2002, 34(9): 1291- 1298. [6] Åkerblom S, Bishop K, Björn E, Lambertsson L, Eriksson T, Nilsson M B. Significant interaction effects from sulfate deposition and climate on sulfur concentrations constitute major controls on methylmercury production in peatlands. Geochimica et Cosmochimica Acta, 2013, 102: 1- 11. [7] 曹爱丽. 长江口滨海沉积物中无机硫的形态特征及其环境意义[D]. 上海: 复旦大学, 2010. [8] Delaune R D, Devai I, Lindau C W. Flux of reduced sulfur gases along a salinity gradient in Louisiana coastal marshes. Estuarine, Coastal and Shelf Science, 2002, 54(6): 1003- 1011. [9] 李新华, 刘景双, 孙志高, 杨继松. 三江平原小叶章湿地生态系统硫的生物地球化学循环. 生态学报, 2007, 27(6): 2199- 2207. [10] Musvoto C, Campbell B M, Kirchmann H. Decomposition and nutrient release from mango and miombo woodland litter in Zimbabwe. Soil Biology and Biochemistry, 2000, 32(8/9): 1111- 1119. [11] Sun Z G, Mou X J, Song H L, Jiang H H. Sulfur biological cycle of the differentSuaedasalsamarshes in the intertidal zone of the Yellow River estuary, China. Ecological Engineering, 2013, 53: 153- 164. [12] Zhou C F, An S Q, Deng Z F, Yin D Q, Zhi Y B, Sun Z Y, Zhao H, Zhou L X, Fang C, Qian C. Sulfur storage changed by exoticSpartinaalterniflorain coastal saltmarshes of China. Ecological Engineering, 2009, 35(4): 536- 543. [13] 曹志洪, 孟赐福, 胡正义. 中国农业与环境中的硫. 北京: 科学出版社, 2011: 1- 83. [14] 胡敏杰,邹芳芳,任鹏,黄佳芳,李冬冬,仝川. 闽江河口湿地土壤CH_4产生与氧化速率对外源氮、硫添加的响应. 生态学报,2017,01:167- 176. [15] Ewanchuk P J, Bertness M D. Structure and organization of a northern New England salt marsh plant community. Journal of Ecology, 2004, 92(1): 72- 85. [16] 钱宝, 刘凌, 肖潇. 土壤有机质测定方法对比分析. 河海大学学报: 自然科学版, 2011, 39(1): 34- 38. [17] 刘雪梅, 黄元仿. 应用激光粒度仪分析土壤机械组成的实验研究. 土壤通报, 2005, 36(4): 579- [18] 王为东. 芦苇型水陆交错带中根孔结构及其影响下的水化学研究[D]. 北京: 中国科学院研究生院(生态环境研究中心), 2002. [19] 吕国红, 周莉, 赵先丽, 贾庆宇, 谢艳兵, 周广胜. 芦苇湿地土壤有机碳和全氮含量的垂直分布特征. 应用生态学报, 2006, 17(3): 384- 389. [20] Ferreira T O, Otero X L, Vidal-Torrado P, et al. Effects of bioturbation by root and crab activity on iron and sulfur biogeochemistry in mangrove substrate. Geoderma, 2007, 142(1/2):36- 46. [21] 何涛,孙志高,李家兵,高会,祝贺,任鹏. 闽江河口不同淹水环境下典型湿地植物-土壤系统全硫含量空间分布特征. 水土保持学报,2016,05:246- 254. [22] 张玉芬, 张大勇. 克隆植物的无性与有性繁殖对策. 植物生态学报, 2006, 30(1): 174- 183. [23] 袁月, 李德志, 王开运. 芦苇和互花米草入侵性研究进展. 湿地科学, 2014, 12(4): 533- 538. [24] 黄敏参. 咸草植物形态解剖及生理生态特性初步探讨[D].福州: 福建师范大学,2008. [25] 赵广琦,张利权,梁霞. 芦苇与入侵植物互花米草的光合特性比较. 生态学报,2005,07:1604- 1611. [26] 伍欢. 大莎草的光合模式鉴定及C3/C4差异表达基因的功能研究[D]. 武汉: 华中农业大学, 2014. [27] 牛书丽, 蒋高明, 李永庚. C3与C4植物的环境调控. 生态学报, 2004, 24(2): 308- 314. [28] Paradis É, Bellavance M, Fontaine B, Brisson J. Interspecific competition for space between wetland plants with clonal growth. Wetlands, 2014, 34(5): 1003- 1012. [29] 赵平, 葛振鸣, 王天厚, 汤臣栋. 崇明东滩芦苇的生态特征及其演替过程的分析. 华东师范大学学报: 自然科学版, 2005, (3): 98- 104, 112- 112. [30] 王维奇,徐玲琳,曾从盛,仝川,张林海. 河口湿地植物活体-枯落物-土壤的碳氮磷生态化学计量特征. 生态学报,2011,23:134- 139. [31] Brewer J S, Levine M, Bertness M D. Effects of biomass removal and elevation on species richness in a New England salt marsh. Oikos, 1997, 80(2): 333- 341.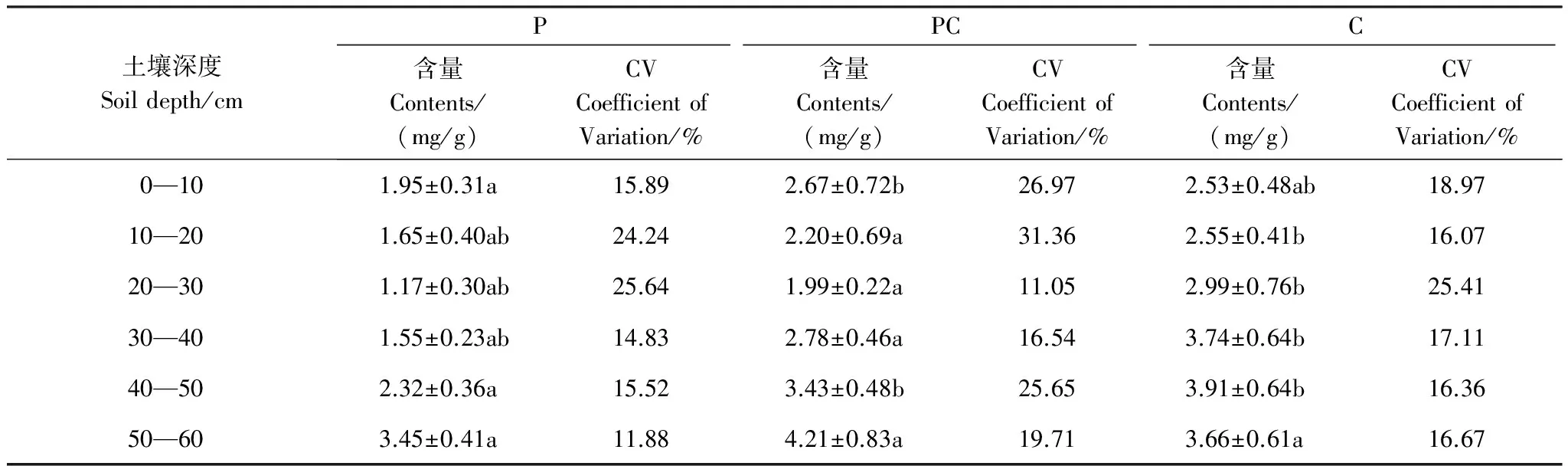
2.3 空间扩展过程中植被硫累积特征
3 讨论
3.1 空间扩展中湿地土壤硫空间分布
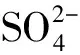
3.2 空间扩展中植被生态特征与硫累积
4 结论
