土壤微生物多样性海拔格局研究进展
2018-04-19厉桂香马克明
厉桂香,马克明
1 中国科学院生态环境研究中心,城市与区域生态国家重点实验室,北京 100085 2 中国科学院大学,北京 100049
海拔梯度包含了温度、湿度和光照等各种环境因子[1],并且环境因子的变化要比纬度梯度上快1000倍,对生物多样性保护及研究生物多样性分布格局及其驱动因素具有重要意义。长期以来,研究人员对树木、哺乳动物、昆虫、鸟类等宏观生物做了大量报道[2- 5],指出宏观动植物多样性在海拔梯度上的分布多随海拔呈现递减模式或单峰模式[6-7],其驱动机制可以归为四大类:气候环境因素、空间因素、历史因素以及生物作用。其中气候因素、中域效应(MDE)被较多的运用于解释大型动植物的海拔分布格局[7-8]。
土壤微生物作为重要的分解者,在生态系统物质循环与能量流动中扮演着重要角色。由于其微小的个体、较强的扩散能力以及极高的多样性和个体丰度[9-10],被早期的研究者认为是全球随机分布的[11-12]。加上当时研究技术手段的限制,土壤微生物长期以来被排斥在生物多样性空间格局研究之外。不过,越来越多的证据表明土壤微生物群落组成及多样性随环境变量的变化而变异,在空间上呈现规律性分布[13- 15]。
随着Bryant等[16]首次揭示了土壤微生物多样性海拔格局同植物多样性分布明显不同,以及伴随着新的高通量测序技术(如Roche FLX 454, Illumina MiSeq)的发展,涌现出一批关于微生物海拔分布的研究成果[17- 20]。本文根据国内外最新研究报道,综述土壤微生物多样性海拔分布格局与维持机制的研究进展,总结影响土壤微生物多样性海拔格局的可能因素,并提出未来研究的相关方向。
1 土壤微生物群落的海拔格局
1.1 细菌群落
微生物通常认为应该包括细菌、古菌以及部分微型真核生物(如单细胞藻类及微型真菌和原生动物)[21-22]。其中细菌是土壤微生物中数量最大、种类最多、功能多样的类群。细菌在土壤形成、凋落物分解、养分循环中具有重要作用。
Bryant等[16]首次对土壤细菌多样性沿海拔梯度的分布格局进行了研究,表明土壤细菌物种丰富度随海拔升高呈现单调递减的模式,这与植物多样性的单峰模式不同。但由于其克隆文库方法的限制,其主要针对酸杆菌(Acidobacteria)这一类群(与土壤pH有很强的相关性),不足以说明整个土壤细菌群落。Fierer等[17]对3种典型生境(有机质土壤、矿质土壤、叶表面)下细菌多样性的研究表明细菌多样性没有明显的海拔梯度格局,而植物与动物群落多样性随海拔升高明显下降,据此得出微生物多样性的海拔分布模式与动植物并不相同。但是其各研究样点间的空间异质性较强,有可能削弱了样点内的多样性水平差异。Shen等[23]研究发现长白山不同海拔植被类型下土壤细菌群落组成在不同海拔间有差异,然而其多样性随海拔并没有明显的规律。而在另一个研究中却发现土壤细菌多样性在长白山苔原沿海拔单调递减的规律[14]。Singh等在日本富士山[18]北坡沿海拔梯度发现了单峰的分布模式,而在韩国汉拿山[24]的研究显示,土壤细菌多样性在中海拔较低,而低海拔和高海拔相对较高,指出山地生态系统中土壤微生物丰富度和多样性并没有一致的分布格局。此外,也有一些最新的研究利用454、MiSeq等高通量测序技术揭示了沿海拔下降的细菌多样性分布模式[20,25]。
根据目前的报道,土壤细菌多样性的海拔分布并未明确倾向于某种分布模式,而表现为无趋势、下降、单峰或者下凹型等多种海拔分布格局(表1)。但比较清楚的是,其与动植物的海拔分布格局并不一致,这意味着两者的驱动机制可能不同。
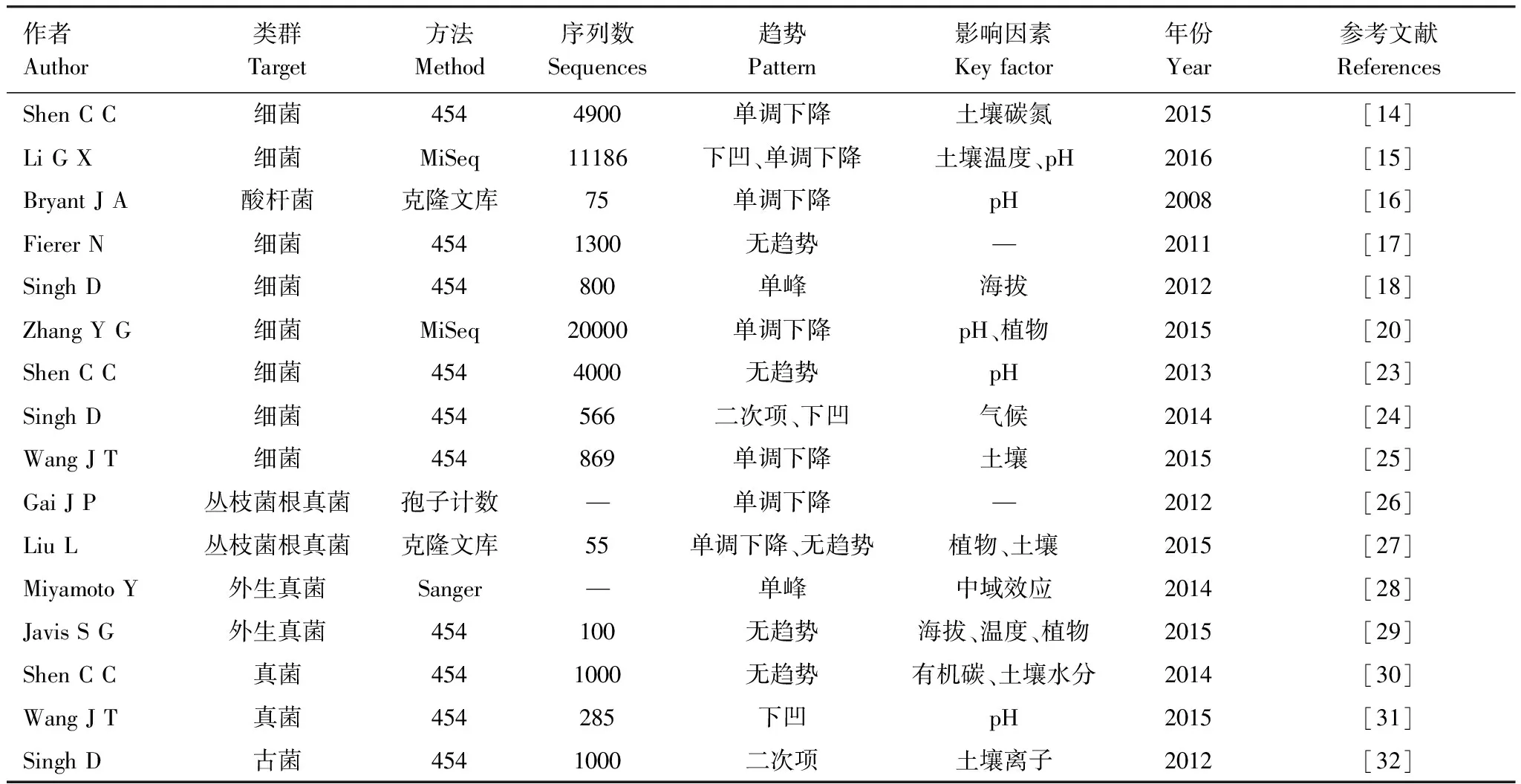
表1 土壤微生物海拔分布格局研究总结
1.2 真菌群落
真菌类群是土壤微生物的重要组成部分,在植物凋落物分解和养分循环中有重要的作用[33]。真菌可以与高等植物形成共生体,为植物生长提供所需的营养元素[34- 36];也可以作为病原菌,影响森林健康[37]。
真菌与植物的共生作用,一直以来是研究的热点。但对真菌多样性海拔梯度格局的研究相对较少。Lugo等[38]利用显微镜计数分离丛枝菌根真菌孢子,发现根际土壤丛枝菌根真菌的数量随海拔升高而降低。利用孢子计数、克隆文库等方法,另外一些研究也发现了丛枝菌根真菌的物种丰富度与海拔呈负相关关系[26- 27,39]。Bahram等[40]对伊朗北部3个不同森林外生菌根真菌的研究发现其多样性随海拔呈现下降的模式,寄主植物物种和海拔显著影响其群落物种组成。Miyamoto等[28]用Sanger测序方法研究了日本富士山海拔梯度上外生菌根真菌的分布,发现其物种丰富度呈现单峰分布的模式,这一分布模式在大型动植物海拔格局中比较常见,推测可能的原因是受到中域效应的影响(mid-domain effect,MDE)。另外还有一些研究并没有发现外生菌根真菌物种丰富度随海拔明显的分布趋势,但是群落组成却在不同的海拔间有明显差异[29,41]。此外,运用454高通量测序技术,研究者对土壤中总的真菌多样性进行研究,揭示土壤真菌物种丰富度随海拔没有明显的分布规律[30]以及存在“hollow”分布模式[31],但土壤真菌群落组成在不同海拔间具有明显差异。Wu等[42]研究也表明真菌群落在不同海拔梯度下不同林龄的土壤间差异显著。
土壤真菌物种丰富度呈现不同的海拔分布模式,但其群落组成具有明显的海拔分异。相比较而言,由于菌根真菌跟植物的关系密切,因此很多研究都发现了菌根真菌随海拔下降或单峰的模式。
1.3 古菌群落
古菌不仅生活在极端环境中,如海底、陆地热泉、火山口以及盐碱湖等,也在非极端的土壤环境中广泛存在[43-44]。对土壤古菌群落的相关海拔格局研究缺乏。Wang等[25]对青藏高原色季拉山6个海拔梯度上古菌多样性进行研究,表明其并没有表现出明显的海拔格局,但是群落组成却在不同的森林类型间表现出分异。而Singh等[32]对日本富士山的研究显示土壤古菌物种丰富度和多样性呈现双峰的模式,即在较低海拔(1500m)达到1个峰值,而后下降,随即又在山顶处出现上升。另一个针对氨氧化古菌(AOA)的研究表明其多度随海拔的上升而下降[45]。
1.4 功能基因
微生物的功能多样性、功能特性跟生态系统的过程和功能息息相关。随着分子生物学技术如基因芯片、宏基因组等的发展,对土壤微生物功能基因的研究越来越多。
Yang等[46]利用基因芯片技术调查了青藏高原草地4个海拔梯度上土壤微生物功能基因的分布,发现碳循环、氮循环及压力相关基因的相对丰度在不同海拔间具有明显差异,海拔越高,压力相关的功能基因相对丰度越高,且不同海拔土壤中存在特有的功能基因。Shen等[47]同样用基因芯片技术对长白山土壤微生物功能基因海拔分布的研究表明,土壤微生物功能基因的海拔格局同物种多样性分布并不一致,功能基因多样性在林线处出现1个明显转变,功能基因多样性在林线之上急剧上升,这对于预测土壤微生物对气候变化的响应具有重要意义。同样,Ding等[48]的研究也揭示了林线两侧灌木林和针叶林土壤微生物功能基因多样性具有显著差异。
土壤中蕴藏着巨大的功能多样性,这对于土壤中物质循环和能量流动具有重要意义。随着新技术的发展,对土壤微生物功能多样性分布规律的研究有助于预测生态系统功能对于地上生物多样性的丧失以及气候变化等的响应。
综上研究,无论是土壤细菌、真菌、古菌,还是功能基因多样性,目前研究报道的海拔分布模式并不明确,但群落组成即beta多样性具有明显的海拔分异。
2 土壤微生物海拔格局的驱动机制
高等动植物多样性海拔格局的维持机制可归为四大类:气候环境因素、空间因素、历史因素以及生物作用。对微生物的空间分布的认识可以追溯到Bass Becking于1934年提出的“Everything is everywhere, but the environment selects”[49],也就是说微生物的空间分布完全受环境条件的影响,但是此后很多研究也证实了空间距离对微生物存在影响。然而,在局域的海拔尺度上,鉴于微生物的高扩散能力,研究者多从气候环境因素方面探讨土壤微生物群落分布的驱动机制,对空间及历史因素的研究较少,集中在以下几个方面。
2.1 土壤
土壤形成的微环境是土壤微生物赖以生存的空间,其理化性质会对生活其中的微生物群落产生直接或间接的影响。土壤pH是目前公认的驱动微生物分布的关键因子。其作用发生于不同的取样尺度上和不同的土壤环境中。无论是在大尺度的纬度梯度上[50-51],还是在局域的海拔梯度上[23];无论是在森林土壤环境[31],还是在草地土壤环境中[52]。
在海拔梯度上,土壤pH对土壤微生物群落的分布具有重要影响。Bryant等[16]的研究指出土壤pH是微生物海拔格局的重要影响因素。Fierer等[17]指出Bryant等得出的微生物下降模式可能就是因为土壤pH沿海拔下降,而非海拔或温度的影响。Shen等[23]在长白山开展的工作显示土壤pH跟细菌物种丰富度以及系统发育多样性都成显著的正相关关系,土壤中优势细菌门也与土壤pH呈显著的正相关或负相关关系。不仅如此,土壤pH对不同海拔间的细菌群落组成也有显著影响。对于真菌群落,土壤pH也对其海拔分布发挥着显著作用。如Shen等[30]对长白山真菌群落的研究显示土壤pH不仅影响多样性的海拔格局,也影响了群落组成的海拔分异。后续很多研究也证明了土壤pH的重要影响[15]。
除土壤pH外,在一些pH变异较小的地区,其他土壤因子也具有重要影响。如Li等[15]在北京东灵山发现土壤有效磷和碳氮比的重要作用;Shen等[14]在长白山苔原发现土壤碳和氮的显著影响。此外,Singh等[53]对云南3个山区不同海拔森林土壤细菌群落的研究发现土壤碳氮比和可交换钙离子、钾离子浓度对细菌群落组成的重要影响。此外,土壤的一些物理结构(如粒度等)也可能对土壤微生物的海拔分布造成影响[15]。
2.2 气候
随海拔上升,温度下降,降水增加,气候被认为是驱动高等动植物沿海拔下降格局的重要因素。很多研究指出温度是驱动土壤微生物海拔分布的一个重要因素。Singh等[24]在对韩国汉拿山不同海拔土壤细菌群落的研究中指出,年均温和降水等气候因子是影响土壤细菌海拔分布的重要因子。Jarvis等[29]对外生菌根真菌群落的研究也指出,土壤水分和温度是驱动外生菌根真菌群落在不同海拔间变异的主要因子。
2.3 植物
植物群落通过多种途径与土壤微生物发生联系。一是通过凋落物的输入以及根系分泌物的分泌来改变土壤理化性质[48,54],改变微生物生存的微环境。二是可以与土壤微生物形成菌根互惠共生体[55]。虽然大部分研究没有发现土壤微生物多样性和植物多样性的相关关系,但植物群落组成可以预测土壤微生物的群落组成,这在海拔梯度和纬度梯度上都已得到了验证[15, 52]。
3 土壤微生物海拔格局的影响因素
土壤微生物多样性表现为无趋势、下降、单峰或者下凹型等多种海拔分布模式,出现这种状况的原因可能有多种。
3.1 微生物的属性特征
微生物的物种概念与大型动植物不同,微生物物种的定义依靠克隆和测序分析,一般是指rRNA基因序列相似性大于97%的一组微生物,用可操作分类单元(operational taxonomic unit,OTU)来表示。这种较为粗略的划分标准会影响土壤微生物空间分布格局的研究结果。
另外,微生物可能由于其个体微小、扩散能力强以及较高的多样性和个体丰度而在局域尺度上扩散不受限制,从而使其多样性随海拔梯度的变异较小。
3.2 驱动机制的差异
微生物可能更易受土壤微环境的影响,从而受到不同的山地系统中土壤因素对其海拔分布格局的影响。Li等[15]指出土壤微生物在树线两侧的森林和草甸中表现为不同的海拔格局,主要原因可能是驱动微生物的土壤因子在树线两侧沿海拔分布规律的不同。
3.3 研究方法的限制
取样点的异质性、海拔尺度不同、取样点的数量与密集程度、多样性研究的技术等都会造成影响。尤其是微生物研究的技术手段,比如测序深度,可能会对微生物的alpha多样性格局造成重要影响。虽然新测序手段的发展极大促进了对于土壤微生物多样性的认识,但即使是用较新的二代高通量测序也只能测得土壤微生物的一小部分。加上土壤微生物海拔格局的研究中用到的序列数差别显著,虽然这些研究都对序列数做了标准化的统一,仍然很难剔除序列数对最终结果的影响。
我们用已发表的土壤微生物海拔格局的高通量测序数据[15],选取了树线之上的草甸中的21个点,对所有样品分别抽取1000、4000、8000、15000条测序序列统计每个海拔样点的土壤微生物OTU总数(图1)。当序列数为1000时,OTU随海拔上升没有呈现出明显的规律。序列数为4000、8000和15000时,OTU随海拔上升出现明显的下降格局,并且调整的R平方随序列数的增加而增大。这表明,虽然对序列数进行了标准化的处理,但序列数仍会对揭示土壤微生物物种丰富度的海拔格局产生影响。序列数较少时(1000条)会有比较大的随机性,从而观察不到明显的海拔规律。
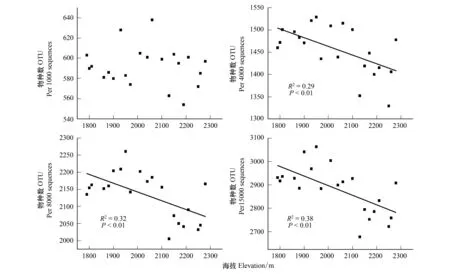
图1 不同测序深度下土壤细菌物种丰富度(OTU)随海拔的变化Fig.1 Changes of soil bacterial species richness (OTU) along elevation under different sequencing depth
由于技术手段等的限制,以往的很多研究中标准化的序列数仅设定为几百条或几千条[17- 18,24],结果没有发现土壤微生物多样性随海拔呈现明显的规律。最近的1个研究将其设定为2万条[20],却发现了土壤细菌多样性随海拔上升而下降的分布模式。目前还没有研究就序列数对土壤微生物海拔格局的可能影响进行评估。不过,随着新技术的发展及测序深度的增加,这一可能影响将会被减弱。
3.4 其他因素
除了微生物自身属性以及测序技术限制之外,土壤微生物的海拔格局还可能与地域有关。比如不同的研究者对日本富士山的土壤细菌群落[18]、古菌群落[32]以及外生菌根真菌[28]进行了研究,三者都表现为在中海拔丰富度较高,而在其他地方并未发现土壤微生物多样性沿海拔的单峰分布模式。还有在对长白山细菌[23]以及真菌[30]的研究中,都没有发现明显的海拔分布规律。同时也有研究指出,在同样的山地系统的不同样带也会呈现不同的海拔格局[24]。因此,还需要更多的深入研究来揭示土壤微生物群落沿海拔的分布格局。
4 系统发育在土壤微生物海拔格局中的应用
随着生物信息学的发展,系统进化的研究方法广泛的渗透到生态学研究中。群落系统发育结构能反应出群落组成的进化历史及不同物种在进化历史上的亲缘关系[56-57]。群落系统发育结构是指群落内部物种在亲缘关系上的远近程度[58],可能受多种生态过程的影响,例如竞争排斥、生境过滤、散布限制、生物地理历史因素等。群落的系统发育结构为理解不同生态过程在物种共存中的相对重要性提供了一个全新的视角。
系统发育方法在探讨土壤微生物群落构建与维持机制的研究中被广泛应用[59- 63],但有关海拔梯度上土壤微生物系统发育结构的研究并不多见。Bryant等[16]揭示了美国洛基山脉土壤中酸杆菌群落在整个海拔梯度上都倾向于系统发育聚集,预示着环境过滤作用在其群落构建中起着更为重要的作用。值得一提的是,Wang等[64]对于云南老君山水体中细菌的研究,也同样揭示了细菌群落系统发育结构沿着海拔梯度显示为谱系聚集(phylogenetic clustering)特征,物种间的亲缘关系随海拔增加而增加,表明随海拔增加环境限制逐渐增强。Shen等[14]对长白山苔原细菌群落的研究也表明细菌群落在高海拔系统亲缘关系较近,在每个海拔物种系统发育都趋向于更近的亲缘关系。
诸多研究都表明土壤微生物群落对于动植物来说更倾向于系统发育聚集,这意味着环境过滤作用在土壤微生物群落的维持机制中起着更为重要的作用。系统发育分析有助于进一步认识土壤微生物群落构建和对环境的响应机制。
5 研究展望
土壤微生物海拔格局研究还处于起步阶段。土壤微生物多样性海拔分布模式并不明确,但其海拔分布格局与大型动植物不同。未来的研究重点应该集中在土壤微生物多样性及其群落构建的驱动机制方面,重点揭示全球气候变化、生物多样性丧失等过程对土壤微生物群落,乃至整个土壤生态系统功能的影响。着重关注以下几个方面:(1)依托最新的基因测序技术,增加测序深度,减小因为技术方法对土壤微生物多样性认识的影响。运用最新的宏基因组技术,开展土壤微生物功能多样性的研究。(2)增加取样点的精度和密度。避免取样的异质性,用样带取样的方法增加取样点的密度,并可从多个尺度分析土壤微生物多样性的海拔格局,深入认识其维持机制。(3)加强土壤微生物海拔格局的beta多样性、系统发育方面的研究,有助于认识土壤微生物群落沿海拔的构建机制,并尝试运用大型动植物群落构建的生态学理论(如中性理论和生态位理论)去验证土壤微生物群落的维持机制。(4)微生物不同类群间存在食物链与相互作用关系,且与地下-地上动植物存在紧密的联系。未来应加强各类群间的协同变化及其驱动机制。利用网络构建等的方法揭示不同类群的相互关系,为探讨不同生物类群相互作用及生态系统应对全球变化提供依据。
参考文献(References):
[1] Körner C. The use of ‘altitude’ in ecological research. Trends in Ecology & Evolution, 2007, 22(11): 569- 574.
[2] Sanders N J, Rahbek C. The patterns and causes of elevational diversity gradients. Ecography, 2012, 35(1): 1- 3.
[3] McCain C M. Elevational gradients in diversity of small mammals. Ecology, 2005, 86(2): 366- 372.
[4] Fu C Z, Hua X, Li J, Chang Z, Pu Z C, Chen J K. Elevational patterns of frog species richness and endemic richness in the Hengduan Mountains, China: geometric constraints, area and climate effects. Ecography, 2006, 29(6): 919- 927.
[5] Grytnes J A. Species-richness patterns of vascular plants along seven altitudinal transects in Norway. Ecography, 2003, 26(3): 291- 300.
[6] Guo Q F, Kelt D A, Sun Z Y, Liu H X, Hu L J, Ren H, Wen J. Global variation in elevational diversity patterns. Scientific reports, 2013, 3: 3007
[7] Rahbek C. The elevational gradient of species richness: a uniform pattern? Ecography, 1995, 18(2): 200- 205.
[8] Colwell R K, Rahbek C, Gotelli N J. The Mid-domain effect and species richness patterns: what have we learned so far? The American Naturalist, 2004, 163(3): E1-E23.
[9] Torsvik V, Goksøyr J, Daae F L. High diversity in DNA of soil bacteria. Applied and Environmental Microbiology, 1990, 56(3): 782- 787.
[10] Van Der Heijden M G A, Bardgett R D, Van Straalen N M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecology Letters, 2008, 11(3): 296- 310.
[11] Finlay B J. Global dispersal of free-living microbial eukaryote species. Science, 2002, 296(5570): 1061- 1063.
[12] O′Malley M A. The nineteenth century roots of ′everything is everywhere′. Nature Reviews Microbiology, 2007, 5(8): 647- 651.
[13] Fierer N, Jackson R B. The diversity and biogeography of soil bacterial communities. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(3): 626- 631.
[14] Shen C C, Ni Y Y, Liang W J, Wang J J, Chu H Y. Distinct soil bacterial communities along a small-scale elevational gradient in alpine tundra. Frontiers in Microbiology, 2015, 6: 582.
[15] Li G X, Xu G R, Shen C C, Tang Y, Zhang Y X, Ma K M. Contrasting elevational diversity patterns for soil bacteria between two ecosystems divided by the treeline. Science China Life Sciences, 2016, 59(11): 1177- 1186.
[16] Bryant J A, Lamanna C, Morlon H, Kerkhoff A J, Enquist B J, Green J L. Microbes on mountainsides: contrasting elevational patterns of bacterial and plant diversity. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(S1): 11505- 11511.
[17] Fierer N, McCain C M, Meir P, Zimmermann M, Rapp J M, Silman M R, Knight R. Microbes do not follow the elevational diversity patterns of plants and animals. Ecology, 2011, 92(4): 797- 804.
[18] Singh D, Takahashi K, Kim M, Chun J, Adams J M. A hump-backed trend in bacterial diversity with elevation on Mount Fuji, Japan. Microbial Ecology, 2012, 63(2): 429- 437.
[19] Ren L J, Jeppesen E, He D, Wang J J, Liboriussen L, Xing P, Wu Q L. pH influences the importance of niche-related and neutral processes in Lacustrine bacterioplankton assembly. Applied and Environmental Microbiology, 2015, 81(9): 3104- 3114.
[20] Zhang Y G, Cong J, Lu H, Li G L, Xue Y D, Deng Y, Li H, Zhou J Z, Li D Q. Soil bacterial diversity patterns and drivers along an elevational gradient on Shennongjia Mountain, China. Microbial Biotechnology, 2015, 8(4): 739- 746.
[21] Woese C R. Bacterial evolution. Microbiological Reviews, 1987, 51(2): 221- 271.
[22] Martiny J B H, Bohannan B J M, Brown J H, Colwell R K, Fuhrman J A, Green J L, Horner-Devine M C, Kane M, Krumins J A, Kuske C R, Morin P J, Naeem S, Ovreås L, Reysenbach A L, Smith V H, Staley J T. Microbial biogeography: putting microorganisms on the map. Nature Reviews Microbiology, 2006, 4(2): 102- 112.
[23] Shen C C, Xiong J B, Zhang H Y, Feng Y Z, Lin X G, Li X Y, Liang W J, Chu H Y. Soil pH drives the spatial distribution of bacterial communities along elevation on Changbai Mountain. Soil Biology and Biochemistry, 2013, 57: 204- 211.
[24] Singh D, Lee-Cruz L, Kim W S, Kerfahi D, Chun J H, Adams J M. Strong elevational trends in soil bacterial community composition on Mt. Halla, South Korea. Soil Biology and Biochemistry, 2014, 68:140- 149.
[25] Wang J T, Cao P, Hu H W, Li J, Han L L, Zhang L M, Zheng Y M, He J Z. Altitudinal distribution patterns of soil bacterial and archaeal communities along Mt. Shegyla on the Tibetan Plateau. Microbial Ecology, 2015, 69(1): 135- 145.
[26] Gai J P, Tian H, Yang F Y, Christie P, Li X L, Klironomos J N. Arbuscular mycorrhizal fungal diversity along a Tibetan elevation gradient. Pedobiologia, 2012, 55(3): 145- 151.
[27] Liu L, Hart M M, Zhang J L, Cai X B, Gai J P, Christie P, Li X L, Klironomos J N. Altitudinal distribution patterns of AM fungal assemblages in a Tibetan alpine grassland. FEMS Microbiology Ecology, 2015, 91(7): fiv078.
[28] Miyamoto Y, Nakano T, Hattori M, Nara K. The mid-domain effect in ectomycorrhizal fungi: range overlap along an elevation gradient on Mount Fuji, Japan. The ISME Journal, 2014, 8(8): 1739- 1746.
[29] Jarvis S G, Woodward S, Taylor A F S. Strong altitudinal partitioning in the distributions of ectomycorrhizal fungi along a short (300 m) elevation gradient. New Phytologist, 2015, 206(3): 1145- 1155.
[30] Shen C C, Liang W J, Shi Y, Lin X G, Zhang H Y, Wu X, Xie G, Chain P, Grogan P, Chu H Y. Contrasting elevational diversity patterns between eukaryotic soil microbes and plants. Ecology, 2014, 95(11): 3190- 3202.
[31] Wang J T, Zheng Y M, Hu H W, Zhang L M, Li J, He J Z. Soil pH determines the alpha diversity but not beta diversity of soil fungal community along altitude in a typical Tibetan forest ecosystem. Journal of Soils and Sediments, 2015, 15(5): 1224- 1232.
[32] Singh D, Takahashi K, Adams J M. Elevational patterns in archaeal diversity on Mt. Fuji. PloS One, 2012, 7(9): e44494.
[33] Warcup J H. The ecology of soil fungi. Transactions of the British Mycological Society, 1951, 34(3): 376- 399.
[34] Bruns T D, Bidartondo M I, Taylor D L. Host specificity in ectomycorrhizal communities: what do the exceptions tell us? Integrative and Comparative Biology, 2002, 42(2): 352- 359.
[35] 梁宇, 郭良栋, 马克平. 菌根真菌在生态系统中的作用. 植物生态学报, 2002, 26(6): 739- 745.
[36] 陈伟立, 李娟, 朱红惠, 陈杰忠, 姚青. 根际微生物调控植物根系构型研究进展. 生态学报, 2016, 36(17): 5285- 5297.
[37] Maron J L, Marler M, Klironomos J N, Cleveland C C. Soil fungal pathogens and the relationship between plant diversity and productivity. Ecology Letters, 2011, 14(1): 36- 41.
[38] Lugo M A, Ferrero M, Menoyo E, Estévez M C, Sieriz F, Anton A. Arbuscular mycorrhizal fungi and rhizospheric bacteria diversity along an altitudinal gradient in south American puna grassland. Microbial Ecology, 2008, 55(4): 705- 713.
[39] Shi Z Y, Wang F Y, Zhang K, Chen Y L. Diversity and distribution of arbuscular mycorrhizal fungi along altitudinal gradients in Mount Taibai of the Qinling Mountains. Canadian Journal of Microbiology, 2014, 60(12): 811- 818.
[40] Bahram M, Põlme S, Kõljalg U, Zarre S, Tedersoo L. Regional and local patterns of ectomycorrhizal fungal diversity and community structure along an altitudinal gradient in the Hyrcanian forests of northern Iran. New Phytologist, 2012, 193(2): 465- 473.
[41] Coince A, Cordier T, Lengellé J, Defossez E, Vacher C, Robin C, Buée M, Marçais B. Leaf and root-associated fungal assemblages do not follow similar elevational diversity patterns. PloS one, 2014, 9(6): e100668.
[42] Wu Y T, Wubet T, Trogisch S, Both S, Scholten T, Bruelheide H, Buscot F. Forest age and plant species composition determine the soil fungal community composition in a Chinese subtropical forest. PloS one, 2013, 8(6): e66829.
[43] 郭良栋. 中国微生物物种多样性研究进展. 生物多样性, 2012, 20(5): 572- 580.
[44] 贺纪正, 沈菊培, 张丽梅. 土壤中温泉古菌研究进展. 生态学报, 2009, 29(9): 5047- 5055.
[45] Zhang L M, Wang M, Prosser J I, Zheng Y M, He J Z. Altitude ammonia-oxidizing bacteria and archaea in soils of Mount Everest. FEMS Microbiology Ecology, 2009, 70(2): 208- 217.
[46] Yang Y F, Gao Y, Wang S P, Xu D P, Yu H, Wu L W, Lin Q Y, Hu Y G, Li X Z, He Z L, Deng Y, Zhou J Z. The microbial gene diversity along an elevation gradient of the Tibetan grassland. The ISME Journal, 2014, 8(2): 430- 440.
[47] Shen C C, Shi Y, Ni Y Y, Deng Y, Van Nostrand J D, He Z L, Zhou J Z, Chu H Y. Dramatic increases of soil microbial functional gene diversity at the treeline ecotone of Changbai Mountain. Frontiers in Microbiology, 2016, 7: 1184.
[48] Ding J J, Zhang Y G, Deng Y, Cong J, Lu H, Sun X, Yang C Y, Yuan T, Van Nostrand J D, Li D Q, Zhou J Z, Yang Y F. Integrated metagenomics and network analysis of soil microbial community of the forest timberline. Scientific reports, 2015, 5: 7994.
[49] Baasbecking L G M. Geobiologie of Inleiding Tot de Milieukunde. Van Stockum & Zoon, The Hague, 1934.
[50] Griffiths R I, Thomson B C, James P, Bell T, Bailey M, Whiteley A S. The bacterial biogeography of British soils. Environmental Microbiology, 2011, 13(6): 1642- 1654.
[51] Lauber C L, Hamady M, Knight R, Fierer N. Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale. Applied and Environmental Microbiology, 2009, 75(15): 5111- 5120.
[52] Prober S M, Leff J W, Bates S T, Borer E T, Firn J, Harpole W S, Lind E M, Seabloom E W, Adler P B, Bakker J D, Cleland E E, DeCrappeo N M, DeLorenze E, Hagenah N, Hautier Y, Hofmockel K S, Kirkman K P, Knops J M, La Pierre K J, MacDougall A S, McCulley R L, Mitchell C E, Risch A C, Schuetz M, Stevens C J, Williams R J, Fierer N. Plant diversity predicts beta but not alpha diversity of soil microbes across grasslands worldwide. Ecology Letters, 2015, 18(1): 85- 95.
[53] Singh D, Shi L L, Adams J M. Bacterial diversity in the mountains of south-west China: climate dominates over soil parameters. Journal of Microbiology, 2013, 51(4): 439- 447.
[54] De Deyn G B, Van der Putten W H. Linking aboveground and belowground diversity. Trends in Ecology & Evolution, 2005, 20(11): 625- 633.
[55] 高程, 郭良栋. 外生菌根真菌多样性的分布格局与维持机制研究进展. 生物多样性, 2013, 21(4): 488- 498.
[56] Webb C O, Ackerly D D, McPeek M A, Donoghue M J. Phylogenies and community ecology. Annual Review of Ecology and Systematics, 2002, 475- 505.
[57] Webb C O. Exploring the phylogenetic structure of ecological communities: an example for rain forest trees. The American Naturalist, 2000, 156(2): 145- 155.
[58] Cadotte M W, Davies T J, Regetz J, Kembel S W, Cleland E, Oakley T H. Phylogenetic diversity metrics for ecological communities: integrating species richness, abundance and evolutionary history. Ecology Letters, 2010, 13(1): 96- 105.
[59] Horner-Devine M C, Bohannan B J M. Phylogenetic clustering and overdispersion in bacterial communities. Ecology, 2006, 87(S7): S100-S108.
[60] Pommier T, Canbäck B, Riemann L, Boström K H, Simu K, Lundberg P, Tunlid A, Hagström Å. Global patterns of diversity and community structure in marine bacterioplankton. Molecular Ecology, 2007, 16(4): 867- 880.
[61] Barberán A, Casamayor E O. Global phylogenetic community structure and β-diversity patterns in surface bacterioplankton metacommunities. Aquatic Microbial Ecology, 2010, 59(1):1- 10.
[62] Pontarp M, Canbäck B, Tunlid A, Lundberg P. Phylogenetic analysis suggests that habitat filtering is structuring marine bacterial communities across the globe. Microbial Ecology, 2012, 64(1): 8- 17.
[63] Barberán A, Casamayor E O. A phylogenetic perspective on species diversity, β-diversity and biogeography for the microbial world. Molecular Ecology, 2014, 23(23): 5868- 5876.
[64] Wang J J, Soininen J, He J Z, Shen J. Phylogenetic clustering increases with elevation for microbes. Environmental Microbiology Reports, 2012, 4(2): 217- 226.
