阳离子双亲性多肽-脂质纳米粒子的构建及细胞毒性和体外稳定性
2018-04-19王乔,费浩
王 乔, 费 浩
(1.上海大学生命科学学院,上海200444;
2.中国科学院苏州纳米技术与纳米仿生研究所,江苏苏州215123)
高密度脂蛋白是体内天然存在的脂质纳米粒子,主要由脂质和载脂蛋白(Apo A-I等)组成,生物相容性好,体内循环时间长,是一种极具前景的药物载体[1-2].目前已有大量研究证明,在体外利用Apo A-I蛋白或其类似物可以将磷脂组装成类似高密度脂蛋白的纳米粒子,成功输送各种化合物或者多肽分子[3].Apo A-I蛋白由243个氨基酸组成,形成高度同源的10个双亲性螺旋结构[4].Apo A-I蛋白的模拟肽(如18A,4F多肽等)与Apo A-I蛋白在氨基酸组成上没有同源性,在二级结构上模拟Apo A-I蛋白,具有双亲性的螺旋结构,并且阴离子性氨基酸和阳离子性氨基酸按照A类螺旋构型分布[5-7].Apo A-I蛋白的模拟肽呈现电中性.此类双亲性螺旋多肽的疏水面与脂质的疏水头部相互作用,组成疏水性的内腔,亲水面与脂质的亲水性头部暴露于水溶液[8].在前期工作中,本课题组利用Apo A-I蛋白第10个螺旋上的多肽,成功构建了具有整合素靶向功能的脂质纳米粒子,实现了纳米粒子的靶向运输[9],并且为了进一步探究功能多肽是否可以通过脂质纳米粒子得到优化,选取了阳离子双亲性多肽进行验证.
阳离子双亲性多肽属于阳离子性抗菌肽,是由亲水和疏水氨基酸构成的α螺旋结构[10].此类多肽不但具有抗菌特性,而且对肿瘤细胞具有杀伤功能[11].大部分肿瘤细胞膜具有负电位,与阳离子双亲性多肽通过静电引力相互作用,将多肽吸附到细胞表面引起细胞膜的破坏或者进入细胞内部引起线粒体、细胞骨架等结构的破坏,从而引起肿瘤细胞的死亡[12-13].但是阳离子多肽稳定性差,易被多种酶消化降解,而借助适当的载体,可以提高多肽的稳定性.本工作利用阳离子双亲性多肽的螺旋结构,使多肽与脂质相互作用,形成类似高密度脂蛋白的纳米粒子,提升多肽的抗酶解能力.目前,对于阳离子双亲性多肽形成类高密度脂蛋白纳米粒子的研究还未见报道.
1 材料和方法
1.1 实验材料
二肉豆蔻酰磷脂酰胆碱(dimyristoyl phosphatidyl choline,DMPC)购自Avanti公司;胆固醇油酸(cholesterol oleate,CO)、噻唑蓝(MTT)购自Sigma公司;DMEM(High)培养基,RPMI 1640培养基、胎牛血清购自Hyclone公司;R多肽(纯度>95%,相对分子质量为1 849.31)由上海波肽公司合成;二甲基亚砜(dimethyl sulphoxide,DMSO)、三氯甲烷等试剂购自国药集团;糜蛋白酶和胰蛋白酶购自阿拉丁公司;96孔板、细胞培养皿购自Corning公司.
1.2 实验方法
1.2.1 多肽定量
将上海波肽公司合成的多肽通过nanodrop测定肽键在205 nm的吸收值,进行准确定量后使用.
1.2.2 脂质纳米粒子的制备
3µmol DMPC,0.1µmol CO溶于氯仿溶液,置于圆底离心管内,用稳定的氮气流室温挥发氯仿1 h,混合物在离心管底部形成薄膜;加入1 mL磷酸缓冲液(phosphate buあer saline,PBS)(pH=7.4),室温涡旋震荡10 min,形成乳白色的乳浊液;充入氮气,密封,在48◦C水浴、功率200 W条件下,超声1 h,形成DMPC/CO乳浊液;滴加等体积R多肽溶液,多肽与DMPC的摩尔比为1∶10,4◦C放置过夜,得到脂质纳米粒子.脂质纳米粒子通过100 kD的超滤管进行纯化,去除游离的多肽、DMPC和CO分子.
1.2.3 脂质乳浊液清除实验
按照1.2.2节方法,在滴加多肽之前,获得DMPC/CO乳浊液.取96孔板,每孔加入100µL乳浊液和100µL R多肽(多肽与脂质的摩尔比为1∶10),室温孵育,测定不同时间点溶液的吸收值(490 nm),表征多肽与脂质相互作用的动力学过程.
1.2.4 色氨酸荧光光谱蓝移实验
按照1.2.2节方法制备R多肽-脂质纳米粒子(R peptide-lipid nanoparticle,R-LNP).R-LNP和R多肽用PBS稀释至0.2 mg/mL,测定两个样品的荧光光谱(激发光波长为295 nm).
1.2.5 透射电子显微镜检测
将10µL脂质纳米粒子溶液滴在23目透射电子显微镜(transmission electron microscope,TEM)专用铜网上,红外干燥2 min,滴加3%磷钨酸溶液,室温静置1 min,吸掉残留的磷钨酸溶液,在干燥器内充分干燥,用120 kV的透射电子显微镜(Tecnai G2 F20 S-TWIN)进行观察拍照.
1.2.6 动态光散射(dynamic light scattering,DLS)和zeta电位检测
超滤纯化后的R-LNP稀释至0.05 mg/mL(多肽质量浓度),取1 mL加入样品池中,用NANOPHOX(Malvern)粒度仪进行粒子直径和电位测量.
1.2.7 细胞培养
人体肺癌上皮细胞系A549、人乳腺癌细胞系MCF-7购自中国科学院生命科学研究院生物化学与分子生物学研究所.A549和MCF-7细胞培养于RPMI 1640培养基(添加10%胎牛血清和1%青霉素/链霉素双抗溶液),两种细胞均生长于37◦C,5%CO2培养箱中.
1.2.8 细胞毒性检测
取2块96孔板,分别接种A549和MCF-7细胞,细胞密度为1×104个/孔,每组设置3个复孔,在细胞培养箱中正常培养24 h;吸掉培养基,加入含有不同质量浓度R多肽或R-LNP的新鲜培养基,孵育24 h;吸掉上清,加入100µL含有20%MTT(5 mg/mL)的新鲜培养基,继续孵育4 h;吸掉上清,每孔加入150µL DMSO,室温震荡孵育20 min,测量每个样品孔在490 nm的吸收值,计算细胞的存活率.
1.2.9 稳定性检测
超滤纯化的R-LNP与R多肽稀释到0.3 mg/mL,与糜蛋白酶和胰蛋白酶在37◦C条件下孵育,两种酶的孵育质量浓度分别为3.20和0.24µg/mL,孵育时间为60 min;孵育完毕,加入1/2体积的乙腈震荡1 min,采用10 kD超滤管进行超滤,去除较大的酶分子,进行超高效液相色谱(ultra high performance liquid chromatography,UPLC)分析.
2 实验结果
本工作选用阳离子双亲性R多肽(RLARLLRRLARWLR)进行研究,其螺旋结构的轮状如图1所示.R多肽的亲水性氨基酸和疏水性氨基酸分别分布在螺旋的两侧,蓝色区域代表亲水性氨基酸(精氨酸),黄色区域代表疏水性氨基酸(亮氨酸和色氨酸),灰色区域代表疏水性较弱的丙氨酸.
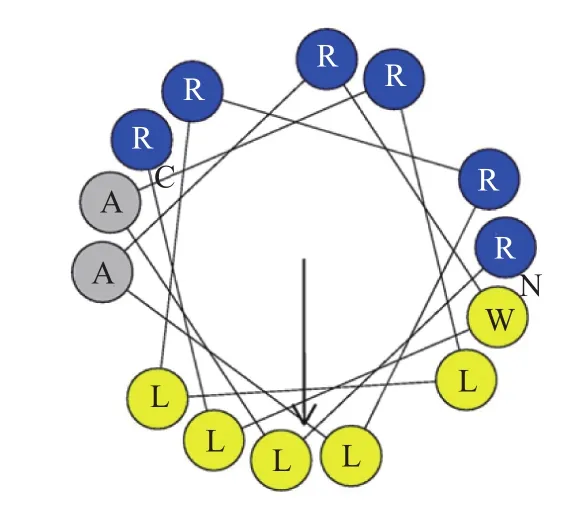
图1 R多肽(RLARLLRRLARWLR)的螺旋结构轮状图Fig.1 Helical wheel presentations of R peptide(RLARLLRRLARWLR)
2.1 R多肽与脂质相互作用分析
通过脂质乳浊液清除实验,检测R多肽促进DMPC/CO乳浊液的重组.如图2所示,R多肽瞬间降低乳浊液的浑浊度,随后浑浊度继续下降,直至平衡.此现象表明R多肽促进了脂质的重组,形成粒径较小的脂质纳米粒子.当多肽充分与脂质结合后,通过R-LNP进行超滤纯化,测定R多肽中色氨酸荧光光谱的变化.如图3所示,R-LNP中R多肽的荧光光谱出现9 nm的蓝移,表明色氨酸所处的环境发生了改变,说明R多肽的疏水性部分嵌入了脂质纳米粒子的疏水核心中.
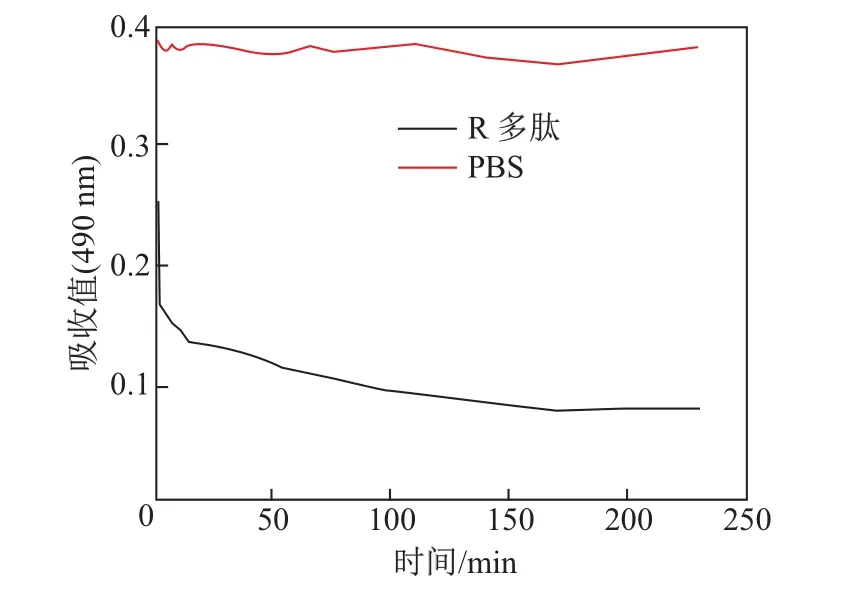
图2 脂质乳浊液清除实验Fig.2 Lipid emulsion clearance assay
2.2 R-LNP的形貌和表面性质
R-LNP在120 kV的TEM形貌观测结果如图4所示,可见R-LNP呈现规则的圆形、粒径均一、分散性好.根据DLS测量,R-LNP的平均粒径为(14.7±0.1)nm(见图5).进一步对R-LNP表面的zeta电位进行表征(见图6),可知R-LNP的电位为17.8 mV,说明粒子在溶液中稳定.上述结果均表明R多肽可以与脂质相互作用,形成形貌规则、粒径均一、表面性质良好的纳米颗粒.

图3 色氨酸荧光光谱蓝移实验Fig.3 Blue shift of TRP f l uorescence assay

图4 R-LNP的TEM形貌Fig.4 TEM image of R-LNP
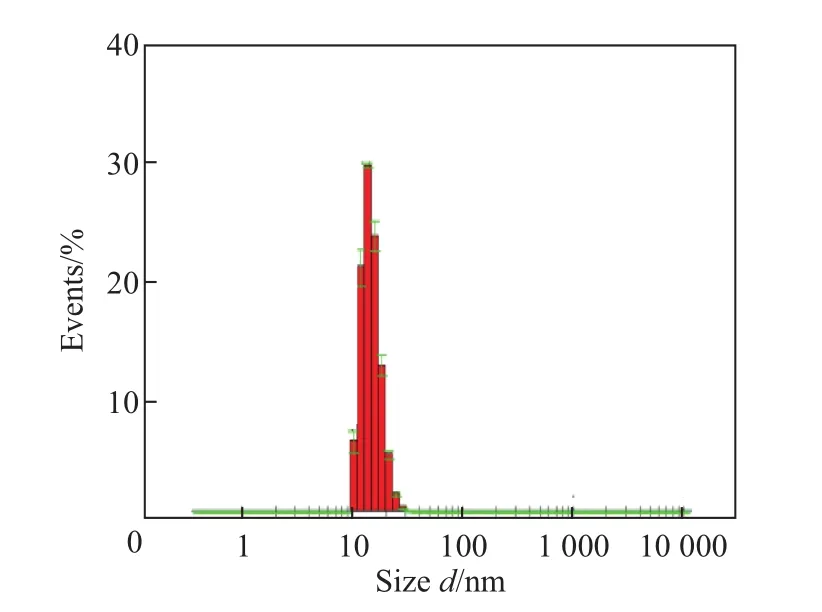
图5 R-LNP的DLS测量Fig.5 DLS measurement of R-LNP
2.3 R-LNP的细胞毒性检测
R多肽对癌细胞具有明显的杀伤作用.本实验对R-LNP和R多肽在两种不同的癌细胞(A549,MCF-7)中的杀伤作用进行比较,检测R-LNP是否保持R多肽的细胞杀伤作用.如图7所示,在A549和MCF-7细胞中,R-LNP和R多肽呈现类似的MTT曲线,表现出相似的杀伤作用.进一步的定量数据如表1所示,R-LNP与R多肽在A549细胞中的IC50分别为(5.93±0.75)和(7.45±0.74)µmol/L,在MCF-7细胞中的IC50分别为(4.36±0.40)和(6.58±0.50)µmol/L.根据实验结果可知,R多肽与脂质相互作用形成的R-LNP并没有降低R多肽的癌细胞杀伤能力.
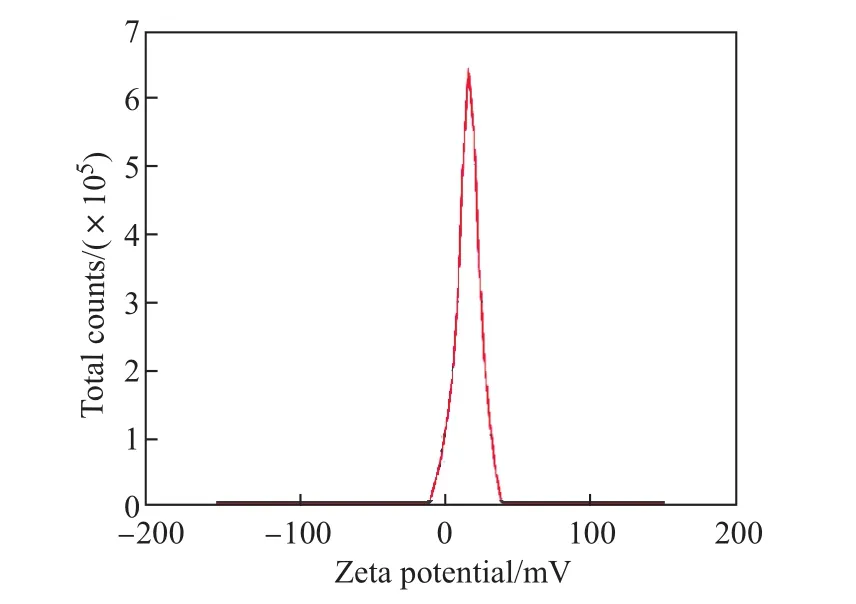
图6 R-LNP的zeta电位测量Fig.6 Zeta potential measurement of R-LNP
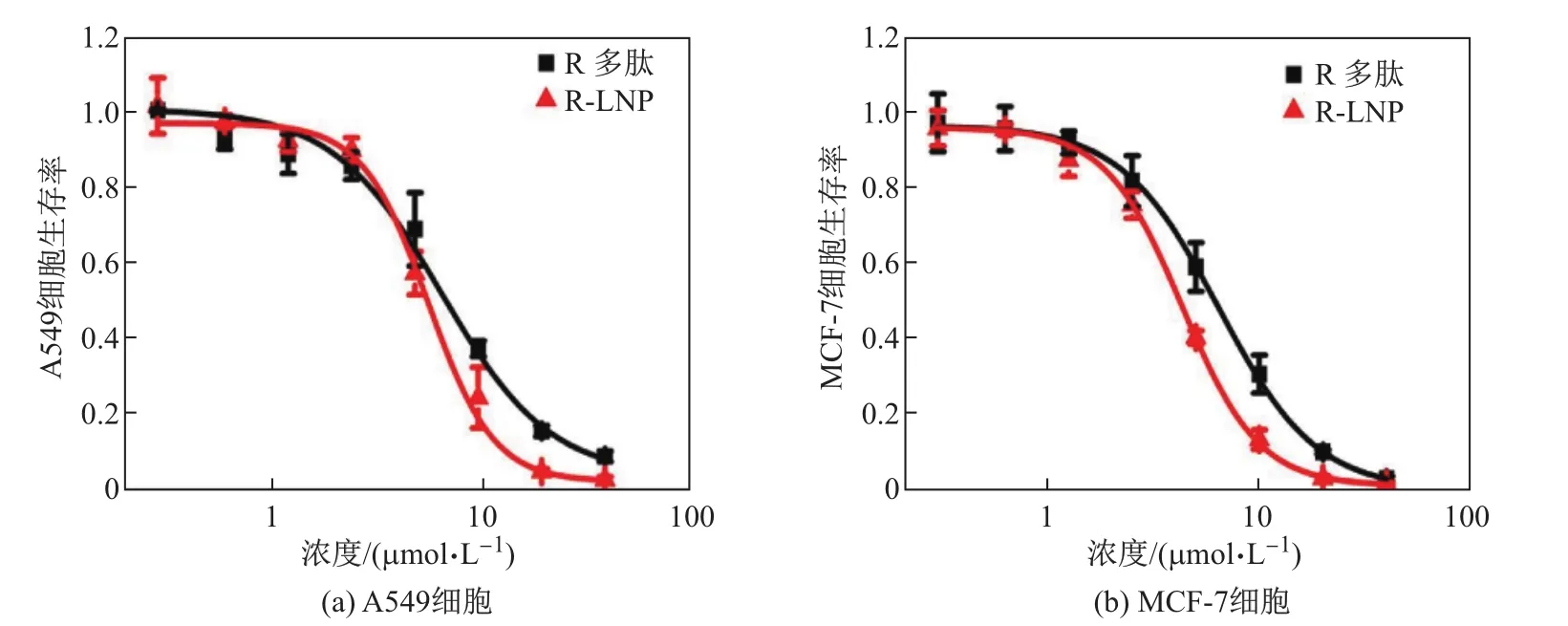
图7 R多肽和R-LNP对A549,MCF-7细胞的MTT实验Fig.7 MTT assay of R peptide and R-LNP for A549,MCF-7 cells
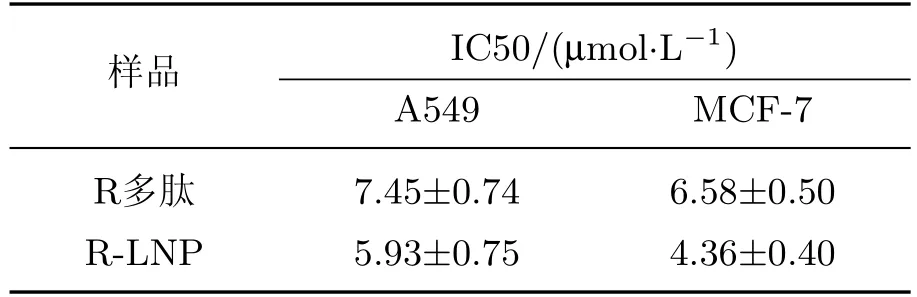
表1 R多肽与R-LNP细胞毒性数据Table 1 Cytotoxicity data of R peptide and R-LNP
2.4 R-LNP稳定性检测
R-LNP利用脂质作为载体,保护R多肽的疏水氨基酸,可能会增强多肽的抗酶解能力.R多肽与R-LNP分别与糜蛋白酶(3.20µg/mL)、胰蛋白酶(0.24µg/mL)在37◦C条件下孵育60 min,通过UPLC分析比较二者的抗酶解能力.如图8(a)和(b)所示,R多肽与R-LNP在滞留时间2.4 min左右出现目标峰;与蛋白酶孵育后R多肽在2.4 min的主峰迅速下降,出现较多杂峰,如图8(c),(e)所示;而R-LNP大大降低了多肽被降解的程度,表现出较好的稳定性,如图8(d),(f)所示.
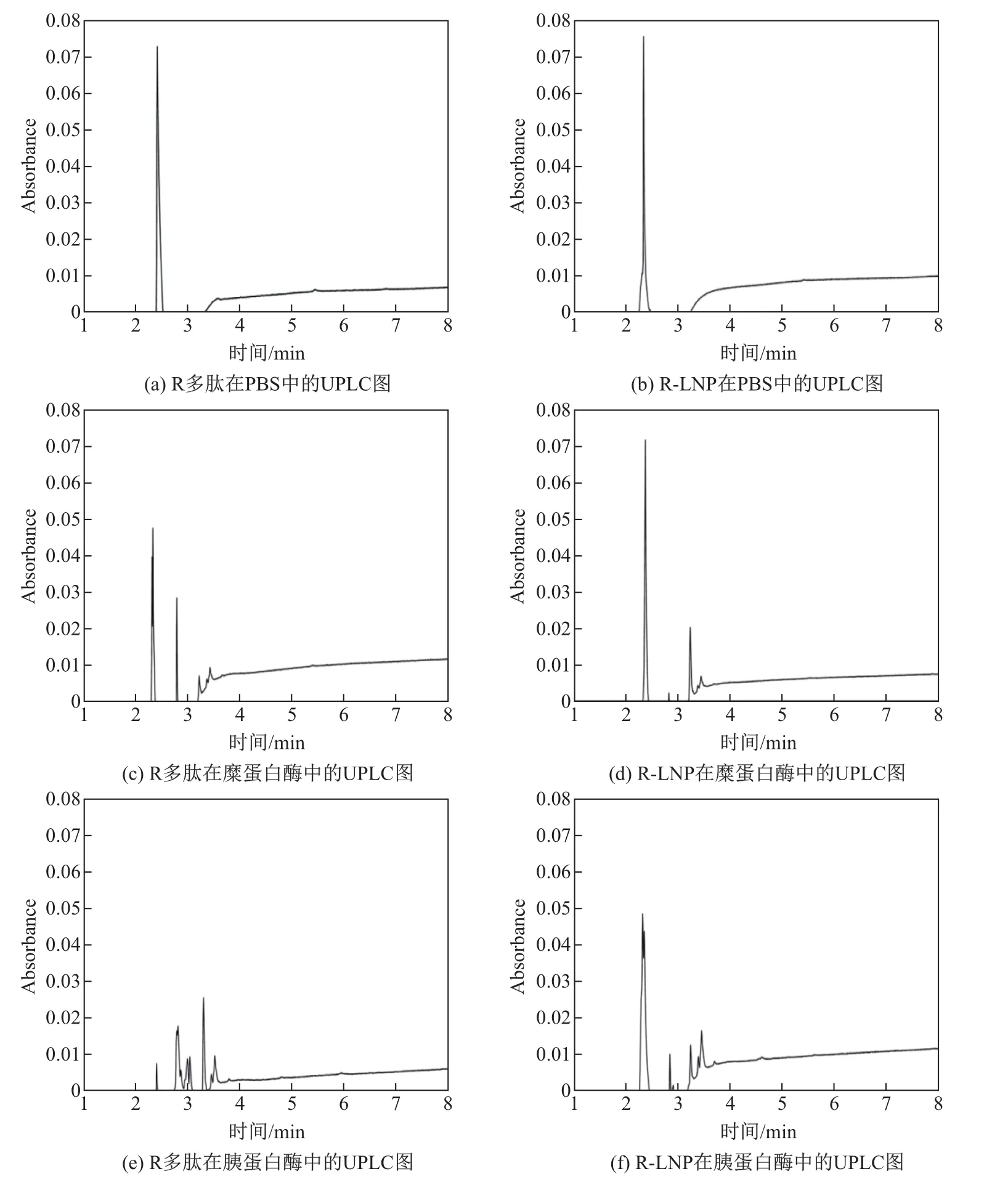
图8 R多肽和R-LNP的稳定性检测Fig.8 Stability evaluation of R peptide and R-LNP
3 讨论
本工作利用多肽-脂质纳米粒子的特殊组成和优良功能,选取具有细胞毒性的阳离子双亲性R多肽(RLARLLRRLARWLR)作为研究对象.具有双亲性螺旋结构的R多肽与脂质形成的多层囊泡结构相互作用,促使脂质发生重组,克服表面张力作用,形成粒径较小的纳米粒子.在此重组过程中,脂质乳浊液的浑浊度下降.通过测定混合物在490 nm处吸收值的改变可以检测多肽与脂质相互作用的动力学过程.当多肽充分与脂质结合后,R多肽疏水性部分嵌入磷脂分子中,亲水性部分暴露于脂质纳米粒子表面,色氨酸由水溶液环境转移到疏水环境中,伴随有荧光光谱的变化,即蓝移现象,这一现象与已有研究结果相符[14].除此之外,带有正电荷的精氨酸暴露于脂质纳米粒子的亲水面,导致脂质纳米粒子表面的zeta电位呈现17.8 mV的正电性.R-LNP的疏水性氨基酸(亮氨酸)埋藏于脂质分子中,降低了与糜蛋白酶接触的可能性,同时亲水性氨基酸(精氨酸)受到表面磷脂分子空间位阻的作用,与胰蛋白的作用降低,有助于提高多肽对这两种酶的抗酶解能力.多肽在体内易被降解和清除[15],从而大大降低了多肽的治疗作用,而R-LNP以纳米粒子形式进入体内有可能延长R多肽在体内的滞留时间和改善治疗效果,这部分研究有待于进一步验证.近年来,研究人员在利用多肽包裹或修饰脂质纳米粒子的工作中取得了很大进展,Luo等[16]和Hunag等[17]利用逆序的4F多肽与鼻咽癌靶向肽或蜂毒肽共价结合,实现了纳米粒子的靶向输送或蜂毒肽溶血性的改善.本课题组将Apo A-I第10个螺旋上的一段多肽通过环化的RGD进行二价化,大大提升了脂质纳米粒子的稳定性,同时赋予纳米粒子靶向整合素的特性.由此可知,多肽-脂质纳米粒子具有很好的灵活性,易进行修饰和改造.此外,也有研究利用固体脂质纳米粒子或聚合物纳米粒子优化多肽的性质[18],但是实现多肽的进一步改造或纳米粒子的多功能化仍较困难.未来可以通过进一步设计,在R多肽的基础上添加靶向序列,增强纳米粒子的特异性;利用不同电荷性质的脂质进行纳米颗粒的修饰,屏蔽纳米粒子表面的正电荷,避免其与阴离子物质相互作用,进一步提升纳米粒子的稳定性;在脂质纳米粒子疏水核心添加具有成像等功能的疏水性化合物,实现多功能一体化目标.
参考文献:
[1]GOGONEA V.Structural insights into high density lipoprotein:old models and new facts[J].Front Pharmacol,2015,DOI:10.3389/fphar.2015.00318.
[2]王若宁,刘聪燕,周建平,等.脂蛋白纳米药物传输系统研究进展[J].中国药科大学学报,2014,45(1):10-16.
[3]HUANG H,CRUZ W,CHEN J,et al.Learning from biology:synthetic lipoproteins for drug delivery[J].Wires Nanomed Nanobi,2015,7(3):298-314.
[4]BROUILLETTE C G,ANANTHARAMAIAH G M.Structural models of human apolipoprotein A-I[J].Biochimica et Biophysica Acta,1995,1256(2):103-129.
[5]CHUNG B H,ANATHARAMAIAH G M,BROUILLETTE C G,et al.Studies of synthetic peptide analogs of the amphipathic helix.Correlation of structure with function[J].J Biol Chem,1985,260(18):10256-10262.
[6]DATTA G,CHADDHA M,HAMA S,et al.Eあects of increasing hydrophobicity on the physicalchemical and biological properties of a class A amphipathic helical peptide[J].J Lipid Res,2001,42(7):1096-1104.
[7]GARBER D W,HANDATTU S P,DATTA G,et al.Atherosclerosis and vascular disease:eあects of peptide mimetics of apolipoproteins[J].Curr Pharm Biotechnol,2006,7(4):235-240.
[8]MISHRA V K,PALGUNACHARI M N,SEGREST J P,et al.Interactions of synthetic peptide analogs of the class A amphipathic helix with lipids:evidence for the snorkel hypothesis[J].J Biol Chem,1994,269(10):7185-7191.
[9]WANG Q,MA X,FEI H,et al.A peptide-lipid nanoparticle assembly platform with integrated functions for targeted cell delivery[J].J Mater Chem B,2016,4(8):1535-1543.
[10]MADER J S,HOSKIN D W.Cationic antimicrobial peptides as novel cytotoxic agents for cancer treatment[J].Expert Opin Inv Drug,2006,15(8):933-946.
[11]GASPAR D,VEIGA A S,CASTANHO M A R B.From antimicrobial to anticancer peptides.A review[J].Front Microbiol,2013,4:1-16.
[12]LEUSCHNER C,HANSEL W.Membrane disrupting lytic peptides for cancer treatments[J].Curr Pharm Design,2004,10(19):2299-2310.
[13]潘广瑞,赵晖.抗菌肽在肿瘤方面的研究进展[J].医学综述,2015,21(18):3318-3320.
[14]MISHRA V K,PALGUNACHARI M N.Interaction of model class A1,class A2,and class Y amphipathic helical peptides with membranes[J].Biochemistry,1996,35(34):11210-11220.
[15]王克全,徐寒梅.多肽类药物的研究进展[J].药学进展,2015,39(9):642-650.
[16]LUO H M,LU L S,YANG F,et al.Nasopharyngeal cancer-specif i c therapy based on fusion peptide-functionalized lipid nanoparticles[J].ACS Nano,2014,8(5):4334-4347.
[17]HUANG C,JIN H L,QIAN Y,et al.Hybrid melittin cytolytic peptide-driven ultrasmall lipid nanoparticles block melanoma growth in vivo[J].ACS Nano,2013,7(7):5791-5800.
[18]ASHABEN P,KISHORE C,MITRA A K.Recent developments in protein and peptide parenteral delivery approaches[J].Ther Deliv,2014,5(3):337-365.本文彩色版可登陆本刊网站查询:http://www.journal.shu.edu.cn
