PKC抑制剂对甲醛诱导的内脏炎性痛大鼠脊髓ERK1/2磷酸化的影响*
2018-04-19张家君张灿文牛敬忠胡冬梅杨明峰张颜波
张家君 岳 伟 张灿文 牛敬忠 胡冬梅 袁 慧 杨明峰 张颜波△
(泰山医学院附属医院1超声科;2消化科;3神经内科,泰安271000)
炎症肠道疾病和癌症相关性内脏痛是临床上常见的内脏痛,内脏炎症痛机制和治疗是目前国内外研究的热点、难点。内脏痛发病机制尚不明确,其研究远远落后于躯体痛,严重影响了内脏痛病人的治疗与预后。众多信号分子、受体在内脏痛觉特别是痛觉敏感化形成和维持中起重要作用,是目前研究的主要方向[1~5]。我们既往的研究发现,大鼠脊髓内PKC及其PKCγ、PKCε亚型参与甲醛内脏炎症痛发生、发展过程;Galan等和Sakurai等研究发现,脊髓和脊神经节内ERK参与内脏炎症痛痛觉敏感化的维持PKC、ERK1/2已经作为内脏炎症痛新型药物治疗靶点[6~8]。ERK1/2是否作为PKC的下游信号通路在内脏炎症痛发病机制中起重要作用,对内脏炎症痛靶向治疗具有重要意义。所以本实验利用甲醛直肠黏膜下注射内脏炎症痛大鼠模型[6,9~11],通过蛛网膜下腔注射给予PKC抑制剂H-7,观察H-7对内脏炎症痛大鼠脊髓ERK1/2磷酸化水平的影响,探讨PKC- ERK1/2信号通路在内脏炎症痛发病机制中的作用。
方 法
1.试剂与材料
H-7(Sigma公司,美国),甲醛、戊巴比妥钠(北京西中化工厂),PE-10管(ID:0.28 mm; OD:0.61 mm,Becton Dickinson公司,美国),有机玻璃行为学观察箱(首都医科大学神经生物研究室制),大鼠手持直肠窥器(专利号:CN200820173538.2),兔ERK 1/2一抗、兔p-ERK 1/2一抗、actin一抗、辣根过氧化物酶标记的羊抗兔抗体(美国Santa Cruz公司,美国),ECL反应底物(Bio-Rad公司,美国),BCA蛋白分析试剂盒(PIERCE公司,美国),Gel Doc凝胶成像分析系统(Bio-Rad公司,美国)。
2.实验动物及分组
选用清洁级雄性SD大鼠(重200~250 g,山东省中医药大学实验动物中心提供,实验动物许可证号:SCXK(鲁)2005-0015),实验随机分为5组:正常对照组(N组);甲醛(formalin, F)直肠致炎组(F组);甲醛直肠致炎和脊髓蛛网膜下腔内插管(intrathecal, IT)组(IT组);甲醛直肠致炎、脊髓蛛网膜下腔内插管并注射生理盐水组(NaCl组);甲醛直肠致炎、脊髓蛛网膜下腔内插管并注射H-7组( H-7组);每组大鼠24只,共120只。
3.脊髓蛛网膜下腔内插管及给药
根据我们实验室既往成熟方法[6,9~11],用PE-10管插入大鼠脊髓蛛网膜下腔,插入长度7.5 cm,外端留有4.5 cm左右。本实验中NaCl和H-7组,分别在甲醛直肠致炎前30 min经PE-10插管注射20 μl 0.9% NaCl、20 μl H-7 溶液(含 5 μg H-7),然后注入10 μl 0.9% NaCl冲洗插管,保证注射药品全部进入蛛网膜下腔。
4.内脏炎症痛模型复制
根据我们实验室既往成熟方法[6,9~11],大鼠乙醚持续麻醉,经肛门插入自制的直肠窥器(专利号:CN200820173538.2),距肛门约35 mm处,用针长8 cm的1 ml注射器于直肠黏膜下注射100 μl 5%的甲醛。
5.内脏痛行为学观察
甲醛致痛后,大鼠共有4种疼痛行为:①舔腹(L);②伸腰(B);③侧扭(C);④全身收缩(W)。疼痛评分公式计算:S = 1L + 2B + 3C + 4W。L,B,C和W代表在一段时间内相应行为的次数。4组大鼠,每组8只,每15 min进行一次疼痛计分,连续记录大鼠的行为120 min[6,9~11]。行为学实验的大鼠在120 min观察后进行ERK1/2磷酸化水平检测。
6. ERK1/2磷酸化水平检测
在甲醛造模后30 min、60 min和120 min取出L6-S1节段脊髓,根据我们既往的方法进行ERK1/2磷酸化检测[9]。磷酸化ERK1/2 的蛋白检测后,同一张NC膜,再与总ERK1/2抗体进行第二次Western blot 杂交反应,获得ERK1/2总蛋白印迹结果。Gel Doc凝胶成像分析系统同时进行actin水平检测,ERK1/2相对磷酸化水平以p-ERK1/2与ERK1/2的比值表示。
7.统计学方法
结 果
1. PKC抑制剂H-7减轻内脏炎症痛疼痛反应
4个实验组大鼠在注射甲醛后30 min均达到疼痛评分的最大值,从注射甲醛后45 min至120 min内,疼痛评分逐渐降低。前60 min内行为表现主要以W、C、B反应为主;而在后60 min内主要以L反应为主。F、IT、NaCl组和H-7组大鼠在注射甲醛后30 min均达到疼痛评分的最大值,从注射甲醛后45 min至120 min内,疼痛评分逐渐降低,120 min时疼痛评分正常。H-7组在前90 min内疼痛分数显著低于 F组 (P< 0.05或P< 0.01),F分别与IT、NaCl组相比未见显著性差异(P> 0.05,见表1)。
2.内脏炎症痛大鼠脊髓ERK1/2磷酸化水平增加
与N组相比,F组甲醛直肠黏膜注射后脊髓ERK1/2磷酸化水平增加,30 min时达最高水平,60 min时仍高于对照组,有显著性差异(P< 0.05或P< 0.01);60 min后磷酸化水平逐渐下降,120 min时磷酸化水平与N组相比,无显著性差异(P> 0.05)。IT组、NaCl组与F组相比,无显著性差异(P> 0.05,见图1~4)。
3. PKC抑制剂H-7降低内脏炎症痛大鼠脊髓ERK1/2磷酸化水平
与N相比,H-7组甲醛直肠黏膜注射后脊髓ERK1/2磷酸化水平也增加,30 min时达最高水平,60 min时仍高于对照组,有显著性差异(P< 0.05或P< 0.01);60 min后逐渐下降,120 min时下降至正常水平(P> 0.05)。在甲醛注射后60 min内,H-7组与F组相比,ERK1/2磷酸化水平明显下降,有显著性差异 (P< 0.05或P< 0.01),120 min时无显著性差异(P> 0.05,见图1~4)。
讨 论
在临床中由炎症而导致的内脏炎症痛非常常见,而且炎症也是导致内脏器官痛敏的最常见原因,常伴随一系列的征候群,如肠易激综合症(irritable bowel syndrome, IBS)等。内脏痛与躯体痛发病机制不同,所以内脏痛与躯体痛对镇痛药物的疗效也不相同。与躯体痛相比,在炎性肠道疾病疼痛的治疗中,应用阿片类药物会导致较高的副作用和死亡率;同样应用非甾体抗炎药(nonsteroidal anti-inflammatory drugs, NSAIDs)镇痛效果也不理想[4]。所以研发新型、有效的内脏炎症痛镇痛药物迫在眉睫。信号通路将是内脏炎症痛新型镇痛药物的研发方向,针对多个信号通路联合药物镇痛治疗优于单一药物,联合治疗是内脏痛治疗原则[4,12]。根据既往我们研究基础和目前国内外进展,所以本研究选择PKC、ERK1/2两条信号通路进行研究,并且将PKC、ERK1/2作为一条上下游信号通路进行研究,是本研究的一个创新点。
表1 注射甲醛后各组不同时间段的疼痛分数(min,±SD)Table 1 Pain scores of different time periods after formalin injection (min,±SD)

表1 注射甲醛后各组不同时间段的疼痛分数(min,±SD)Table 1 Pain scores of different time periods after formalin injection (min,±SD)
F: formalin group; IT: intrathecal group; NaCl: NaCl group; H-7: H-7 group. *P < 0.05, **P < 0.01, compared with F group.
Group Pain Score 15 30 45 60 75 90 105 120 F 60.32±6.47 88.47±7.89 47.56±4.56 25.98±3.04 14.78±2.32 10.35±1.79 3.41±1.65 3.22±0.97 IT 64.78±7.06 89.45±7.65 48.78±5.01 22.47±3.65 13.41±2.74 11.01±2.01 3.73±1.78 3.34±0.87 NaCl 62.62±6.14 86.25±8.03 49.45±4.54 24.45±3.17 14.14±2.98 9.88±2.74 4.87±1.58 3.25±0.96 H-7 44.52±5.18** 65.78±6.65** 35.74±4.65** 16.42±3.89* 8.57±2.69* 5.36±1.87* 3.58±1.54 3.52±1.12
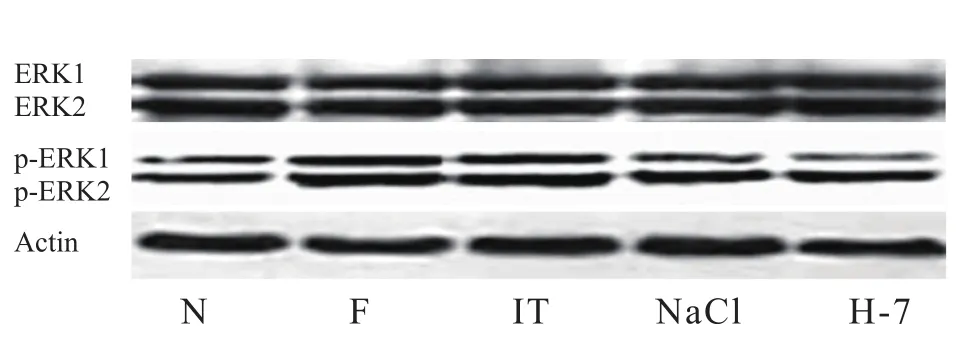
图1 注射甲醛后30 min ERK1/2磷酸化水平Fig.1 Phosphorylation of ERK1/2 at 30 minutes after formalin injection

图2 注射甲醛后60 min ERK1/2磷酸化水平Fig.2 Phosphorylation of ERK1/2 at 60 minutes after formalin injection

图3 ERK1磷酸化水平变化Fig.3 Changes of phosphorylation level of ERK1 N: Normal control group; F: Formalin group; IT:Intrathecal group; NaCl: NaCl group; H-7: H-7 group.
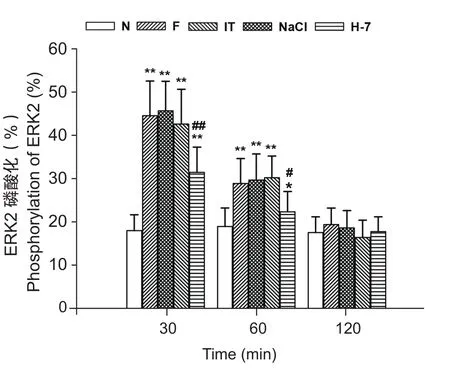
图4 ERK2磷酸化水平变化Fig.4 Changes of phosphorylation level of ERK2 N: Normal control group; F: Formalin group; IT:Intrathecal group; NaCl: NaCl group; H-7: H-7 group.
在本实验中,甲醛注射后30 min达到疼痛的高峰,注射90 min后,甲醛组和对照组相比,没有明显差异,我们的实验结果和Miampamba等人的结果一致[13],说明甲醛直肠黏膜下注射诱导内脏炎症痛模型,是国际上公认的、可靠的内脏痛模型,是内脏炎症痛的研究手段。PKC抑制剂H-7在甲醛注射后90 min内,能明显抑制内脏炎症痛行为反应,说明PKC抑制剂可作为内脏炎症痛的治疗药物。在甲醛注射30 min时ERK1/2磷酸化水平达最高水平,60 min仍高于对照组,说明ERK1/2参与内脏炎症痛的形成和维持过程;PKC抑制剂H-7在甲醛注射后60 min内能明显抑制ERK1/2磷酸化水平,说明ERK1/2可能作为PKC的下游信号通路参与了内脏炎症痛的发病机制。PKC-ERK1/2作为一条信号通路参与信号传导,这与目前国际上应用不同实验模型得出的结果一致[14~18]。El-Zein等研究发现,瘦素通过PKC/ERK信号通路抑制肠道葡萄糖的吸收[17];Sun[16]等也研究证实,Egr-1通过PKC/ERK信号通路介导慢性缺氧引起的肾间质纤维变性。
综上所述,PKC抑制剂H-7能降低内脏炎症痛疼痛评分和抑制脊髓ERK1/2磷酸化水平,ERK1/2是PKC的下游信号通路在内脏炎症痛发病机制中起重要作用,对内脏炎症痛靶向治疗具有重要意义。
[1]Gebhart GF, Bielefeldt K. Physiology of Visceral Pain.Compr Physiol, 2016, 6:1609 ~ 1633.
[2]Elsenbruch S, Enck P. Psychobiological mechanisms in the pathophysiology of chronic visceral pain. Schmerz,2016, 30:407 ~ 411.
[3]Johnson AC, Greenwood-Van Meerveld B. The Pharmacology of Visceral Pain. Adv Pharmacol, 2016,75:273 ~ 301.
[4]Davis MP. Drug management of visceral pain:concepts from basic research. Pain Res Treat, 2012,2012:265605.
[5]Yamanaka H, Noguchi K. Pathophysiology of neuropathic pain: molecular mechanisms underlying central sensitization in the dorsal horn in neuropathic pain. Brain Nerve, 2012, 64:1255 ~ 1265.
[6]Zhang Y, Gong K, Zhou W,et al. Involvement of subtypes γ and ε of protein kinase C in colon pain induced by formalin injection. Neurosignals, 2011,19:142 ~ 150.
[7]Galan A, Cervero F, Laird JM. Extracellular signalingregulated kinase-1 and -2 (ERK 1/2) mediate referred hyperalgesia in a murine model of visceral pain. Brain Res Mol Brain Res, 2003, 116:126 ~ 134.
[8]Sakurai J, Obata K, Ozaki N,et al. Activation of extracellular signal-regulated protein kinase in sensory neurons after noxious gastric distention and its involvement in acute visceral pain in rats.astroenterology, 2008, 134:1094 ~ 1103.
[9]Zhang YB, Guo ZD, Li MY,et al. Gabapentin Effects on PKC-ERK1/2 Signaling in the Spinal Cord of Rats with Formalin-Induced Visceral Inflammatory Pain.PLoS One, 2015, 10: e0141142.
[10]张颜波,牛敬忠,周卫华,等. cPKCs在大鼠内脏炎性痛形成中的作用.中华麻醉学杂志, 2008,28:249 ~ 252.
[11]张颜波,高翠英,李菁锦,等.大鼠福尔马林内脏炎症痛过程中脊髓PKC、PKCε膜转位的变化.中国疼痛医学杂志, 2005, 11(2): 91 ~ 95.
[12]Aziz Q, Botha C, Willert R. Pharmacology of visceral pain: central factors. Dig Dis, 2009, 27 (Suppl 1):31 ~ 41.
[13]Miampamba M, Chéry-Croze S, Gorry F,et al.In flammation of the colonic wall induced by formalin as a model of acute visceral pain. Pain, 1994, 57(3):327 ~334.
[14]Muscella A, Vetrugno C, Calabriso N,et al.[Pt(O,O'-acac)(γ-acac)(DMS)]Alters SH-SY5Y Cell Migration and Invasion by the Inhibition of Na+/H+Exchanger Isoform 1 Occurring through a PKC-ε/ERK/mTOR Pathway. PLoS One, 2014, 9(11): e112186.
[15]Jia K, Sun D, Ling S,et al. Activated δ-opioid receptors inhibit hydrogen peroxide-induced apoptosis in liver cancer cells through the PKC/ERK signaling pathway.Mol Med Rep, 2014, 10(2):839 ~ 847.
[16]Sun S, Ning X, Zhai Y,et al. Egr-1 mediates chronic hypoxia-induced renal interstitial fi brosis via the PKC/ERK pathway. Am J Nephrol, 2014, 39(5):436 ~448.
[17]El-Zein O, Kreydiyyeh SI. Leptin inhibits glucose intestinal absorption via PKC, p38MAPK, PI3K and MEK/ERK. PLoS One, 2013, 8(12): e83360.
[18]Zhou JR, Zhang LD, Wei HF,et al. Neuropeptide Y induces secretion of high-mobility group box 1 protein in mouse macrophage via PKC/ERK dependent pathway.J Neuroimmunol, 2013, 260(1-2):55 ~ 59.
