不同品种猕猴桃果实的理化性质及抗氧化活性
2018-04-18曹毛毛卢泽绵牛文倩曹丹丹
曹毛毛,卢泽绵,高 慧,令 阳,牛文倩,汪 钰,曹丹丹
(西北大学 食品科学与工程学院, 陕西 西安 710069)
猕猴桃,又称奇异果、羊桃,是一种营养丰富,口感酸甜,风味鲜美的水果,深受大众喜爱,有“水果之王”的美誉。猕猴桃含有丰富的VC、糖、酸、酚类物质以及氨基酸等重要营养成分和功能性成分,有较高的营养价值和医用价值,对人体健康有重要作用[1]。有研究表明,猕猴桃可清除体内活性氧自由基,为抗衰老研究提供了理论依据[2];刘若英[3]等人通过研究发现猕猴桃可改善机体对入侵菌和异物的清除,增强人体免疫功能;也有研究表明猕猴桃有明显降血脂,抗突变和抗畸变作用[4-6]。随着研究的深入,猕猴桃果实品质的优劣和抗氧化活性的高低越来越受到重视,但是近年来的研究大多数集中于猕猴桃单一品种的品质和活性研究。本文选取了7种不同品种的猕猴桃,对其理化性质和抗氧化活性进行了深入的研究,并对其做了进一步的分析与比较,旨在了解其品质特征,以期为合理利用猕猴桃资源提供科学依据。
1 材料与方法
1.1 材 料
7个猕猴桃品种:红阳、翠香、华优、徐香、海沃德、秦美、黄金果,均随机采自陕西省周至县同一果园。
1.2 实验试剂
1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl) hydrazyl, DPPH)、没食子酸、芦丁、2,6-二氯酚靛酚(2,6-dichlorophenolindophenol, DCPIP)购自美国Sigma公司;pBR322质粒DNA 购于日本Takara生物医药公司;其他试剂均为分析纯,购于西安化学试剂公司。
1.3 仪器与设备
数显手持便携式折光仪PAL-1(日本爱宕公司); 可见分光光度计722G(上海仪器分析仪器有限公司); DYY-11型电脑三恒多用电泳仪(北京市六一仪器厂); 旋转蒸发器RE-3000B(西安太康生物科技有限公司); 高速台式离心机7GL-16G(上海安亭科学仪器厂)。
1.4 测定方法
1.4.1理化指标测定水分质量分数测定按照GB/T 8858-1988方法测定[7];可溶性固形物质量分数采用数显手持便携式折光仪测定;可溶性蛋白含量采用考马斯亮蓝比色法[8]测定;VC含量采用2, 6-二氯靛酚滴定法[9]测定;叶绿素及类胡萝卜含量的测定参考Datt[10]的方法;总酚含量采用Folin-Ciocalteu法[11]测定,以没食子酸为标准品建立标准曲线;总黄酮含量的测定参考Marinova[12]等人的方法。
1.4.2抗氧化活性测定DPPH自由基清除能力测定参考Larrauri[13]等人的方法,并对不同提取样品体积下的DPPH自由基清除能力进行测定;Fe2+络合能力测定参考Singh[14]等人的方法并加以改进;Fe3+还原能力测定铁氰化钾-三氯化铁还原比色法[15]。
1.4.3对DNA氧化损伤的保护作用测定参考Yeung[16]等人的方法并加以修改,结合琼脂糖电泳和激光扫描等方法,观察了羟基自由基对质粒pBR322DNA的损伤及猕猴桃果实的防护效能。
1.5 数据处理
所得数据用Excel (2013)和SPSS (19.0)统计软件处理,利用Duncan′s新复极差法进行显著性分析。
2 结果与分析
2.1 不同品种猕猴桃果实理化性质的比较
2.1.1不同品种猕猴桃水分、可溶性固形物和可溶性蛋白含量的比较如表1所示,不同品种猕猴桃果实水分质量分数范围为79.82%~83.61%,其平均值为81.23%,这与前人的研究结果一致[17]。果实水分质量分数的高低与果实的硬度、色泽和糖酸比等品质指标直接相关[18],不同品种猕猴桃果实的口感和风味不同,可能受其水分质量分数不同的影响。不同品种猕猴桃的可溶性固形物之间均差异显著。其中,红阳和翠香的可溶性固形物质量分数最高,可达18%及以上,秦美最低,为10.83%。可溶性蛋白含量是评价果实品质和营养价值的重要指标之一[19]。不同品种猕猴桃果实可溶性蛋白质含量范围为8.79~10.51 mg/g,其平均值为9.77 mg/g,黄金果猕猴桃果实可溶性蛋白含量最高,为10.51 mg/g,海沃德最低,含量为8.79 mg/g。可溶性蛋白质能够直接参与植物适应逆境的过程,其含量能够反映植物的抗性水平和总代谢水平[20]。有研究发现,海沃德和秦美猕猴桃是易感病品种[21],这可能是本研究中此两品种可溶性蛋白含量较低的原因之一。
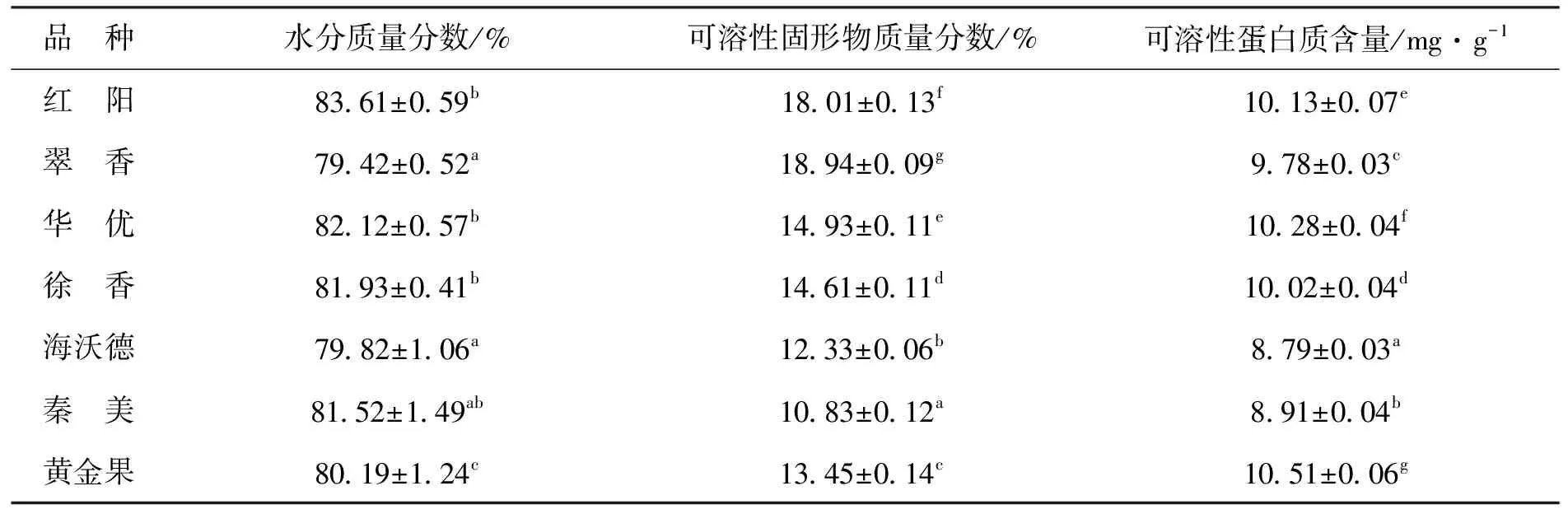
表1 不同品种猕猴桃水分含量、可溶性固形物和可溶性蛋白质含量的比较Tab.1 Comparison of water content, soluble solids, total acid and protein content in different kiwifruit varieties
注:同列小写字母不同表示差异显著(P<0.05)
2.1.2不同品种猕猴桃叶绿素和类胡萝卜素含量的比较有研究表明,猕猴桃果肉以绿色居多,黄色次之,红色最少[22]。不同品种猕猴桃果肉颜色不尽相同,可能与其叶绿素和类胡萝卜素含量有关。如表2所示,海沃德、徐香、秦美和翠香的叶绿素含量均较高,此研究结果与其果肉颜色呈绿色相一致。黄金果以黄色果肉著名,其类胡萝卜素含量远大于叶绿素含量,是叶绿素含量的2.83倍。红阳的最大特征是红心,红阳和华优的果肉均呈黄绿色,它们的叶绿素含量和类胡萝卜素含量之间的差异相对较小。

表2 不同品种猕猴桃叶绿素a、叶绿素b和类胡萝卜素的含量比较Tab.2 Comparison of chlorophyll a, chlorophyll b and carotenoids in different kiwifruit varieties
注:同列小写字母不同表示差异显著(P<0.05)
2.1.3不同品种猕猴桃VC、总酚和总黄酮含量的比较猕猴桃有较高的VC含量,有“VC之冠”的美誉,其VC含量较其他水果高几倍到几十倍[23]。如表3所示,不同品种猕猴桃果实的VC含量差异显著。7种猕猴桃果实中VC含量范围为0.46~1.60mg/g,华优含量最高,海沃德最低,华优的VC含量较海沃德高3.5倍,7种猕猴桃VC平均含量为0.83 mg/g。王元秀[24]曾用滴定法对猕猴桃VC含量进行了测定,其结果为0.78 mg/g,与本研究略有差异。该结果可能与猕猴桃果实的成熟度与果实品种不同有关。
酚类物质是猕猴桃果实中具有生物活性的重要成分,其含量与猕猴桃抗氧化活性具有极显著的相关性[1]。由表3可知,7种猕猴桃果实的总酚和总黄酮含量差异均较为显著,其总酚含量范围为0.73~1.69 mg/g,平均含量为1.12 mg/g,其中,秦美和徐香的总酚含量均较高,翠香的总酚含量最低。其他品种总酚含量顺序依次为:红阳>华优>黄金果>海沃德。7种猕猴桃果实的总黄酮含量在0.56~4.89mg/g之间,平均含量为2.13mg/g,红阳的总黄酮含量最高,显著高于其他品种,海沃德的总黄酮含量最低。此结果与任晓婷[25]等人的研究结果略有不同。
2.2 不同品种猕猴桃果实抗氧化活性的比较
2.2.1DPPH自由基的清除能力DPPH是一种稳定的有机自由基,自由基清除剂能够使DPPH溶液褪色,通过吸光度的变化可对其进行定量分析[26]。由表4可知,秦美和徐香猕猴桃DPPH自由基清除能力最强,两种果实提取物体积分别为20μL和40μL时,清除能力就达到了与VC几乎相同的水平,分别为94.04%和95.62%。7种猕猴桃提取物对DPPH自由基的清除能力均随样品体积的增加而增强,除徐香与秦美外,其他品种猕猴桃果实提取物对DPPH自由基清除能力均随样品体积的增加而线性上升,呈剂量-效应关系。本研究中,猕猴桃DPPH清除能力与总酚含量呈显著正相关关系(R2=0.79);除海沃德外,猕猴桃DPPH清除能力与总黄酮含量亦呈显著正相关关系(R2=0.74)。上述研究结果表明,猕猴桃果实的DPPH清除能力主要来自其中的酚类物质,这与杜国荣[27]的研究结果一致。
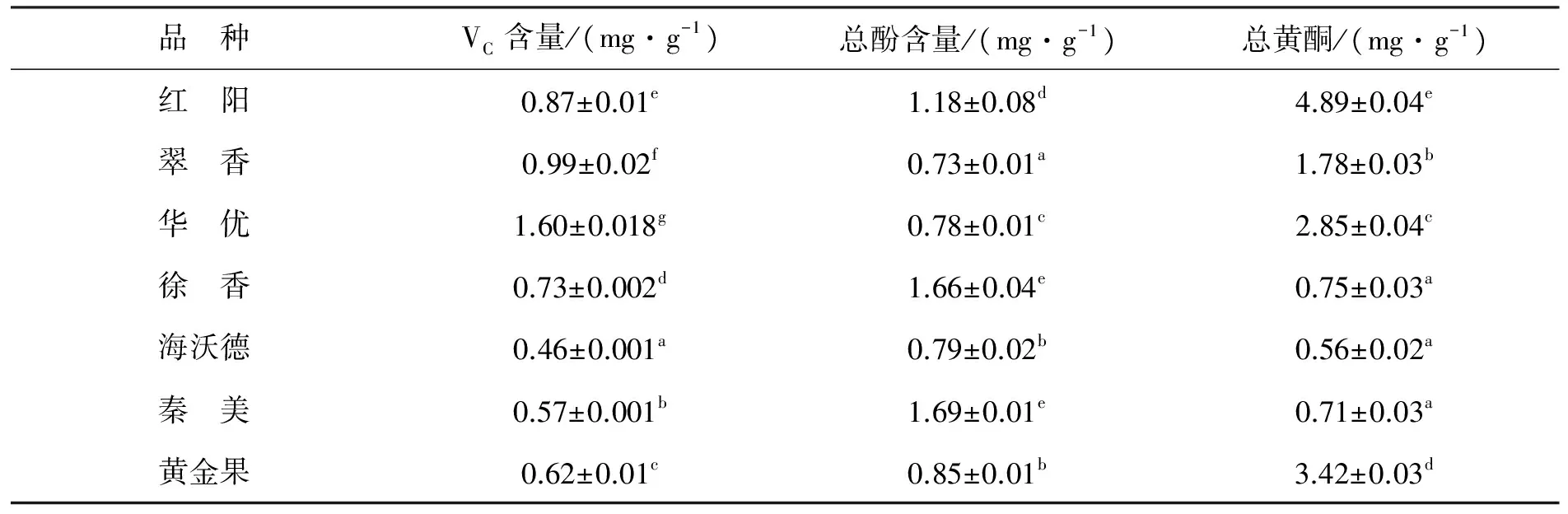
表3 不同品种猕猴桃VC、总酚和总黄酮含量的比较Tab.3 Comparison of VC content, total phenolics content and total flavonoids content in different kiwifruit varieties
注:同列小写字母不同表示差异显著(P<0.05)
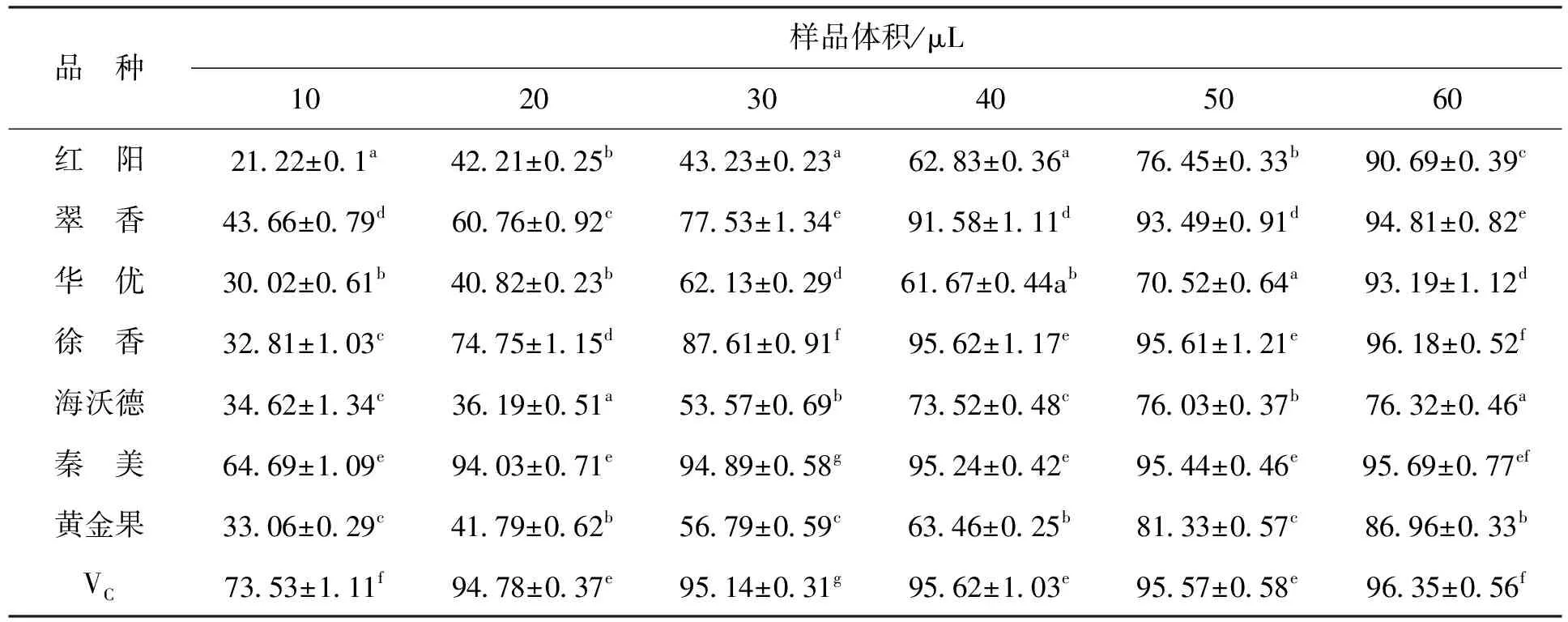
表4 VC和不同品种猕猴桃对DPPH自由基的清除率Tab.4 DPPH radical scavenging rate of VC and different kiwifruit varieties %
注:同列小写字母不同表示差异显著(P<0.05)
2.2.2Fe2+络合能力Fe2+能够催化Fenton反应,产生毒性较大的羟基自由基,引起动、植物机体氧化损伤,抗氧化物质能够在一定程度上络合Fe2+,阻碍反应进行[28],进而表现出对动、植物机体的保护作用。由表5可知,7种猕猴桃果实均具有一定的Fe2+络合能力,且不同品种间猕猴桃存在显著性差异。秦美和徐香猕猴桃的络合能力明显高于其他品种,分别为5.42mg/g,5.37 mg/g,黄金果络合能力最弱,为2.39 mg/g,约为秦美络合能力的40%。其他品种猕猴桃络合能力由高到低顺序依次为红阳、华优、海沃德、翠香。除红阳和黄金果外,Fe2+络合能力与总酚含量呈显著正相关关系(R2=0.77);除海沃德和黄金果外,Fe2+络合能力与总黄酮含量亦呈显著正相关关系(R2=0.84)。结果表明,猕猴桃果实的Fe2+络合能力主要基于其丰富的酚类物质含量。探究原因,酚类物质多具有C3—OH,C4O或C5—OH以及邻苯二酚羟基,因此可与Fe2+发生络合反应[29]。
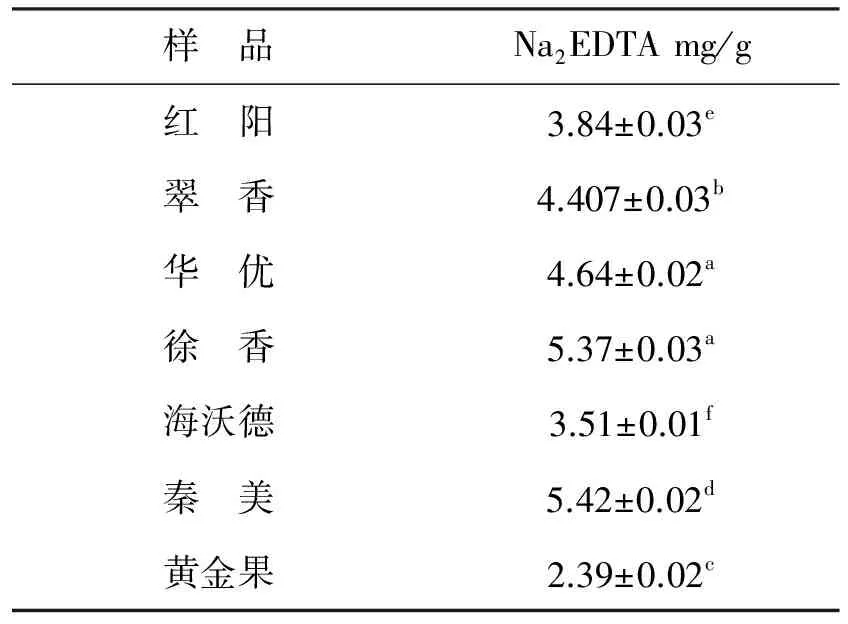
表5 不同品种猕猴桃对Fe2+络合能力Tab.5 Fe2+ chelating capacity of different kiwifruit varieties
注:同列小写字母不同表示差异显著(P<0.05)
2.2.3 Fe3+还原能力通常样品的还原能力与抗氧化活性呈正相关。依据样品还原能力的测定方法,在波长700nm处读取的吸光值越大,其还原能力越强[30]。由表6可知,7种猕猴桃果实水提物对Fe3+均有一定的还原能力,其中,秦美的Fe3+还原能力最强,海沃德最弱,两者之间存在显著性差异,在200μL样品体积下,秦美的还原能力是海沃德的2.4倍。其他品种的Fe3+还原能力,按华优、翠香、徐香、黄金果和红阳依次减弱。7种不同品种猕猴桃还原能力均随着样品体积的增加而线性上升,呈剂量-效应关系。除红阳外,猕猴桃还原能力与VC含量呈显著正相关关系(R2=0.82)。上述研究结果表明,猕猴桃果实的Fe3+还原能力主要与其VC含量有关。这与王菲[31]等人的研究结果一致,他们认为VC的还原能力是猕猴桃黄酮还原能力的1.16倍。
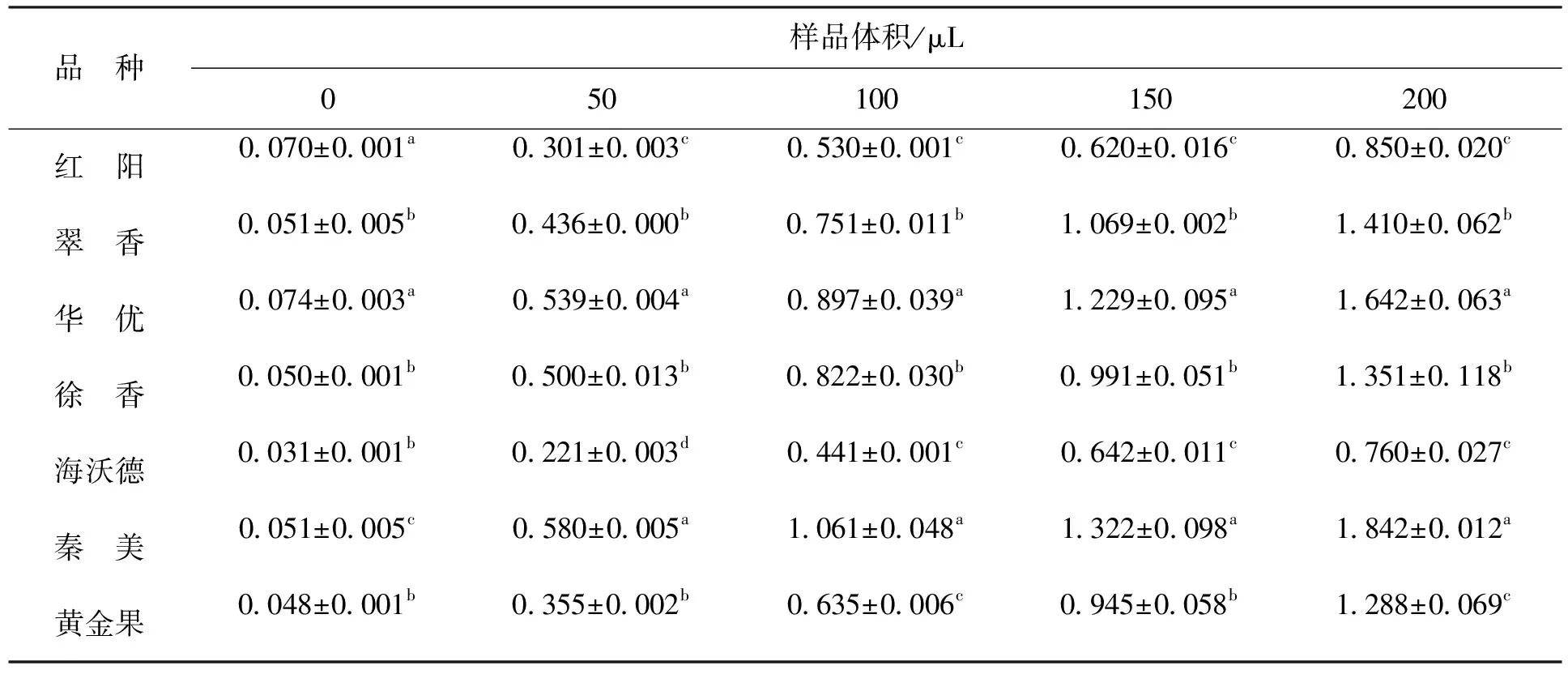
表6 不同品种猕猴桃Fe3+的还原能力Tab.6 Fe3+ reducing power of different kiwifruit varieties
注:同列小写字母不同表示差异显著(P<0.05)
2.2.4DNA氧化损伤测定结果来自于Fenton反应的羟基自由基(OH·)能够攻击DNA链,并使其断裂[32],几乎能够与超螺旋DNA分子中所有的组分反应,产生超螺旋、开链和线状DNA3种形式[33]。由表7可知,空白对照组仍有部分DNA损伤(13.69%),可能是实验过程中添加实验试剂或电压过大等因素造成的。模型组中过氧化氢溶液和硫酸亚铁混合溶液导致电泳产生92.31% 的开链和线状DNA,正常对照组电泳产生13.69% 的开链和线状DNA,模型组是正常对照组的6.74倍。加入猕猴桃果实提取物后,开链和线状DNA的比例如表7所示,7种猕猴桃对于由OH·引起的pBR322质粒DNA损伤均有明显的保护作用。其中华优提取物对DNA氧化损伤的保护作用最强,超螺旋DNA所占比例为85.48%,与对照组几乎一致,基本达到最大保护。翠香、秦美、黄金果、徐香和红阳对DNA氧化损伤的保护作用依次减弱,保护作用最弱的是海沃德,超螺旋形式DNA所占比例只有15.06%。有研究表明,酚类物质能够还原OH·,且酚类物质可与Fe2+发生络合反应,从而减慢Fenton反应,发挥抗氧化作用[34],黄酮作为多酚物质的一类,对于DNA氧化损伤亦有较强的保护作用[35]。
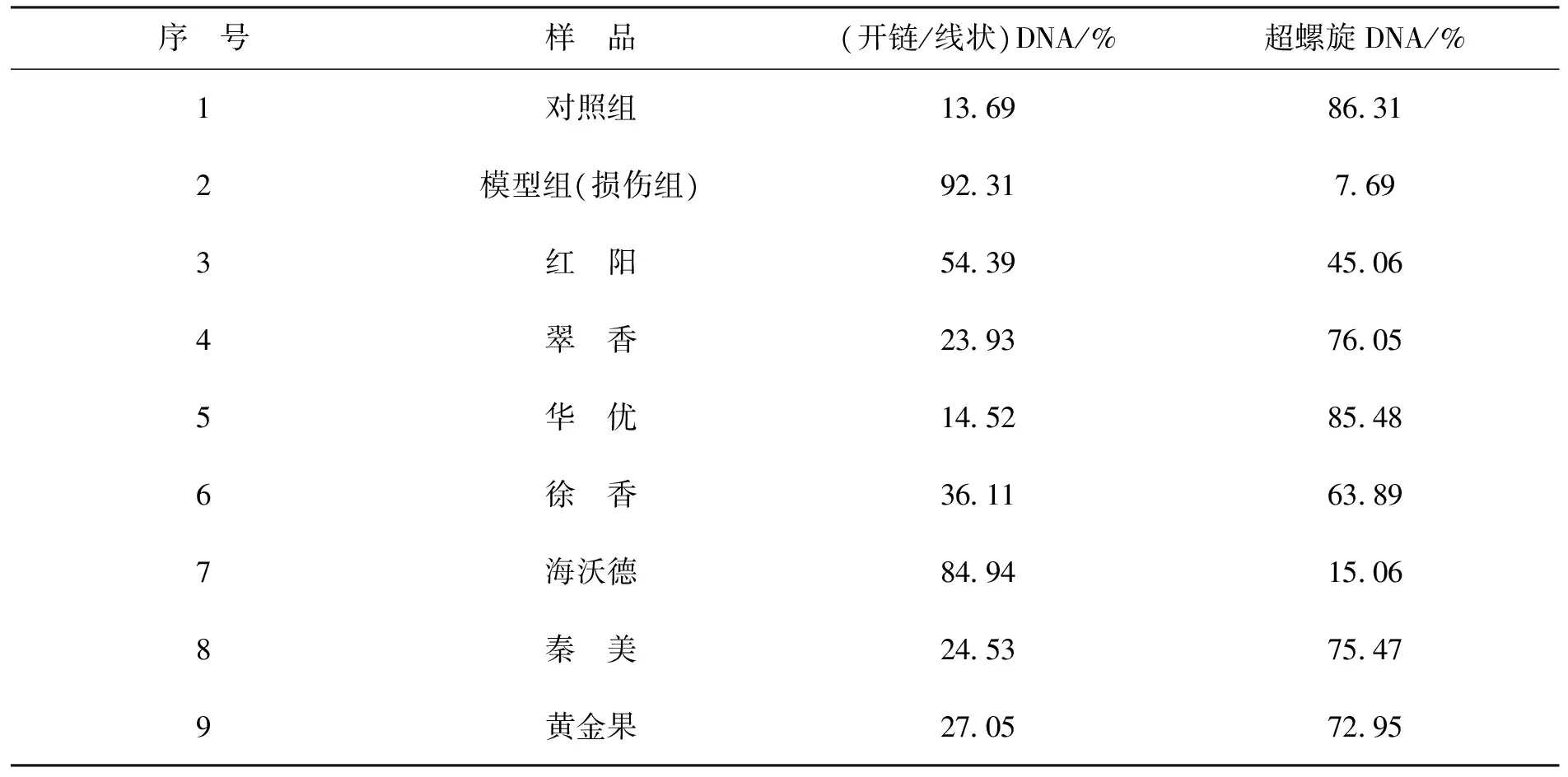
表7 不同品种猕猴桃对DNA氧化损伤的保护作用Tab.7 Protective effects of different kiwifruit varieties against oxidative DNA damage
3 结 语
本研究测定了7种猕猴桃果实的理化特性,抗氧化活性和对DNA氧化损伤的保护作用。结果表明,基础理化指标和抗氧化活性指标在不同品种猕猴桃之间均有一定差异性。秦美具有最强的DPPH清除率,Fe2+络合能力和Fe3+还原能力,华优具有最强的对DNA氧化损伤的保护作用。对不同品种猕猴桃总酚,总黄酮和VC含量与抗氧化能力做相关性分析,发现总酚,总黄酮含量与DPPH清除率和Fe2+络合能力均呈现显著的正相关,VC含量与Fe3+还原能力呈显著正相关。
参考文献:
[1]DU Guo-rong, LI Ming-jun, MA Feng-wang. Antioxidant capacity and the relationship with polyphenol and Vitamin C in Actinidia fruits [J]. Food Chemistry, 2009, 113(2): 557-562.
[2]阎家麒, 王九一, 赵敏. 中华猕猴桃多糖的提取及其对自由基的清除作用[J]. 中国生化药物杂志, 1995, 16(1): 12-14.
[3]刘若英, 朱晓萍, 查筑红, 等. 猕猴桃中药复方制剂对人体免疫功能的影响[J]. 贵阳医学院学报; 1994, 19(1): 20-21.
[4]刘延吉,刘金凤, 田晓艳, 等. 软枣猕猴桃多糖降血糖降血脂活性研究[J]. 食品与生物技术学报, 2012, 31(1): 86-89.
[6]崔莹. 猕猴桃属植物化学成分及药理活性研究进展[J]. 西安文理学院学报(自然科学版), 2011, 14 (4):21-25.
[7]国家卫生和计划生育委员会.GB 50093-2016食品中水分的测定[S]. 北京: 中国标准出版社, 2017.
[8]BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976,72(S1-2):248-254.
[9]国家卫生和计划委员会.GB 5009 86-2016食品中抗坏血酸的测定 [S]. 北京: 中国标准出版社, 2017.
[10] DATT B. Remote sensing of chlorophyll a, chlorophyll b, chlorophyll a+b, and total carotenoid content in eucalyptus leaves [J]. Remote Sensing of Environment, 1998, 66(2): 111-121.
[11] ELIZABETH A A, GILLESPIE K M. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin—Ciocalteu reagent [J]. Nature Protocol, 2007, 2(4): 875-877.
[12] MARINOVA D, RIBAROVA F, ATANASSOVA M. Total phenolics and total flavonoids in Bulgarian fruits and vegetables [J]. Journal of the University of Chemical Technology and Metallurgy, 2005, 40(40): 255-260.
[13] SIDDHURAJU P, BECKER K. Antioxidant properties of various solvent extracts of total phenolic constituents from three different agroclimatic origins of drumstick tree (MoringaoleiferaLam.) leaves [J].Journal of Agricultural and Food Chemistry, 2003, 51(8): 2144-2155.
[15] SINGH N, RAJINI P.S. Free radical scavenging activity of an aqueous extract of potato peel [J]. Food chemistry, 2004, 85(4): 611-616.
[16] YEUNG SY, LAN WH, HUANG CS, et al. Scavenging property of three cresol isomers against H2O2, hypochlorite, superoxide and hydroxyl radicals[J]. Food and Chemical Toxicology, 2002, 40(10): 1403-1413.
[17] 郭秀兰, 陈易珊, 许淳, 等. 红心果肉猕猴桃的营养评价[J]. 食品科技, 2014, 39(11): 71-73.
[18] 刘明池, 小岛孝之, 田中宗浩, 等. 草莓果实含水量对品质的影响[J]. 华北农学报, 2002, 17(3): 114-117.
[19] 邓丽莉, 潘晓倩, 生吉萍, 等. 考马斯亮蓝法测定苹果组织微量可溶性蛋白含量的条件优化[J]. 食品科学, 2012, 33(24): 185-189.
[20] 严蓓, 孙锦, 郭世荣, 等. 钙对盐胁迫下黄瓜幼苗生长及可溶性蛋白质表达的影响[J]. 江苏农业学报, 2012, 28(4): 841-845.
[21] 李淼, 檀根甲, 李瑶, 等. 不同猕猴桃品种对细菌性溃疡病的抗病性及其聚类分析[J]. 植物保护, 30(5): 51-54.
[22] 李文生, 石磊, 王宝刚, 等. 不同颜色果肉猕猴桃营养品质的比较[J]. 食品科技, 2012, 37(7): 47-52.
[23] 龙勇, 孙谦, 冯婧媛, 等. 提高果蔬维生素C含量研究进展[J]. 食品工业科技, 2014, 35(01): 385-389.
[24] 王元秀, 庄海燕. 微量滴定法测定猕猴桃中维生素C的含量[J]. 济南大学学报, 2001, 15(4): 374-375.
[25] 任晓婷, 张生万, 李美萍, 等. 不同品种猕猴桃总酚含量与清除自由基能力相关性研究[J]. 山西农业大学学报, 2016, 36(5): 341-344.
[26] KUMARAN A, KARUNAKARAN R J. Antioxidant and free radical scavenging activity of an aqueous extract of Coleus aromaticus [J]. Food Chemistry, 2006, 97(1): 109-114.
[27] 杜国荣. 猕猴桃, 柿和苹果果实的抗氧化能力及其抗氧化活性成分的分析[D]. 西安:西北农林科技大学, 2009.
[28] HALLIWELL B. Antioxidants: the basics-What they are and how to evaluate them [J]. Advance in Pharmacology, 1997, 38(1): 3-20.
[29] 梁靖, 陈留记, 杨贤强, 等. 茶多酚的络合作用研究进展[J]. 茶叶, 2003, 29(2): 72-74.
[30] 荣建华, 李小定, 谢笔钧. 大豆肽体外抗氧化效果的研究[J]. 食品科学, 2002, 23(11): 118-120.
[31] 王菲, 栾云峰, 刘长江. 软枣猕猴桃总黄酮体外抗氧化活性[J]. 食品科学, 2011, 32(17): 168-171.
[32] 张德莉, 朱圣姬, 罗光富, 等. 自由基与DNA氧化损伤的研究进展[J]. 三峡大学学报, 2004, 26(6): 563-567.
[33] DIZDAROGLU M, JARUGA P, BIRINCIOGLU M et al. Free radical-induced damage to DNA: mechanisms and measurement [J]. Free Radical Biology and Medicine, 2002, 32(11): 1102-1115.
[34] 曹炜, 卢珂, 陈卫军, 等. 不同种类蜂蜜抗氧化活性的研究[J]. 食品科学, 2005, 26(8): 352-356.
[35] 陈红君, 刘霞, 余自成, 等. 黄酮类活性成分对吸烟致质粒 DNA 损伤的保护作用[J]. 中南药学, 2013, 11(7):4-5.
