不同剂量姜黄素对宫颈癌裸鼠移植瘤生长及瘤组织MIF、VEGF表达的影响
2018-04-17葛佳威程正健
葛佳威 程正健
(深圳市宝安第二人民医院(集团)总医院中医科,广东 深圳 518104)
1深圳市宝安第二人民医院(集团)总医院超声科
顺铂及其他铂类抗肿瘤药是宫颈癌的一线化疗用药,但易发生肾毒性、神经毒性、严重消化道反应等不良反应,限制顺铂的临床应用〔1,2〕。姜黄素是一种味微苦的结晶粉末,主要从天南星科和姜科植物的根茎中提取而来〔3〕。实验证明姜黄素具有抗肿瘤作用,具有抗癌广谱、不良反应小的优点,可以诱导肿瘤细胞凋亡,对肿瘤细胞生长的信号传导通路产生阻断作用,抑制调节肿瘤细胞黏附分子表达及肿瘤血管生成〔4〕。本研究旨在探讨不同剂量姜黄素对宫颈癌裸鼠移植瘤生长及瘤组织中巨噬细胞移动抑制因子(MIF)和血管内皮生长因子(VEGF)表达水平的影响。
1 材料与方法
1.1动物模型建立与实验处置
1.1.1细胞培养人宫颈癌Caski细胞,购于中科院上海细胞库,培养于RPMI-1640培养基(含10%胎牛血清,10×104U/L青霉素,100 mg/L链霉素)中,于37℃、5%CO2培养箱中培养,处于对数生长期的Caski细胞经0.25%胰蛋白酶消化后,无血清RIMI-1640培养基洗涤2次,采用含25% Matrigel的无血清RIMI-1640培养基将细胞密度调整为1.0×107/ml。
1.1.2模型建立35只SPF级BALB/c-nu雌性裸小鼠,鼠龄4~5 w,体重15~20 g,购于上海斯莱克实验动物有限责任公司。抽取Caski细胞混悬液200 μl(约2.0×106细胞),将其接种于裸鼠的右侧腋窝外侧皮下。每天观察接种部位有无出血和破溃,成瘤标准为移植瘤达到5 mm×5 mm。
1.1.3实验分组及处置35只小鼠成瘤成功后,按数字随机法将动物模型分为5组:阴性对照组、顺铂组(3 mg·kg-1·d-1)、姜黄素低剂量组(50 mg·kg-1·d-1)、中剂量组(100 mg·kg-1·d-1)和高剂量组(200 mg·kg-1·d-1),每组各7只。阴性对照组给予羧甲基纤维素钠灌胃15 d。顺铂组每隔3 d腹腔注射给药,共5次。姜黄素组连续灌胃给药15 d。本研究动物实验经医院伦理委员会审核批准,实验过程遵守《实验动物管理条例》。
1.2裸鼠体重、移植瘤体积及瘤重的监测停药24 h后处死各组裸鼠,测量裸鼠体重,剥取瘤体,测量移植瘤体积和瘤重,计算抑瘤率,将瘤体置于液氮中保存。
1.3实时定量PCR试验(RT-PCR)取出液氮保存的移植瘤组织,采用Trizol法提取组织总RNA,紫外分光光度计(美国Thermo公司)检测总RNA浓度及纯度(OD260 nm/OD280 nm比值),逆转录生成cDNA,置于-20℃保存备用。RT-PCR引物序列(上海生工生物工程有限公司)。见表1。定量PCR扩增仪(美国ABI公司) 检测MIF和VEGF表达水平。qRT-PCR扩增体系为10 μl,反应条件:50℃,2 min;95℃,10 min;95℃,15 s;60℃,1 min,进行35个循环。采用2-ΔΔCt方法表示MIF和VEGF相对表达量。

表1 RT-PCR引物序列
1.4蛋白质免疫印迹试验(Western印迹)取出液氮保存的移植瘤组织,加入RIPA裂解液提取组织总蛋白,BCA试剂盒(美国Thermo公司)检测组织总蛋白浓度。10% SDS-PAGE凝胶电泳分离蛋白后,湿转法将蛋白转到PVDF膜上,5%脱脂奶粉室温振荡封闭1 h,TBS-T洗膜,加入羊抗大鼠单克隆抗体MIF(美国Santa公司),羊抗大鼠单克隆抗体VEGF(美国Santa公司),内参-GAPDH抗体(美国Santa公司),4℃孵育过夜。TBS-T洗膜后,加入HRP标记的兔抗羊二抗(南京金斯瑞生物科技有限公司),室温孵育1 h,加ECL发光液(美国Millipore公司)进行化学发光显影,凝胶成像仪(美国UVP公司)观察蛋白条带,对实验结果进行灰度分析(ImageLab软件)。
1.5免疫组织化学取出液氮保存的移植瘤组织,采用免疫组化SP法进行检测,所有样本经10%中性福尔马林溶液固定,石蜡包埋,4 μm连续切片;经二甲苯脱蜡,在100%、95%、85%的酒精浸泡水化,98℃的枸橼酸钠溶液(0.01 mol/L,pH6.0)中浸泡15 min进行抗原修复,滴加正常山羊血清室温封闭20 min,弃去血清,分别滴加MIF和VEGF一抗工作液(美国Abcam公司),37℃孵育2 h,PBS洗涤3×5 min,滴加生物素二抗(上海杰美基因医药科技有限公司),室温孵育30 min,PBS洗涤3×5 min,DAB显色(武汉博士德生物工程有限公司),充分冲洗后,苏木素复染,常规脱水,透明,干燥,封片。若细胞胞质内出现棕黄色颗粒则认为MIF或VEGF蛋白阳性,随机选取10个含有阳性细胞的400倍视野进行观察。用 Image-ProPlus 计算MIF和VEGF蛋白累积光密度(IOD)。

2 结 果
2.1各组裸鼠体重、移植瘤体积及瘤重的变化药物治疗15 d后,与阴性对照组相比,顺铂组裸鼠体重显著降低(P<0.05),而姜黄素低、中、高剂量组与阴性对照组之间的裸鼠体重比较差异无统计学意义(P>0.05)。顺铂组和姜黄素低、中、高剂量组的移植瘤体积均显著小于阴性对照组(P<0.05)。姜黄素低剂量组移植瘤体积与顺铂组、姜黄素中、高剂量组相比差异具有统计学意义(P<0.05)。顺铂组移植瘤瘤重明显小于阴性对照组(P<0.05),而姜黄素低、中、高剂量组与阴性对照组比较差异无统计学意义(P>0.05)。不同剂量姜黄素组抑瘤率两两比较差异具有统计学意义(P<0.05)。见表2。
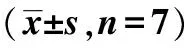
表2 各组裸鼠体重、移植瘤体积、瘤重的变化
与阴性对照组相比:1)P<0.05;与姜黄素低剂量组相比:2)P<0.05;与姜黄素中剂量组比较:3)P<0.05,下表同
2.2各组MIF、VEGF mRNA表达水平的变化顺铂组、姜黄素低、中、高剂量组MIF mRNA和VEGF mRNA相对表达量明显低于阴性对照组(P<0.05);MIF mRNA相对表达量在姜黄素低、中、高剂量组之间差异无统计学意义(P>0.05);姜黄素低剂量组的VEGF mRNA相对表达量与姜黄素中、高剂量组及顺铂组相比差异具有统计学意义(P<0.05)。见表3。
2.3各组MIF、VEGF蛋白表达水平的变化顺铂组、姜黄素低、中、高剂量组的移植瘤组织中MIF、VEGF蛋白相对表达量明显低于阴性对照组(P<0.05)。MIF蛋白相对表达量在姜黄素低、中、高剂量组之间差异无统计学意义(P>0.05);姜黄素低剂量组的VEGF蛋白相对表达量与姜黄素中、高剂量组及顺铂组相比差异具有统计学意义(P<0.05)。见表4。
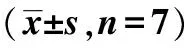
表3 各组MIF、VEGF mRNA表达水平的变化
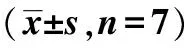
表4 各组MIF、VEGF蛋白的IOD值
3 讨 论
中药姜黄的干燥根茎,具有清心解郁、活血止痛、行气破淤等功效,临床上广泛用于治疗跌打肿痛、腹痛、胃炎等,姜黄素是其主要化学成分,一种天然的多酚类化合物,具有色泽稳定、毒性极低等特点,被广泛应用在食品添加剂和染料等领域〔5〕。此外,姜黄素还具有抗氧化、抗炎、预防血栓、抗动脉粥样硬化和抗肿瘤等多种作用〔6~8〕。多项随机对照试验已经证实,姜黄素在人类疾病的治疗中具有很高的安全性和有效性〔9〕。Lev-Ari等〔10〕的动物体内研究发现,姜黄素处理人非小细胞肺癌裸鼠移植瘤后,能够显著减缓移植瘤的生长速度,并且延长移植瘤小鼠的生存时间。Ferreira等〔11〕发现,姜黄素能够抑制乳腺癌细胞移植瘤的体内生长及移植瘤内的血管生成。本研究结果提示姜黄素对宫颈癌移植瘤生长有抑制作用,且姜黄素剂量越大抑瘤效果越强。并且在用药期间,顺铂组小鼠逐渐出现活动减少,厌食,皮肤干涩,消瘦等表现。而其余各组没有出现行动迟缓、消瘦、食欲降低、体表温度下降等不良反应,说明姜黄素无毒副作用,具有较好的安全性。姜黄素参与并影响肿瘤发生发展的多个环节与步骤,如姜黄素能够降低胃癌细胞裸鼠移植瘤组织中的淋巴管密度〔12〕、能够增加肺癌细胞对化疗敏感性〔13〕、对乳腺癌细胞具有抑制生长和诱导凋亡的作用〔14〕。在恶性肿瘤进展过程中,肿瘤微环境中的炎性细胞具有重要的作用,由肿瘤细胞和基质分泌的趋化因子、细胞因子和生长因子促进了肿瘤相关巨噬细胞的浸润,进而刺激晚期癌症细胞血管形成和侵袭〔15〕。MIF是一种能够抑制离体巨噬细胞迁移的细胞因子,由活化T细胞分泌。Wang等〔16〕的研究证实,在宫颈癌细胞中,沉默MIF基因表达后,能够抑制细胞的增殖、迁移和侵袭能力。淋巴管生成是肿瘤细胞发生淋巴结转移的关键,VEGF是最早被证实的能够促进淋巴管生成的细胞因子。Sun等〔17〕的Meta分析结果显示,VEGF阳性表达增加了宫颈癌患者的淋巴转移风险。Thacker等〔18〕研究发现,姜黄素通过下调TGF-β信号通路活性,抑制细胞增殖、迁移和侵袭能力。本研究结果提示姜黄素能够有效地降低瘤组织中MIF和VEGF表达,这可能是姜黄素抗宫颈癌淋巴转移的内在机制。
1许剑利,徐克惠.高危型HPV检测及TCT检查在宫颈癌筛查中的应用分析〔J〕.实用妇产科杂志,2014;30(12):946-9.
2Nair LM,Kumar RR,Thomachan KC,etal.Phase IIb trial comparing two concurrent cisplatin schedules in locally advanced head and neck cancer〔J〕.South Asian J Cancer,2017;6(2):64-8.
3贺帅,吴彦萍,蔡湘仪,等.姜黄素对宫颈癌细胞生长与增殖的影响研究〔J〕.现代生物医学进展,2017;17(1):7-10,19.
4高文,何彦津,梁凤鸣,等.姜黄素抗肿瘤血管生成分子机制研究进展〔J〕.国际眼科杂志,2016;16(3):466-8.
5付兴会,林连美.中药姜黄主要有效成分药理学研究进展〔J〕.湖北中医药大学学报,2015;17(4):109-10.
6Cho DC,Ryu K,Kim KT,etal.The therapeutic effects of combination therapy with curcumin and alendronate on spine fusion surgery in the ovariectomized Rats〔J〕.Korean J Spine,2017;14(2):35-40.
7Akyuz S,Turan F,Gurbuzler L,etal.The anti-inflammatory and antioxidant effects of curcumin in middle ear infection〔J〕.J Craniofac Surg,2016;27(5):e494-7.
8Miao M,Cheng B,Li M.Effect of curcumin on diabetic rat model of cerebral ischemia〔J〕.Pak J Pharm Sci,2015;28(1 Suppl):401-5.
9马勇,王礼宁,郭杨,等.姜黄素通过调节Wnt/β-catenin信号通路促进软骨细胞增殖的研究〔J〕.广州中医药大学学报,2017;34(1):90-5.
10Lev-Ari S,Starr A,Katzburg S,etal.Curcumin induces apoptosis and inhibits growth of orthotopic human non-small cell lung cancer xenografts〔J〕.J Nutr Biochem,2014;25(8):843-50.
11Ferreira LC,Arbab AS,Jardim-Perassi BV,etal.Effect of curcumin on pro-angiogenic factors in the xenograft model of breast cancer〔J〕.Anticancer Agents Med Chem,2015;15(10):1285-96.
12Da W,Zhu J,Wang L,etal.Curcumin suppresses lymphatic vessel density in an in vivo human gastric cancer model〔J〕.Tumour Biol,2015;36(7):5215-23.
13Ai Y,Zhu B,Ren C,etal.Discovery of new monocarbonyl ligustrazine-curcumin hybrids for intervention of drug-sensitive and drug-resistant lung cancer〔J〕.J Med Chem,2016;59(5):1747-60.
14Wang Y,Yu J,Cui R,etal.Curcumin in treating breast cancer:a review〔J〕.J Lab Autom,2016;21(6):723-31.
15Giannice R,Erreni M,Allavena P,etal.Chemokines mRNA expression in relation to the Macrophage Migration Inhibitory Factor(MIF)mRNA and Vascular Endothelial Growth Factor(VEGF)mRNA expression in the microenvironment of endometrial cancer tissue and normal endometrium:a pilot study〔J〕.Cytokine,2013;64(2):509-15.
16Wang Q,Wei Y,Zhang J.Combined knockdown of d-dopachrome tautomerase and migration inhibitory factor inhibits the proliferation,migration,and invasion in human cervical cancer〔J〕.Int J Gynecol Cancer,2017;27(4):634-42.
17Sun H,Tang F,Zhou S,etal.Association between vascular endothelial growth factor expression and lymph node metastasis in cervical cancer:a meta-analysis〔J〕.J Obstet Gynaecol Res,2016;42(10):1310-6.
18Thacker PC,Karunagaran D.Curcumin and emodin down-regulate TGF-β signaling pathway in human cervical cancer cells〔J〕.PLoS One,2015;10(3):e0120045.
