跑台训练对脊髓损伤大鼠运动功能及Notch信号通路的影响
2018-04-17袁琼嘉赵卫卫
孙 鹏 袁琼嘉 赵卫卫
(玉林师范学院体育健康学院,广西 玉林 537000)
1成都体育学院运动医学系2德阳市人民医院康复科
脊髓损伤(SCI)是一类有极高致残率和致死率的中枢神经系统疾病,发病率呈年上升趋势,由于SCI后复杂的生理病理及神经系统再生的限制,目前仍缺乏有效的治疗方式〔1〕。近些年来,随着对康复医学的不断发展及对损伤机制的不断了解,运动训练成为目前临床上对SCI治疗不可缺少的一部分。运动训练能促进营养因子的分泌表达、诱导神经肌肉的塑性、改善脊髓局部血液循环、促进突触的正确联系及轴突的再生,对于损伤后的功能恢复有重要作用〔2,3〕。很多研究采用运动训练提高SCI的治疗效果,由于运动训练方法、损伤程度、训练强度、训练时间等多种因素,目前对各种运动训练的效果存在一定的争议。本研究建立SCI大鼠模型采用跑台训练对其运动功能进行评分,并探讨相关作用机制。
1 材料与方法
1.1实验动物成年雌性健康SD大鼠36只,体重260~300 g,均由广西医科大学动物实验室提供。饲养环境温度20℃~24℃,采取自由采食和饮水,并分笼饲养。
1.2主要试剂和仪器荧光定量试剂盒及反转录试剂盒购自日本Takala;荧光定量PCR仪购自美国ABI;跑步训练器为自制。
1.3SCI模型的建立将10%水合氯醛按照300 mg/kg体重腹腔麻醉大鼠,麻醉成功后俯卧位固定于手术台上,背部剪毛并消毒,以T10棘突为中心做后背部长约3 cm的正中切口,钝性分离背部的皮下组织,用血管钳固定,用血管钳咬除T8椎板和棘突,充分暴露出T9节段的脊髓,使大鼠脊髓处于水平位。以T9相应的区域为损伤区,以正中血管为中心,用一重量为10 g的砝码沿玻璃导管垂直下落,造成脊髓急性挫伤。模型制作成功的标志为大鼠的下肢回缩性扑动,尾巴痉挛摆动,被打击的局部脊髓表面迅速出现淤紫色,术后双肢僵硬,并出现完全瘫痪。之后逐层缝合并皮下注射2 ml生理盐水,并连续3 d肌肉注射20万U青霉素。术后每天上下午各进行一次膀胱按摩协助排尿,直至形成反射性排尿为止。
1.4实验分组模型制作过程中共死亡6只,剔除肠胀气、泌尿系统感染等原因,剩余30只,随机分为3组:SCI模型组、运动训练组和正常组(无脊髓损伤也不做训练),每组10只。
1.5运动训练本研究采用跑台训练。参照相关文献〔4,5〕及预实验的结果,运动训练在造模成功后的第2天开始,根据大鼠自身的状况,跑台速度设定为6~15 m/min,每天进行30 min训练,分2次进行,每次训练15 min,2次间隔5 min,5次/w。训练过程中如出现大鼠停滞不动时,适当给予阴囊刺激,确保训练的正常进行。大鼠每次训练前排空膀胱,训练后及时给予食物和饮水补充。
1.6运动功能评定分别在损伤前及损伤后的1、7、14、21、28 d对各组大鼠的运动功能进行评定,采用BBB评分法〔6〕和改良Tarlow评分〔7〕两项。
1.7Notch1、发状分裂相关增强子(Hes)1表达的检测采用逆转录聚合酶链反应(RT-PCR)方法。麻醉处理各组大鼠,手术截取以脊髓损伤部位为中心5 mm长度的脊髓组织,提取组织中的总RNA,逆转录试剂盒反转录总RNA为cDNA。根据GenBank基因库搜索出鼠Notch1、Hes1和甘油醛-3-磷酸脱氢酶(GAPDH)共3个基因的CDS序列,利用Primer premier6.0引物设计软件设计Notch1、Hes1和GAPDH的RT-PCR引物,每个样品设置6个重复孔,以cDNA为模板用实时荧光定量PCR仪对Notch1、Hes1和GAPDH基因进行扩增。引物序列如下:Notch1上游引物:5′-CCTTTACCTGCCTCTGCC-3′,下游引物:5′-GTCCTGTGGTCCCCTTGA-3′。Hes1上游引物:5′-GAGGCTGCCAAGGTTTTT-3′,下游引物:5′-GGTGGGCTAGGGAGTTTATG-3′。GAPDH上游引物:5′-ACGGCAAGTTCAACGGCACAG-3′,下游引物:5′-GACGCCAGTAGACTCCACGACA-3′。PCR扩增条件为:95℃ 10 min;95℃ 15 s;60℃ 60 s,72℃ 20 s,以上共40个循环。72℃延伸15 min,4℃保存。根据Ct值利用2-△△Ct法计算各基因mRNA相对表达量。
1.8统计学方法采用SPSS21.0软件进行单因素方差分析、t检验。
2 结 果
2.1各组不同时间点BBB评分比较SCI模型组及运动训练组各时间点BBB评分均显著低于正常组(均P<0.05),运动训练组从14 d起BBB评分均显著高于SCI模型组(均P<0.05),见表1。
2.2各组不同时间点改良Tarlow评分比较SCI模型组及运动训练组在各时间点改良Tarlow评分均显著低于正常组(均P<0.05),运动训练组从14 d起改良Tarlow评分均显著高于SCI模型组(均P<0.05),见表2。
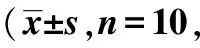
表1 各组不同时间点BBB评分结果分)
与正常组比较:1)P<0.05;与SCI模型组比较:2)P<0.05,下表同
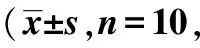
表2 各组不同时间点改良Tarlow评分结果分)
2.3各组不同时间点Notch1、Hes1 mRNA相对表达量比较SCI模型组和运动训练组各时间点Notch1、Hes1 mRNA相对表达量均显著高于正常组(均P<0.05),运动训练组在各时间点Notch1、Hes1 mRNA相对表达量均显著低于SCI模型组(均P<0.05),见表3。
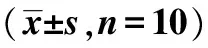
表3 各组不同时间点Notch1、Hes1 mRNA相对表达量
3 讨 论
目前对SCI主要的康复治疗为中医针灸、运动训练、并发症的康复治疗、心理干预、物理因子、矫形器及辅助用具应用等。运动训练是SCI后肢体功能恢复的重要措施。研究发现,SCI后何时进行运动训练是有严格限制的,基本在损伤后的2 w至2月之间,若训练开始太晚,会由于有大量的死亡细胞及在局部损伤部位形成的胶纸瘢痕而影响治疗效果〔8〕。也有研究发现,在SCI后开始训练太早可能会加重组织缺氧、缺血,进一步加重损伤,认为适当地延期治疗是十分必要的〔9〕。本研究中考虑到SCI后期损伤全身及局部就开始启动复杂的继发性损伤,其严重程度直接影响后期的功能恢复情况,且运动能改善局部微环境,因此,本研究在术后24 h即开始运动训练。目前对于SCI的运动训练主要包括主动训练、被动训练、电刺激训练等多种方式。跑台训练为一种被动训练,研究证实其对SCI的功能恢复有一定疗效〔10,11〕。
Notch信号通路是在进化上高度保守的细胞途径,广泛存在于脊椎动物和非脊椎动物,由Notch受体和配体、下游效应物、DNA结合蛋白等组成,参与调节细胞的增殖、凋亡、分化及机体的发育等过程。研究显示,Notch信号通路对于神经干细胞的增殖及分化有重要影响,在SCI后的表达明显增强〔12,13〕。电针对SCI的治疗可能与Notch信号通路有关〔14〕。
综上,跑台训练可显著降低SCI大鼠的BBB评分法和改良Tarlow评分,并下调Notch1、Hes1的表达,这说明跑台训练对脊髓损伤大鼠治疗可能通过抑制Notch信号通路起作用。
1Ruschel J,Hellal F,Flynn KC,etal.Systemic administration of epothilone B promotes axon regeneration after spinal cord injury〔J〕.Science,2015;348(6232):347-52.
2Rank MM,Flynn JR,Battistuzzo CR,etal.Functional changes in deep dorsal horn interneurons following spinal cord injury are enhanced with different durations of exercise training〔J〕.J Physiol,2015;593(1):331-45.
3Gorman PH,Scott W,York H,etal.Robotically assisted treadmill exercise training for improving peak fitness in chronic motor incomplete spinal cord injury:a randomized controlled trial〔J〕.J Spin Cord Med,2016;39(1):32-44.
4Cha J,Heng C,Reinkensmeyer DJ,etal.Locomotor ability in spinal rats is dependent on the amount of activity imposed on the hindlimbs during treadmill training〔J〕.J Neurotrauma,2007;24(6):1000-12.
5Multon S,Franzen R,Poirrier AL,etal.The effect of treadmill training on motor recovery after a partial spinal cord compression-injury in the adult rat〔J〕.J Neurotrauma,2003;20(8):699-706.
6Basso DM,Beattie MS,Bresnahan JC.A sensitive and reliable locomotor rating scale for open field testing in rats〔J〕.J Neurotrauma,1995;12(1):1-21.
7Gale K,Kerasidis H,Wrathall JR.Spinal cord contusion in the rat:behavioral analysis of functional neurologic impairment〔J〕.Exp Neurol,1985;88(1):123-34.
8West CR,Taylor BJ,Campbell IG,etal.Effects of inspiratory muscle training on exercise responses in Paralympic athletes with cervical spinal cord injury〔J〕.Scand J Med Sci Sports,2014;24(5):764-72.
9Bochkezanian V,Raymond J,De Oliveira CQ,etal.Can combined aerobic and muscle strength training improve aerobic fitness,muscle strength,function and quality of life in people with spinal cord injury? A systematic review〔J〕.Spinal Cord,2015;53(6):418-31.
10Jung SY,Kim DY,Yune TY,etal.Treadmill exercise reduces spinal cord injury induced apoptosis by activating the PI3K/Akt pathway in rats〔J〕.Exp Ther Med,2014;7(3):587-93.
11Nees TA,Tappe-Theodor A,Sliwinski C,etal.Early-onset treadmill training reduces mechanical allodynia and modulates calcitonin gene-related peptide fiber density in lamina Ⅲ/Ⅳ in a mouse model of spinal cord contusion injury〔J〕.Pain,2016;157(3):687-97.
12Chen S,Luo M,Zhao Y,etal.Fasudil stimulates neurite outgrowth and promotes differentiation in c17.2 neural stem cells by modulating notch signalling but not autophagy〔J〕.Cell Physiol Biochem,2015;36(2):531-41.
13Chen BY,Zheng MH,Chen Y,etal.Myeloid-specific blockade of notch signaling by rbp-j knockout attenuates spinal cord injury accompanied by compromised inflammation response in mice〔J〕.Mol Neurobiol,2015;52(3):1378-90.
14Geng X,Sun T,Li J,etal.Electroacupuncture in the repair of spinal cord injury:inhibiting the Notch signaling pathway and promoting neural stem cell proliferation〔J〕.Neural Regen Res,2015;10(3):394-403.
