脾气虚模型大鼠心脏组织葡萄糖转运蛋白-1和水通道蛋白-1表达水平
2018-04-17郭胜男丛培玮王艳杰王德山
郭胜男 丛培玮 王艳杰 王德山
(辽宁中医药大学医学检验学院,辽宁 沈阳 110847)
脾气虚本质一直是中医基础理论研究的一个重要部分,其机制的研究主要集中在神经内分泌的轴调节、免疫功能、消化功能和能量代谢等方面。基础理论表明,心与脾脏的关系主要表现在血液生成与血液运行两个方面的相互协同功能。脾主运化,运输水谷精微向上达肺脏,复注于心脉赤化生成血;而心主一身之血,又能滋养脾脏,供给其正常的功能行使。研究表明心肌细胞中葡萄糖转运蛋白(GLUT)1对心脏正常生理功能有重要作用,水通道蛋白(AQP)1可能在病理情况致心肌细胞内外渗透压改变而发挥重要作用〔1〕。本实验通过检测脾气虚模型大鼠心肌细胞中GLUT1和AQP1的表达水平,探讨脾气虚中脾与心生理功能关系的可能机制。
1 材料与方法
1.1动物本溪实验动物中心提供SPF级雄性SD大鼠16只,许可证号:SCXK(辽)(2010-001),体重(200±10)g,饲养于辽宁中医药大学实验动物中心。
1.2主要试剂和仪器RT-PCR反应试剂盒(Takara公司);二喹啉甲酸(BAC)蛋白定量试剂盒(武汉博士德生物工程有限公司);兔抗大鼠AQP1、GLUT1抗体、羊抗兔IgG抗体(CST公司);PCR反应仪,7500 RT-PCR检测仪,YLS-13A大小鼠抓力测定仪。
1.3建立脾气虚模型大鼠被随机分为对照和脾气虚两组。脾气虚组模型建立和评价参考报道〔1〕。对照组:在同一温度和湿度环境下饲养,不限制饮水及进食。脾气虚组:饲养1 w适应后开始实验。第1天先过多喂食,接着连续2 d禁食处理,不限制饮水,重复操作5次;每日35℃~37℃常温水中游泳至力竭。
1.4模型评价基本情况测量两组大鼠体质量、体温,计算24 h进食量;检测大鼠肌力〔1〕。
1.5RT-PCR法检测AQP1、GLUT1 mRNA表达水平造模结束后取大鼠心脏组织,提取总RNA进行实验。引物序列:AQP1:上游引物5′-GACTACACTGGCTGTGGGATCAA-3′,下游引物5′-CCAGGGCACTCCCAA TGAA-3′;GLUT1上游引物5′-TCCTGCTCATCAAT CGTAA-3′,下游引物5′-GACCCTCTTCTTTCATCTCC-3′。
1.6免疫印迹法测定AQP1、GLUT1蛋白表达水平取大鼠心脏组织,提取总蛋白,定量后继续实验。80~120 V条件下电泳,100 V 80 min湿转至硝酸纤维素(NC)膜,37℃室温5%脱脂奶粉封闭1 h,加入一抗(1∶1 000稀释),4℃过夜孵育;二抗(1∶1 000)稀释,室温封闭1 h;最后,化学发光法显影。
1.7统计学方法应用SPSS17.0软件行t检验。
2 结 果
2.1模型评价与对照组比较,脾气虚组被毛稀松,活动减少,部分大鼠反应迟钝,对周围刺激不敏感,大便稀软甚至水样;体温、进食量、前肢抓力均降低(P<0.05),见表1。
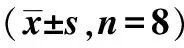
表1 两组体温、进食量及前肢抓力比较
与对照组比较:1)P<0.05,2)P<0.01;下表同
2.2AQP1、GLUT1 mRNA表达水平比较与对照组(设为1)比较,脾气虚组AQP1和GLUT1 mRNA水平(0.55±0.13,0.44±0.14)明显减少(P<0.01)。
2.3AQP1、GLUT1 蛋白表达水平比较与对照组比较,脾气虚组AQP1和GLUT1表达明显减少(P<0.01),见图1,表2。
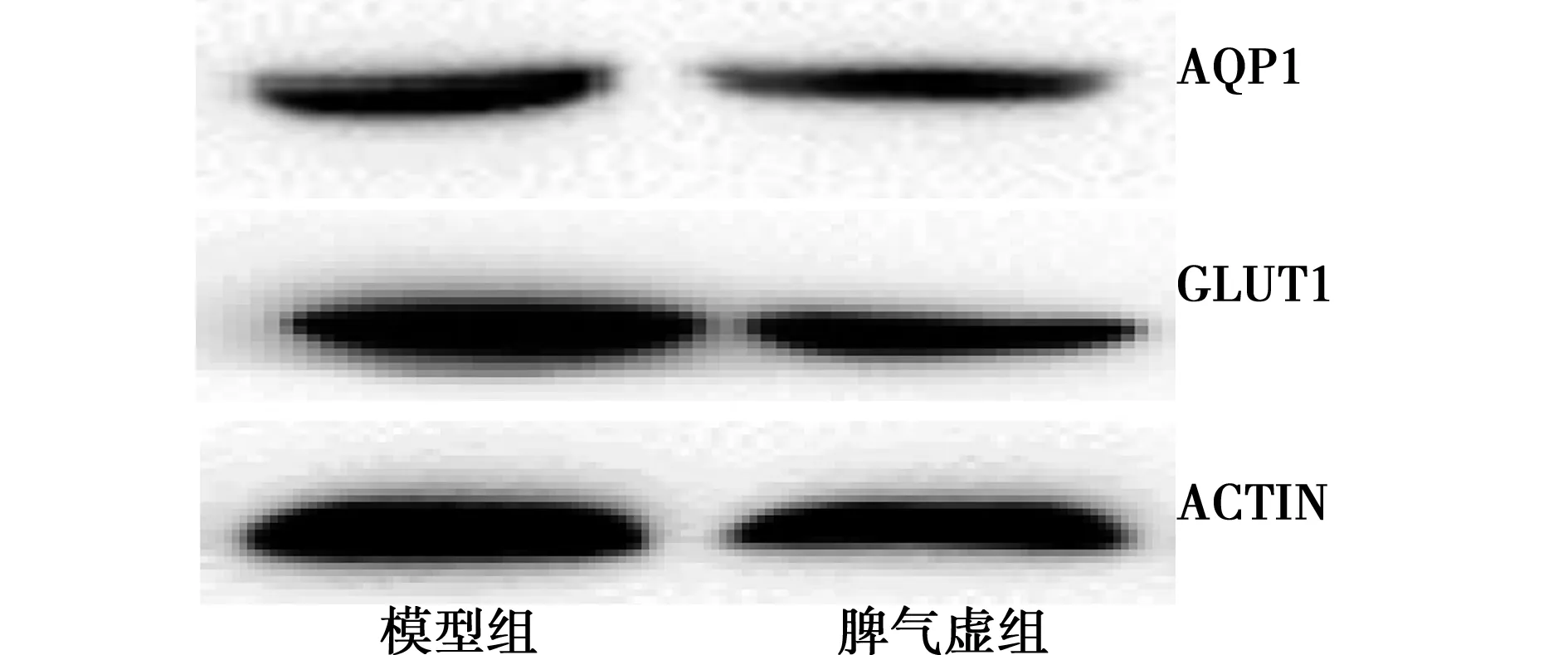
图1 心肌组织AQP1、GLUT1表达水平
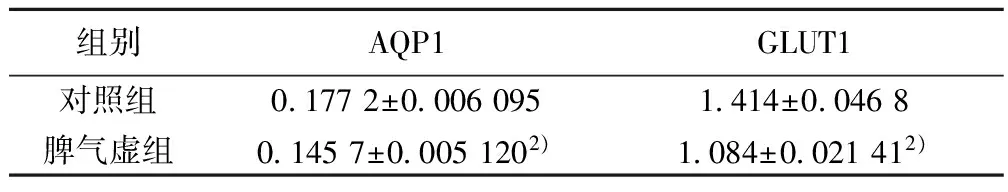
组别AQP1GLUT1对照组01772±00060951414±00468脾气虚组01457±00051202)1084±0021412)
3 讨 论
本实验中脾气虚模型沿用了实验组前期使用的造模法,即饮食失节结合劳倦过度两种手段,结果显示,脾气虚组大鼠活动明显减少,喜懒乏力,皮毛蓬松无光泽,大便多不成形甚至泄泻如水状。与此一致的表现为大鼠体重量减轻,基础体温或有降低,进食量明显减少,前肢抓力降低。因此,认为脾气虚模型造模成功。
脾为气血生化之源,薛氏滋化源认为“滋化源者何?脾胃之气是也。土为万物之母,则万物非土不生,唯脾土旺则万物皆昌,而四脏多有生气矣”。先天禀赋不足,饮食不节、水谷不化,气血不足,都可能最终导致脾胃功能障碍,产生脾虚之症候。“脾气虚则四肢不用,五脏不安”,脾气日益衰竭,血脉不通顺,筋骨肌肉失去濡养,经久失用,其他脏器同样不能行使其功能,维持人体正常活动。
目前对脾虚机制的研究主要集中在消化系统、神经内分泌轴、免疫调节和能量代谢等方面。文献报道的能量代谢相关理论认为,精微物质(主要指三大物质如葡萄糖、氨基酸、脂肪酸等)通过血液循环被输送到各组织细胞,以酶促反应完成能量转化,最后产生ATP、H2O和CO2。
葡萄糖是生物体能量代谢的最重要来源之一,GLUTs是葡萄糖出入细胞的重要载体,作为第一个限速酶在糖代谢中具有积极意义。目前已知的GLUTs共有14种,GLUT1、GLUT3、GLUT4与葡萄糖亲和力较高,其中GLUT1是最基础的转运体,与葡萄糖亲和力最高。研究表明机体各组织内通过调节GLUTs表达,形成代偿性保护机制,即在高血糖状态下,GLUTs水平反而降低,以此避免高血糖细胞毒性〔2〕。GLUT1和GLUT3在脑缺血、缺氧环境中表达明显增加,尤其是GLUT1在2 h内即可达到高峰。尚冰等〔3〕研究证实,脾气虚大鼠模型中大肠组织的GLUT5表达水平明显降低。丛培玮等〔4〕研究认为,中医脾虚在临床出现的消化功能紊乱可能由下丘脑调节功能异常引起,表现为下丘脑分泌β-EP、CCK、VIP明显减少,表达GLUT1、GLUT3减少。
水的代谢转运对生命活动有绝对重要的意义。AQPs是一类能够促进水分子快速跨膜运转的蛋白质。目前,AQPs在肺、神经系统和泌尿生殖器官中已确切分布,对其作用机制的研究也较为清楚,但在心脏方面相关研究就显得较少。文献报道,AQP1在心肌组织中表达水平较高且与心肌水肿关系最为密切〔5〕。Butler等〔6〕利用AQPs敲除小鼠模型检测AQPs在心肌细胞中相关作用,结果现实AQP1敲除小鼠水通透性下降最明显,因此认为AQP1在心肌细胞中起主要作用。Kellen等〔7〕研究认为稳定状态下只有28%的水分子通过AQPs转运完成,而高渗状态下的水分子可转运达正常的800倍,这种升高作用主要通过AQPs实现。李志清等〔8〕研究AQP1在大鼠烧伤早期心肌的表达及与心肌水肿的相关性,发现烧伤后心肌细胞AQP1表达增多与心肌水肿呈正相关,且通过抑制AQP1表达可减轻心肌水肿。因此,AQP1可能在病理情况致心肌细胞内外渗透压改变起重要作用。
心与脾的关系,主要体现为脾主运化,使水谷精微向上输布于肺,复注于心脉赤化生血;心主血脉,心血进一步供养脾脏以维持正常的运化功能,两者在血液生成与运行关系中相互协同互利。研究表明〔9〕,心肌缺血缺氧状态,心肌细胞膜上GLUT1和GLUT4表达增多,目的是帮助更多的葡萄糖转运至细胞内参与糖酵解过程,在满足组织器官能量需求的同时保护心肌细胞免受损伤。另一方面,葡萄糖转运异常可导致心肌功能异常。姜晓琳〔10〕研究认为脾气虚模型大鼠“脾主运化”功能损伤时,其左室收缩末期容积增大,舒张末期容积、每搏出量等均发生变化,且左室射血分数发生改变。脾气虚运化功能发生障碍,心脏射血功能异常,即表现为行血功能下降。本研究以脾气虚为模型,发现脾气虚组GLUT1水平明显降低。因此,推断脾气虚表现的血液生成不足,不能荣养身体,可能与心脏组织GLUT1表达减少有关。
此外,心肌细胞中AQP1水平降低,其水转运能力降低,但正常情况和病理情况下AQP的功能不一致。赵俊林等〔11〕关于体外循环肺损伤与AQP-1基因表达相关性的研究中,认为AQP1对体外循环肺损伤间质水肿的形成和吸收起重要作用,其作用机制可能与AQP1表达下降导致跨膜转运速率降低有关。Tabbutt等〔12〕利用羊心肺转流模型,发现体外循环手术后再灌注6 h,肺组织AQP1表达上升,再灌注3 h则无明显变化。Egan等〔13〕在体外循环动物模型的研究结果显示,心肌细胞中AQP1表达较术前均有上调,且与心肌细胞水肿程度呈正相关。
综上所述,AQP1在心肌细胞水转运过程中有重要作用,但其在组织损伤(水肿)、心肺体外循环之间的作用机制尚不明确。文献表明AQPs在脾虚湿困型疾病模型中有差异表达〔14〕,表明脾气虚症中脾运化水液机制在生物学基础上可能与AQPs表达量有关。
1尚冰.脾气虚证、脾阴虚证、脾阳虚证模型大鼠MDA、SOD、GSH-Px、T-AOC、8-OHdG、端粒长度变化的实验研究〔D〕.沈阳:辽宁中医药大学,2006.
2崔家鹏,李德新,朱爱松.脾气虚证模型大鼠心脏、肝脏、 脑组织 MAPK活性变化及补脾气方药对其影响的实验研究〔J〕.中华中医药学刊,2005;23(5):819-21.
3尚冰,丛培玮,王艳杰,等.脾气虚和脾阳虚模型大鼠空肠组织葡萄糖转运体5表达水平变化的实验研究〔J〕.中国全科医学,2016;19(3):332-6.
4丛培玮,尚冰,王艳杰,等.脾气虚和脾阳虚模型大鼠脑肠肽与下丘脑葡萄糖转运体1及葡萄糖转运体3表达水平变化的实验研究〔J〕.中国全科医学,2016;19(18):2201-5.
5闫玉梅,梅举,孙锟,等.水通道蛋白-1及其在心脏中作用的研究进展〔J〕.上海交通大学学报(医学版),2011;31(1):99-103.
6Butler TL,Au CG,Yang B,etal.Cardiac aquaproin expression in humans,rats,and mice〔J〕.Am J Physiol Heart Circ Physiol,2006;291(2):705-13.
7Kellen MR,Bassingthwaighte JB.Transient transcapillary exchange of water driven by osmotic forces in the heart〔J〕.Am J Physiol Heart Circ PHysiol,2003;285(3):1317-31.
8李志清,肖德权,王甲汉,等.大鼠烫伤早期心肌组织水通道蛋白1表达及其与心肌水肿的关系〔J〕.中华烧伤杂志,2013;29(3):245-8.
9黄庆先.血糖水平对糖尿病大鼠心肌GLUT1和GLUT4表达变化的影响〔D〕.济南:山东大学,2013.
10姜晓琳.脾气虚证模型大鼠心功能变化及其机制的研究〔D〕.沈阳:辽宁中医药大学,2016.
11赵俊林,纪阴心.体外循环肺损伤与水通道蛋白1基因表达相关性的实验研究〔J〕.生物医学工程与临床,2012;16(5):482-5.
12Tabbutt S,Nelson DP,Tsai N,etal.Induction of aquaporin-1 mRNA following cardiopulmonary bypass and reperfusion〔J〕.Mol Med,1997;3(9):600-9.
13Egan JR,Butler TL,Cole AD,etal.Myocardial ischwmia is more important than the effects of cardiopulmonary bypass on myocardial water handling and portoperative dusfunction:a pediatric animal model〔J〕.J Thorac Cardiovasc Surg,2008;136(5):1265-73.
14赵广西.水通道蛋白3和8在消化系统的表达及其在炎症性肠病动物模型中的改变〔D〕.上海:复旦大学,2014.
