膳食维生素B12添加与阿尔茨海默病的防治
2018-04-17黄亦依王欢欢
黄亦依 冯 潇 朱 炫 王欢欢
(杭州师范大学医学院,浙江 杭州 310036)
1浙江工商大学食品与生物工程学院食品安全重点实验室
阿尔茨海默病(AD)是一种神经退行性疾病,主要表现为进行性认知功能障碍,记忆力降低并伴随个性和行为改变,病变持续发展最终出现痴呆〔1〕。AD发病的最大影响因素是年龄,80岁以上人群患AD的概率高达20%以上〔1〕。20世纪以来,随着社会医疗水平的不断提高,人的寿命显著延长,AD发病率也快速上升。AD已成为影响老年人身体健康、生活质量最重要的疾病之一,预计到2050年,全球将有超过1亿的AD患者〔2〕。维生素(VitB12)的缺乏与AD的发生关系密切,这与VitB12参与机体许多重要生理过程有关。VitB12在体内作为辅酶参与多种生化过程,调节关键DNA或蛋白质的甲基化水平,调控溶酶体正常功能,以及其本身也具有一定的抗炎抗氧化作用。膳食VitB12的添加作为新型AD防治的辅助方法当前受到越来越多的关注,但膳食中VitB12的稳定性及安全性尚未作深入研究。本文将对VitB12缺乏与AD发生的机制,以及膳食VitB12添加与AD防治隐患作如下综述。
1 AD发病机制
AD的发生伴随一系列神经系统损伤症状,其最基本的病理特征是淀粉样沉淀和神经纤维缠结(NFTs)〔3〕。当前研究认为,AD患者脑内β淀粉样肽(Aβ)的沉积是产生神经损伤的主要原因〔1〕。Aβ数量的增多及二聚体、寡聚体、多聚体至淀粉样沉淀的形成对神经细胞造成损伤,激活神经胶质细胞。胶质细胞的激活可通过模式识别受体(PRR)活性的上调活化细胞内一系列炎症相关信号通路,从而上调细胞因子、趋化因子等促炎因子的转录和翻译。胶质细胞释放的大量炎症因子,如肿瘤坏死因子(TNF)α等,可以使tau蛋白过度磷酸化形成细胞内NFTs,从而造成更大范围的神经损伤。因此,神经炎症反应的抑制作为AD治疗的潜在靶点一直受到广泛关注,但至今仍鲜有切实有效的相关治疗药物和方案〔4〕。Aβ是它的前体淀粉样前体蛋白(APP)的剪切产物。APP可被β剪切酶(BACE)1和γ剪切酶(PS)1剪切,从而释放Aβ〔5〕。目前虽然已经有一些研究成功合成BACE1和PS1抑制剂,但临床效果甚微或副反应较大。当前对于AD的治疗主要依靠的仍然是胆碱能神经功能相关的缓减症状的方法,而真正针对发病机制的靶点药物仍乏善可陈。
2 维生素B12的缺乏与AD的发生
AD的发生常常伴随VitB12的缺乏。许多报道发现血清VitB12及叶酸水平的降低与认知能力的损伤有密切关系〔6〕。更为准确的神经生物学功能测试也显示B族维生素的缺乏与痴呆的发生之间的联系更为紧密〔7〕。早期研究认为这二者之间孰因孰果无定论,有可能二者互为因果,通常认为VitB12的缺乏往往伴随着AD相关认知功能的丧失。对于单纯性VitB12缺乏患者的研究发现,患者往往长期处在VitB12缺乏的状态中〔8,9〕;进一步流行病研究发现,长期缺乏VitB12的膳食摄入可加剧AD和轻度认知障碍的发生率〔10,11〕。另外,还有研究表明长期补充VitB12可推迟家族型AD和散发型AD的发病〔12,13〕。因此,目前认为VitB12的补充是预防AD发生的有效方法之一,许多AD高发人群都会遵医嘱长期规律摄取VitB12以延缓疾病的发生。
更为重要的是,老年患者往往是VitB12缺乏症的高危人群。老年人缺乏VitB12主要原因往往归咎于肠道系统对于VitB12吸收的下降。有研究显示,VitB12缺乏患者中,53%的患者消化吸收不良,33%患者处于长期恶性贫血,只有不到2%的患者是由于饮食问题引起VitB12的缺乏〔14〕。而且,通常老年患者胃炎的发病率高于正常值,胃酸分泌量减少,可进一步削弱VitB12的吸收。在非AD患者或轻度认知功能障碍的患者中,VitB12的缺乏也已被证实与患者认知功能的损伤相关〔15〕。因此,老年人不仅是VitB12缺乏的高危人群,也是AD发生的高危人群,这二者之间存在紧密的内在联系。
3 VitB12缺乏影响AD发生的可能机制
3.1VitB12的生化特性VitB12是一种水溶性维生素,它在机体许多生理功能中发挥着重要作用,如神经功能、红细胞的生成及DNA的合成等。VitB12又叫钴胺素,是体内唯一含金属元素的维生素,以相邻的4个吡咯环及1个钴原子组成的咕啉环为基本结构,化学分子式为C63H88CoN14O14P(图1)。根据咕啉环轴向上方的配基(-R)不同,则会产生不同形式的钴胺素类物质,包括氰基钴胺素(-CN)、羟基钴胺素(-OH)、水钴胺素(-H2O)、硝基钴胺素(-NO)、甲基钴胺素(-CH3)和脱氧腺苷钴胺素(-5-dA)等〔16〕。VitB12是所有这些衍生物的统称,其中氰基钴胺素不是VitB12的天然存在形式,它是在工业提纯时用氰化物取代天然钴胺素而得到的产物,商品形式的VitB12多为氰基钴胺素。VitB12参与的体内具体生化过程包括:将同型半胱氨酸转变为甲硫氨酸,又可将甲基丙二酸转变为琥珀酰辅酶A;将5-甲基四氢叶酸转变为四氢叶酸酯,这一过程在DNA的合成和红细胞的生成中至关重要〔17〕。VitB12无法被人体自身合成,必须通过外源摄取动物蛋白或植物加工制品并经体内充分消化获取。VitB12主要存在于肉类中,植物中的大豆及一些草药也含有VitB12。胃酸可将食物中的VitB12游离,随后与内因子结合,并在结肠末端被人体吸收。
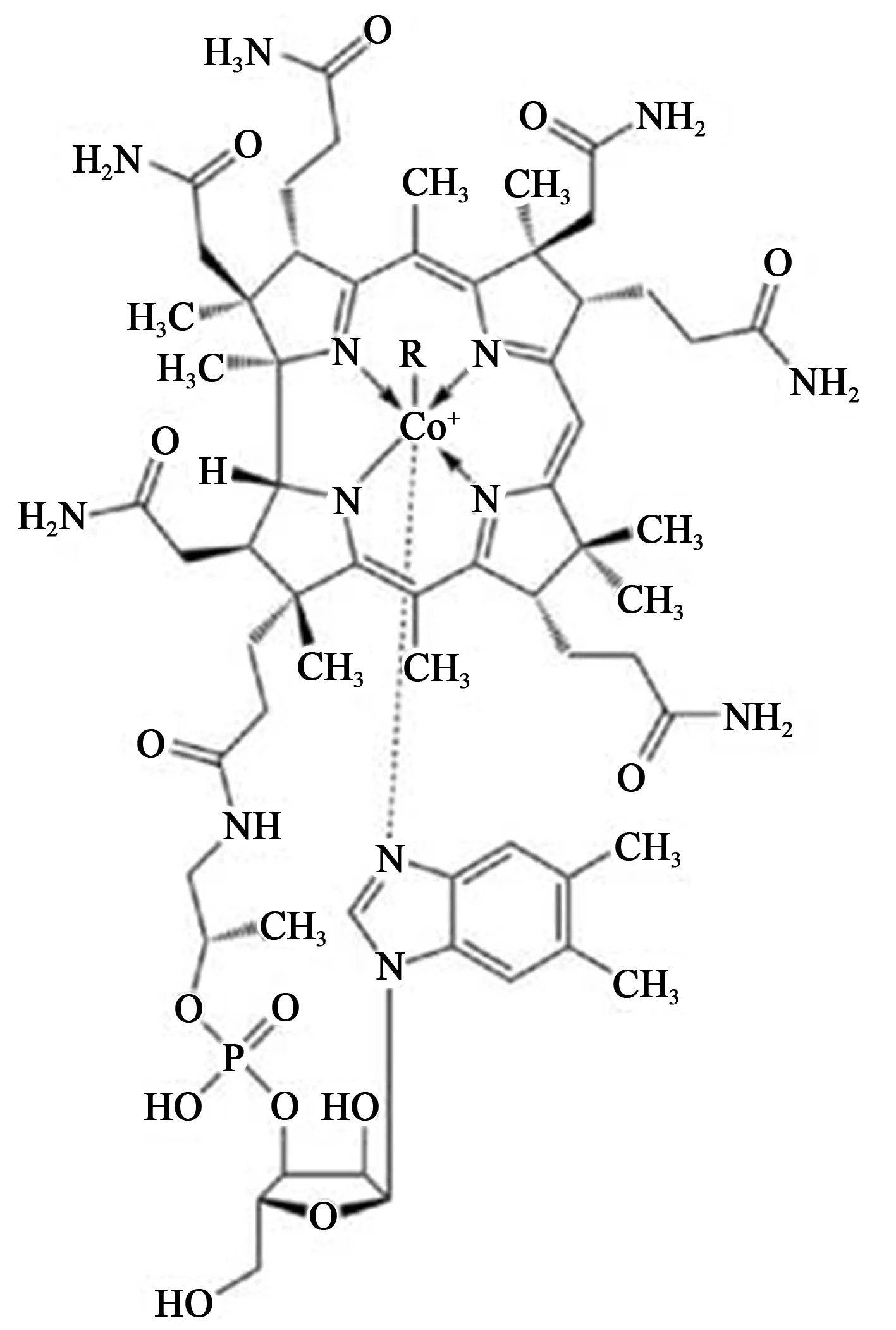
图1 VitB12分子结构示意图
3.2VitB12作为辅酶参与机体代谢通常认为VitB12的缺乏与神经损伤的关系存在两种机制,这两种机制都建立在VitB12作为辅酶参与体内许多生化反应的基础上。VitB12作为辅酶参与体内多项代谢反应中,最为重要的就是同型半胱氨酸(Hcy)的代谢。Hcy是一种含硫氨基酸,它并不参与蛋白质的合成,它只是甲硫氨酸(Methionine)代谢循环的中间产物〔18〕(图2)。Hcy是S-腺苷半胱氨酸(SAH)的代谢产物。SAH的有效代谢需要一些辅助因子的参与,其中包括较低剂量的叶酸和VitB12,而Hcy失活转化为S-腺苷甲硫氨酸(SAM)则需要较高剂量VitB12的帮助。因此,缺乏VitB12可阻碍Hcy的失活从而引起高半胱氨酸血症(HHcy)的产生。
体内半胱氨酸含量的升高引起的HHcy与许多疾病的发生密切相关,如冠状动脉疾病、外周血管疾病和脑卒中等〔19〕。除此之外,HHcy也被证实参与一些神经退行性疾病如AD的发生〔20,21〕。流行病学统计结果显示,AD患者血浆Hcy水平显著上升〔22〕。关于血浆Hcy水平作为一项相对独立的AD发病危险因素也在近期得到证实〔18,21〕,因此近年来血浆Hcy水平也成为AD发生的检测指标之一〔23,24〕。研究显示,VitB12的缺失可加速转基因AD小鼠模型脑部Aβ的沉积〔25,26〕;由高SAH饲料喂饲或低叶酸饲料喂饲引起的HHcy可显著上调小鼠体内PS1和BACE1活性及Aβ的产量(图2)〔27,28〕。
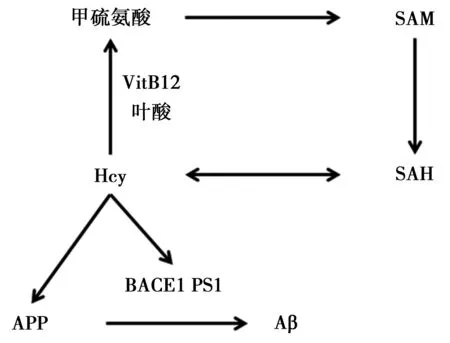
图2 VitB12参与体内甲硫氨酸代谢循环及其对AD相关APP剪切的影响
3.3VitB12参与甲基化修饰调节甲基化修饰是体内许多酶系统激活和DNA转录的关键调节步骤,而由叶酸和VitB12共同参与Hcy转化而来的SAM则是体内最重要的甲基化来源〔29〕。有研究表明,血浆Hcy水平的升高和体内甲基化代谢的失调有着密切关系。甲基化是DNA转录前修饰的重要方式之一,DNA的甲基化可引起染色质结构、DNA构象、DNA稳定性及DNA与蛋白质相互作用方式的改变,从而控制基因表达。通常情况下,在甲基转移酶的催化下,DNA的CG两个核苷酸的胞嘧啶被选择性地添加甲基,从而引起DNA的失活。体内甲基化代谢的异常会影响体内多种正常生理功能,包括神经细胞的正常功能、细胞的增殖增生和染色体双螺旋的稳定性等〔16〕。就AD相关PS1和BACE1而言,基因DNA的甲基化可有效控制其转录翻译,从而调控神经毒性Aβ的产生〔30〕。因此,VitB12引起DNA甲基化的效能将决定其对AD相关PS1、BACE1,甚至APP基因转录翻译的控制。有研究表明,无活性VitB12衍生物可通过竞争血浆VitB12运载蛋白降低VitB12本身的活性,从而弱化各类基因的甲基化。同时,也不排除VitB12衍生物本身可直接下调AD相关基因甲基化,影响Aβ的产生及其神经毒性作用〔22〕。
3.4VitB12的抗氧化作用在AD的发生过程中,过氧化反应的发生及内质网(ER)、线粒体的过氧化损伤,以及由此引发的活性氧(ROS)、一氧化氮(NO)的释放,都会加剧神经胶质细胞的激活及炎症反应和神经细胞进一步的损伤〔31〕。且有报道称,小鼠缺少VitB12可以上调脑脊液TNFα和表皮生长因子(EGF)水平,增强神经炎症反应,加剧神经损伤〔32〕。因此,VitB12对AD的神经保护作用除了通过相关基因蛋白表达直接调控Aβ的产生以外,还可以通过抵抗由Aβ神经毒性引起的ER损伤,弱化细胞炎症反应而间接发挥其作用。有报道称,VitB12可通过调节Sirtuin 1脱乙酰酶(SIRT1)活性及SIRT1下游一系列激酶的活化,调控细胞内分子伴侣蛋白(chaperon protein)以抵抗ER损伤〔33〕。VitB12分子中以钴元素为中心的卟啉环及5,6-二甲基苯并咪唑被认为是发挥该作用的重要结构。不同VitB12类似物在卟啉和咪唑环上的修饰对其抗氧化作用和抑制神经炎症作用有何不同,对细胞内ER、线粒体过氧化反应的作用,及对由Aβ产生的神经毒性作用或有害或有益,都还未见成熟研究。
3.5VitB12参与溶酶体功能调控VitB12的正常代谢需要溶酶体转运体的参与。VitB12从肠道吸收进入血浆或组织间液后可与钴胺素转运蛋白(TC)结合随循环系统运输,与靶细胞膜上特定受体结合,以VitB12-TC复合物的形式被细胞摄取〔34〕。VitB12-TC进入细胞后TC部分可被溶酶体消化,继而游离出VitB12,进一步参与各类细胞内生化反应。溶酶体内含有超过50种水解酶,溶酶体腔内的酸性pH对其发挥正常功能十分关键。对于VitB12而言,胞内溶酶体的正常运作对VitB12在胞内的释放并转运至线粒体这一过程至关重要,这一过程受到溶酶体膜上的两种蛋白LMBD1和ABCD4对VitB12的调控〔35~37〕。各种VitB12衍生物在溶酶体中代谢过程的不同特点目前并没有深入研究,VitB12各取代基对溶酶体膜蛋白LMBD1和ABCD4活性的不同影响也未有详细报道。与此同时,AD相关Aβ在细胞内外的蓄积也受到溶酶体代谢的调节:一方面AD发生过程中生成的部分Aβ可被溶酶体消化,从而缓解细胞内Aβ载量及由此带来的细胞毒性;另一方面,不断增加的Aβ量也可加重溶酶体负担,从而破坏膜蛋白LMBD1和ABCD4活性,影响Aβ的正常降解〔38〕。VitB12与Aβ的代谢均依赖于溶酶体这一特性决定了,VitB12的正常水平及VitB12衍生物不同取代基对于溶酶体膜蛋白活性的调控,都将影响细胞内Aβ的产量及其导致的AD相关神经损伤的症状。
4 膳食VitB12添加的风险
早期对于VitB12缺乏的治疗往往采用传统的肌肉注射法〔17〕,而后又被口服片剂取代〔39〕。随着社会医疗水平的进步及大众对于健康养生的关注和重视,目前除人工合成VitB12片剂以外,许多人也选择通过食用富含VitB12的食物来增加VitB12的摄取,如一些海鲜、肉类和大部分腌制食品等。研究显示,VitB12的膳食添加可以有效改善患者血浆Hcy水平并部分改善或延缓患者认知功能的退化〔40〕。VitB12分别以腺基钴胺素和甲基钴胺素两种形式参与了体内各种代谢反应〔41〕。人工合成的VitB12主要以较为稳定的氰钴胺为主,进入体内后可被代谢为可被人体利用的腺钴胺和甲钴胺。食物中的VitB12的类型则要丰富得多,存在许多类型的VitB12衍生物或类似物,而这些类似物是否在体内能转变为人体能利用的形式则未能证实。值得关注的是,一些VitB12的衍生物会造成某些酶系统的失活,从而对细胞的正常代谢产生负面效应。研究人员在猴头菇中检测到了c-内酰钴胺素,并发现c-内酰钴胺素可以在体内或体外与特定酶结合并使其丧失生理功能〔42,43〕。由此说明,各种VitB12类似物在体内的作用不尽相同,一些衍生物在进入体内后可代谢为腺基钴胺素和甲基钴胺素参与如Hcy的失活等生化反应,而另一些则不具备此功能,以无效VitB12的形式存在体内,妨碍VitB12的正常功能,甚至产生其他毒性作用。明确各种VitB12衍生物的生物活性及其对AD相关基因、蛋白表达、活化的影响,对Aβ产生的神经毒性的调控作用,将有利于食品药品生产中有效规避有害副产物产生,提高其有效成分的利用率。
综上,VitB12作为人体多项代谢过程中重要的调控因子,它的缺乏将会引起机体多方面的损伤,神经功能损伤及相关认知功能的障碍,从而引起的老年痴呆或AD相关症状得到了越来越多的关注。VitB12的缺乏可以调控机体内多项生化反应的辅酶活性,DNA转录的甲基化修饰,包括ER、线粒体、溶酶体等细胞器的正常功能,从而影响神经细胞的活性和正常功能(图3)。外源性补充VitB12被证实可有效降低AD相关神经损伤的症状,但食品药品中存在的不同VitB12衍生物进入体内后多经历的化学反应、代谢途径及对机体各项机能所产生的可能影响都尚没有深入系统的研究。明确VitB12各类衍生物对AD相关基因、蛋白的影响,将可以进一步提高VitB12膳食添加对AD防治的效果和效率。
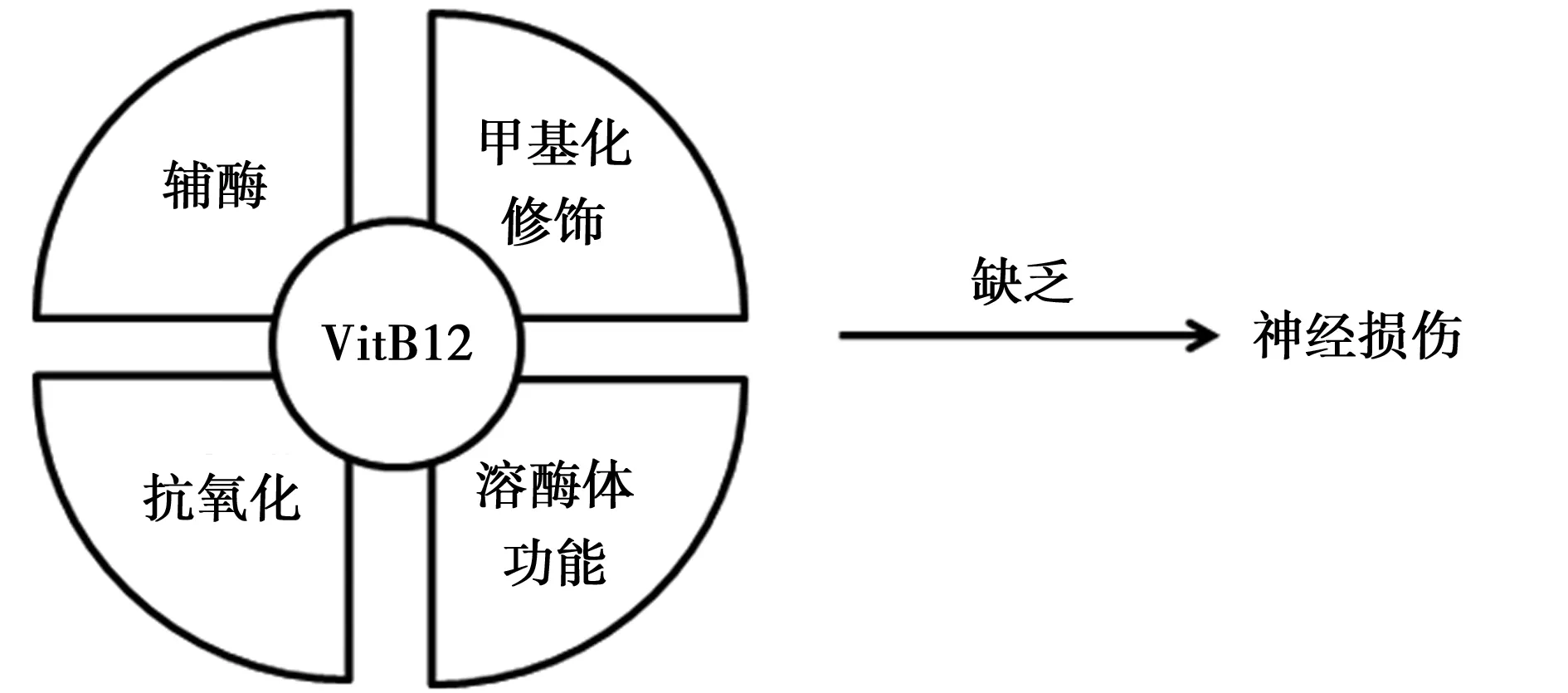
图3 VitB12参与机体多种代谢反应与AD相关神经损伤的关系示意图
1Selkoe DJ.Alzheimer′s disease:genes,proteins,and therapy 〔J〕.Physiol Rev,2001;81(2):741-66.
2Karran E,Mercken M,De Strooper B.The amyloid cascade hypothesis for Alzheimer′s disease:an appraisal for the development of therapeutics 〔J〕.Nat Rev Drug Discov,2011;10(9):698-712.
3Serrano-Pozo A,Frosch MP,Masliah E,etal.Neuropathological alterations in Alzheimer disease 〔J〕.Cold Spring Harb Perspect Med,2011;1(1):a006189.
4Patel NS,Paris D,Mathura V,etal.Inflammatory cytokine levels correlate with amyloid load in transgenic mouse models of Alzheimer′s disease 〔J〕.J Neuroinflammation,2005;2(1):9.
5Hardy J,Selkoe DJ.The amyloid hypothesis of Alzheimer′s disease:progress and problems on the road to therapeutics 〔J〕.Science,2002;297(5580):353-6.
6Faux NG,Ellis KA,Porter L,etal.Homocysteine,vitamin B12,and folic acid levels in Alzheimer′s disease,mild cognitive impairment,and healthy elderly:baseline characteristics in subjects of the Australian Imaging Biomarker Lifestyle study 〔J〕.J Alzheimers Dis,2011;27(4):909-22.
7Chang N,Kim E,Kim KN,etal.Folate nutrition is related to neuropsychological functions in the elderly 〔J〕.Nutr Res Pract,2009;3(1):43-8.
8Planells E,Sanchez C,Montellano MA,etal.Vitamins B6 and B12 and folate status in an adult Mediterranean population 〔J〕.Eur J Clin Nutr,2003;57(6):777-85.
9Tucker KL,Qiao N,Scott T,etal.High homocysteine and low B vitamins predict cognitive decline in aging men:the Veterans Affairs Normative Aging Study 〔J〕.Am J ClinNutr,2005;82(3):627-35.
10Mizrahi EH,Jacobsen DW,Debanne SM,etal.Plasma total homocysteine levels,dietary vitamin B6 and folate intake in AD and healthy aging 〔J〕.J Nutr Health Aging,2003;7(3):160-5.
11Corrada MM,Kawas CH,Hallfrisch J,etal.Reduced risk of Alzheimer′s disease with high folate intake:the baltimore longitudinal study of aging 〔J〕.Alzheimers Dement,2005;1(1):11-8.
12Chan A,Paskavitz J,Remington R,etal.Efficacy of a vitamin/nutriceutical formulation for early-stage Alzheimer′s disease:a 1-year,open-label pilot study with an 16-month caregiver extension 〔J〕.Am J Alzheimers Dis Other Demen,2008;23(6):571-85.
13Flicker L,Martins RN,Thomas J,etal.B-vitamins reduce plasma levels of beta amyloid 〔J〕.Neurobiol Aging,2008;29(2):303-5.
14Henoun LN,Noel E,Ben AM,etal.Cobalamin deficiency due to non-immune atrophic gastritis in elderly patients.A report of 25 cases 〔J〕.J Nutr Health Aging,2005;9(6):462.
15Kwok T,Lee J,Ma RC,etal.A randomized placebo controlled trial of vitamin B12 supplementation to prevent cognitive decline in older diabetic people with borderline low serum vitamin B12 〔J〕.Clin Nutr,2016;S0261-5614(16):31308-5.
16Grober U,Kisters K,Schmidt J.Neuroenhancement with vitamin B12-underestimated neurological significance 〔J〕.Nutrients,2013;5(12):5031-45.
17Langan RC,Zawistoski KJ.Update on vitamin B12 deficiency 〔J〕.Am Fam Physician,2011;83(12):1425-30.
18Oikonomidi A,Lewczuk P,Kornhuber J,etal.Homocysteine metabolism is associated with cerebrospinal fluid levels of soluble amyloid precursor protein and amyloid beta 〔J〕.J Neurochem,2016;139(2):324-32.
19Boushey CJ,Beresford SA,Omenn GS,etal.A quantitative assessment of plasma homocysteine as a risk factor for vascular disease.Probable benefits of increasing folic acid intakes 〔J〕.JAMA,1995;274(13):1049-57.
20Leblhuber F,Walli J,Artner-Dworzak E,etal.Hyperhomocysteinemia in dementia 〔J〕 J Neural Transm,2000;107(12):1469-74.
21Seshadri S,Beiser A,Selhub J,etal.Plasma homocysteine as a risk factor for dementia and Alzheimer′s disease 〔J〕.N Engl J Med,2002;346(7):476-83.
22McCaddon A,Hudson P,Abrahamsson L,etal.ageing and aberrant assimilation of vitamin B12 in Alzheimer′s disease 〔J〕.Dement Geriatr Cogn Disord,2001;12(2):133-7.
23Morris MS.Homocysteine and Alzheimer′s disease 〔J〕.Lancet Neurol,2003;2(7):425-8.
24Seshadri S.Elevated plasma homocysteine levels:risk factor or risk marker for the development of dementia and Alzheimer′s disease〔J〕?J Alzheimers Dis,2006;9(4):393-8.
25Fuso A,Nicolia V,Cavallaro RA,etal.B-vitamin deprivation induces hyperhomocysteinemia and brain S-adenosylhomocysteine,depletes brain S-adenosylmethionine,and enhances PS1 and BACE expression and amyloid-beta deposition in mice 〔J〕.Mol Cell Neurosci,2008;37(4):731-46.
26Zhuo JM,Pratico D.Acceleration of brain amyloidosis in an Alzheimer′s disease mouse model by a folate,vitamin B6 and B12-deficient diet 〔J〕.Exp Gerontol,2010;45(3):195-201.
27Chan A,Tchantchou F,Rogers EJ,etal.Dietary deficiency increases presenilin expression,gamma-secretase activity,and Abeta levels:potentiation by ApoE genotype and alleviation by S-adenosyl methionine 〔J〕.J Neurochem,2009;110(3):831-6.
28Hinterberger M,Fischer P.Folate and Alzheimer:when time matters 〔J〕.J Neural Transm,2013;120(1):211-24.
29Duthie SJ.Folate and cancer:how DNA damage,repair and methylation impact on colon carcinogenesis 〔J〕.J Inherit Metab Dis,2011;34(1):101-9.
30Fuso A,Cavallaro RA,Zampelli A,etal.gamma-Secretase is differentially modulated by alterations of homocysteine cycle in neuroblastoma and glioblastoma cells 〔J〕.J Alzheimers Dis,2007;11(3):275-90.
31Wang X,Wang W,Li L,etal.Oxidative stress and mitochondrial dysfunction in Alzheimer′s disease 〔J〕.Biochim Biophys Acta,2014;1842(8):1240-7.
32Miller JW.Vitamin B12 deficiency,tumor necrosis factor-alpha,and epidermal growth factor:a novel function for vitamin B12 〔J〕?Nutr Rev,2002;60(5 Pt 1):142-4.
33Ghemrawi R,Pooya S,Lorentz S,etal.Decreased vitamin B12 availability induces ER stress through impaired SIRT1-deacetylation of HSF1 〔J〕.Cell Death Dis,2013;4:e553.
34Seetharam B,Yammani RR.Cobalamin transport proteins and their cell-surface receptors 〔J〕.Expert Rev Mol Med,2003;5(18):1-18.
35Rosenblatt DS,Hosack A,Matiaszuk NV,etal.Defect in vitamin B12 release from lysosomes:newly described inborn error of vitamin B12 metabolism 〔J〕.Science,1985;228(4705):1319-21.
36Coelho D,Kim JC,Miousse IR,etal.Mutations in ABCD4 cause a new inborn error of vitamin B12 metabolism 〔J〕.Nat Genet,2012;4(10):1152-5.
37Rutsch F,Gailus S,Miousse IR,etal.Identification of a putative lysosomalcobalamin exporter altered in the cblF defect of vitamin B12 metabolism 〔J〕.Nat Genet,2009;41(2):234-9.
38Zhao H,Li H,Ruberu K,etal.Impaired lysosomalcobalamin transport in Alzheimer′s disease 〔J〕.J Alzheimers Dis,2015;43(3):1017-30.
39Toh BH,van Driel IR,Gleeson PA.Pernicious anemia 〔J〕.N Engl J Med,1997;337(20):1441-8.
40Douaud G,Refsum H,de Jager CA,etal.Preventing Alzheimer′s disease-related gray matter atrophy by B-vitamin treatment 〔J〕.Proc Natl Acad Sci U S A,2013;110(23):9523-8.
41Roth JR,Lawrence JG,Bobik TA.Cobalamin (coenzyme B12):synthesis and biological significance 〔J〕.Annu Rev Microbiol,1996;50(1):137-81.
42Stabler SP,Brass EP,Marcell PD,etal.Inhibition of cobalamin-dependent enzymes by cobalamin analogues in rats 〔J〕.J Clin Invest,1991;87(4):1422-30.
43Teng F,Bito T,Takenaka S,etal.Vitamin B12〔c-lactone〕,a biologically inactive corrinoid compound,occurs in cultured and dried lion′s mane mushroom (Hericiumerinaceus) fruiting bodies 〔J〕.J Agric Food Chem,2014;62(7):1726-32.
