4种植物对水体中苯的净化效果及其抗性响应
2018-04-16裴淑兰王凯雷淑慧
裴淑兰,王凯,雷淑慧
山西林业职业技术学院,山西 太原 030009
苯(C6H6)是最简单的芳烃,俗称天那水,常温下为无色透明液体,易挥发,易燃,具有芳香型气味,密度为0.88 g·mL-1,微溶于水,易溶于有机溶剂,其自身也是一种良好的溶剂(路守彦,2011)。由于苯具有毒性,已经被世界卫生组织列为强烈致癌物质(吕超,2013;兰国栋等,2009)。
苯在工业生产中的使用非常普遍,常被应用于塑料、染料、去污剂、杀虫剂、纤维、橡胶、汽油添加剂等工业生产中(路守彦,2011),随着此类工业废水的排放,苯不断进入水环境中,成为水体中常见污染物之一,对水环境和人类造成严重的影响和危害(Carletti et al.,2009)。因此,研究水体中苯的净化对于保护和改善人类生存环境具有重要意义。
净化苯的传统方法主要是物理化学方法,如吸附法、光催化氧化法等,但往往操作复杂,费用高,且存在二次污染(Froom,2008)。近年来,利用植物可以吸附、吸收或降解环境中有毒物质的能力对污染水体进行修复的相关技术研究(Chaney,1983;胡鹏杰等,2014;陆成云等,2015;)已经成为国内外学者研究的热点。目前此类方法被较多地应用于水体中氮、磷及重金属污染物的净化,而对苯的植物修复研究还仅仅集中于对室内空气中苯的净化方面(周茜茜等,2013;王彦靖等,2014;来伊楠等,2015;鲁敏等,2016;鲁敏等,2017),将其应用于水体中苯的净化却鲜见报道(樊兰英等,2010;于方磊等,2012;董晓丽等,2013;裴亮宇等,2013)。本研究以菊芋(Helianthus tuberosus L.)、旋覆花(Inula japonica Thunb.)、千屈菜(Lythrum salicaria L.)和红蓼(Polygonum orientale L.)4 种抗逆性、适应性强,耐水湿的观花植物为修复试验材料,探讨其对污水河道水体中苯的去除能力,旨在为污水河道水体中苯的净化及污水河道绿化提供新的植物种类选择。
1 材料和方法
1.1 材料的采集与驯化
试验于2016年7月进行,4种观花植物分别为菊芋、旋覆花、千屈菜和红蓼,均采自太原市涧河大同路至胜利街段。选择生长健壮,植株挺拔,无病虫害,叶色鲜绿,生长期相同的植株,用铁锹挖起后连土带回实验室。反复冲洗植物根部泥沙,直至根部变为鲜白色,而后放入塑料桶(桶口直径25 cm,深35 cm)中,每桶5株。桶内加入3 L蒸馏水和pH值为7的Hoagland营养液150 mL,进行为期5 d的适应性培养。
1.2 试验设置
选择长势良好,无枯黄叶片,株高、地径、生物量相近的植株(表1)。将植物的根部浸入0.1%的KMnO4中杀菌10 min,再浸入蒸馏水中缓解20 min,用滤纸吸干根部水分后放入经消毒后的塑料瓶中,每瓶放置 1株植物,分别标记为菊芋(1)、旋覆花(2)、红蓼(3)和千屈菜(4)。
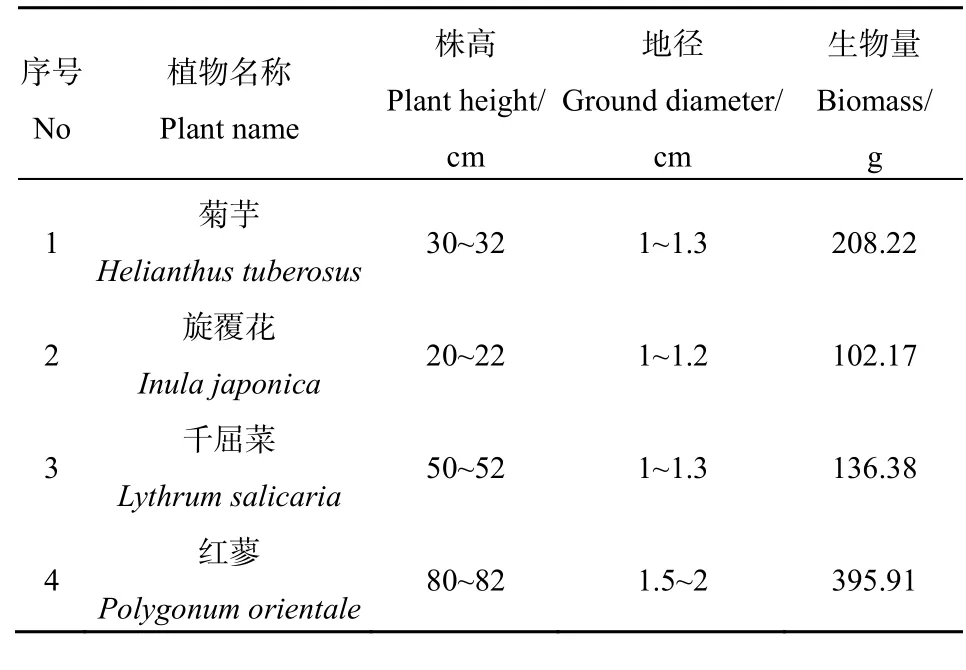
表1 植物材料的规格Table 1 Size of different species of plants
1.2.1测定生物量变化试验
试验在山西林业职业技术学院恒温温室内进行,试验期间的环境条件为昼夜比15 h∶9 h,温度为(29±1) ℃,相对湿度为 68%±5%,预实验测得苯在此条件下在水中的溶解度较低,平均质量浓度为1.75 g·L-1,与赵剑英等(2009)得出的苯在水中的溶解度很低,仅为1.75 g·L-1的结论相符。所以,本研究以1.75 g·L-1作为苯处理的试验浓度。每种植物设置12个重复样,其中6个作为处理组,6个作为对照组。在处理组中,将配好的1.75 g·L-1苯溶液灌入经过消毒的350 mL塑料瓶中(瓶口直径5 cm),每瓶300 mL,其中含有Hoagland营养液15 mL供植物生长,CuSO43 mg以抑藻,氨苄青霉素10 mg以抑菌(施翔等,2008)。在对照组中,不添加植物,仅在瓶中用蒸馏水添加 15 mL含苯营养液。瓶口用塑料薄膜和胶带密封,薄膜上扎小孔若干,以便植物呼吸,分别于试验开始的第0天和第30天时测定植物生长量,并计算变化量。
1.2.2测定苯去除率和生理指标试验
每种植物设置 12个重复样,按照上述方法在瓶中灌入 1.75 g·L-1苯溶液后封口。分别于第0、5、10、15、20、25、30天测定各组溶液中剩余苯的浓度和各项生理指标,数据处理时将第0天的初始数据作为对照,结果取各组数据的平均值。
1.3 试验方法
1.3.1苯去除率的测定
采用分光光度法测定溶液中剩余苯的浓度(于方磊等,2012),在252 nm处测定吸光值,根据苯浓度与吸光值的函数关系进行计算,y=927.8x(R2=0.97)(于方磊等,2012)。其中,y为苯的质量浓度(mg·L-1),x为吸光值,再通过苯的质量浓度计算苯去除率,公式如下:
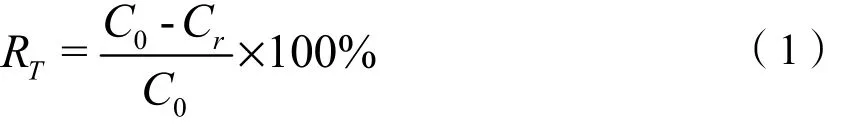
式中,RT为苯的去除率;C0为溶液中苯的初始质量浓度(mg·L-1);Cr为处理结束时溶液中剩余苯的质量浓度(mg·L-1)。
1.3.2生长指标的测定
分别在试验初始和终止时,每组随机选择3株植物,用滤纸将植物体水分吸干后切开,分为地上部分和地下部分两份,置于80 ℃下烘干4 h至恒重,使用托盘天平称取重量,比较试验前后植物地上和地下部分生物量的增长率R(尹程等,2012),计算公式如下:
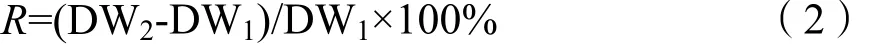
式中,DW1和 DW2分别为试验初始和终止时植物地上或地下部分生物量。
1.3.3生理指标的测定
1.3.3.1植物细胞伤害指标的测定
在各试验组植物体中部选取向阳的健康叶片,避开主脉,剪碎,称量1 g样品待测。H2O2含量的测定参照Sergiev et al.(1997)的方法,在240 nm处测定吸光值,通过标准曲线计算数值。丙二醛(MDA)含量的测定采用硫代巴比妥酸法(郝建军等,2001),用分光光度计分别在450、532和600 nm处测定吸光值(郝建军等,2001),根据以下公式计算MDA含量(-1μmolg·):

式中,Vt为提取液的总体积(mL);Vs为测定用提取液体积(mL);W为取样重量(g)。
1.3.3.2植物体内抗氧化酶的测定
超氧化物歧化酶(SOD)活性采用 NBT还原法测定(张至良,2003);过氧化物酶(POD)活性采用愈创木酚比色法(420 nm)(张至良,2003);过氧化氢酶(CAT)活性采用过氧化氢分解法(张至良,2003)。
1.3.3.3植物体内渗透调节物质的测定
采用小液流法测定植物体的水势(张至良,2003),可溶性蛋白含量采用考马斯亮蓝法进行测定(郝建军等,2001),游离脯氨酸含量采用酸性茚三酮法进行测定(郝建军等,2001),可溶性糖含量采用蒽酮比色法进行测定(张至良,2003)。
1.3.3.4植物光合指标的测定
每组随机选择 3株植物,每株植物选择中间向阳的叶片3枚,用LI-COR-6400XT(LICOR,USA)便携式光合仪测定其净光合速率(Pn)。叶绿素含量的测定时参照张宪政的方法(张宪政,1992),健康功能叶片用直径6 mm打孔器取5枚圆形小叶片,用体积分数为 95%的乙醇浸提,而后用分光光度计测定吸光值并计算叶绿素含量,结果取平均值。
1.4 数据分析与作图
试验数据运用Excel 2010和SPSS 19.0软件处理,运用Excel 2010和Origin 8.0作图。结果以各试验组计算结果的平均值表示。
2 结果与分析
2.1 4种植物对水体中苯的去除效果
从图1可知,4种植物对水体中苯的去除率随着处理时间的延长呈现上升趋势。其中,第5天内各种植物对苯的去除率迅速升高,此后,除红蓼对苯的去除率持续快速升高外,其他3种植物对苯的去除率的升高趋势减缓。至第 30天时,菊芋、旋覆花、千屈菜和红蓼对苯的去除率分别分别达到了59.83%、26.94%、21.14%和 78.22%,按去除效果大小排序为红蓼>菊芋>旋覆花>千屈菜。不加入植物的对照组中苯的消耗量为0.13 g·L-1,将其作为误差对数据进行校正。
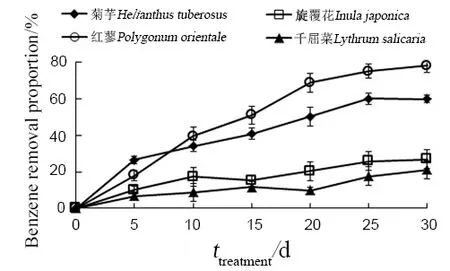
图1 4种植物对水体中苯的去除效果Fig. 1 Effect of four species of plants for benzene removal
2.2 苯胁迫对4种植物生长状况的影响
如图2A所示,第30天时菊芋、旋覆花和千屈菜地上部分的生物量增长量与各自对照相比均达到极显著水平(P<0.01),而红蓼和对照差异不明显(P>0.05)。菊芋、旋覆花、千屈菜和红蓼第30天内的生物量增长量分别比对照降低了24%、32%、35%和5%。
如图2B所示,第30天时4种植物地下部分生物量增长量与对照相比均达到显著水平(P<0.05),且旋覆花和千屈菜的生物量增长量达到了极显著水平(P<0.01)。菊芋、旋覆花、千屈菜和红蓼第30天内生物量增长量分别比对照低10%、28%、44%和16%。
2.3 水体中苯对4种植物细胞伤害指标的影响
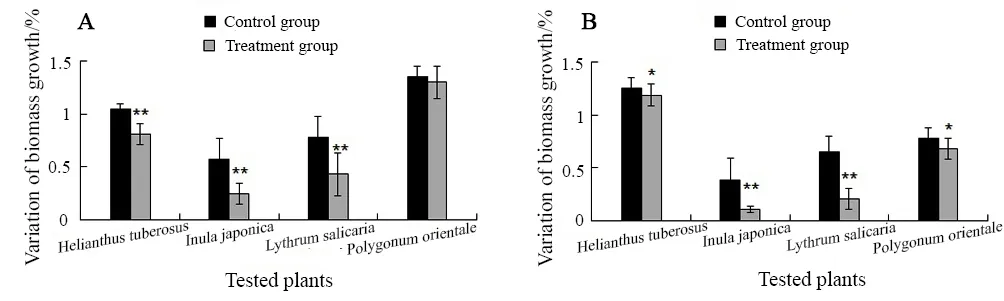
图2 苯胁迫对4种植物生物量的影响Fig. 2 Effects of benzene on biomass of the four plants
如图3A所示,在试验期内,溶液中的苯使得4种植物体内 H2O2含量呈现先升高后逐渐回落的趋势。其中,旋覆花和千屈菜体内的 H2O2含量在第30天内始终高于对照(P<0.05),并分别在第5天和第10天时达到最高;菊芋和红蓼在第10天内较对照有所上升之后(P<0.05),分别在第15天和第25天时恢复到对照水平(P>0.05)。
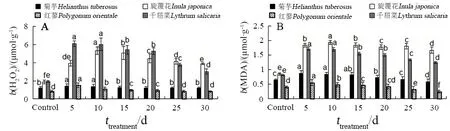
图3 4种植物在苯胁迫下的细胞伤害分析Fig. 3 Analysis of the damage of cell membrane of the four plants under benzene stress
如图3B所示,4种植物体内MDA含量随着溶液中苯处理时间的延长呈现先升高后下降的趋势。其中,菊芋和红蓼分别在第20天和第25天后恢复到对照水平(P>0.05),此后低于对照(P<0.05);而旋覆花和千屈菜在整个试验期内MDA 含量始终显著高于对照(P<0.05),且在第10天时均达到最高值,到第30天时分别较对照高出94%和52%。
2.4 水体中苯对 4种植物体内抗氧化酶活性的影响
如图4A所示,菊芋体内SOD活性在第5天时达到最大值,比对照高出 21.91%,但在第 10天后便恢复到对照水平(P>0.05)。旋覆花体内SOD活性在第 5~10天显著下降并低于对照(P<0.05),此后呈升高趋势,第15天后显著高于对照(P<0.05),至第30天时比对照高出59.76%。千屈菜体内SOD活性随着时间的延长呈先升高后下降的趋势,在第 15~20天时达到最大值(P<0.05)。红蓼体内SOD活性仅在第5天时高于对照,此后迅速恢复至对照水平,并在整个试验时间内保持稳定(P>0.05)。
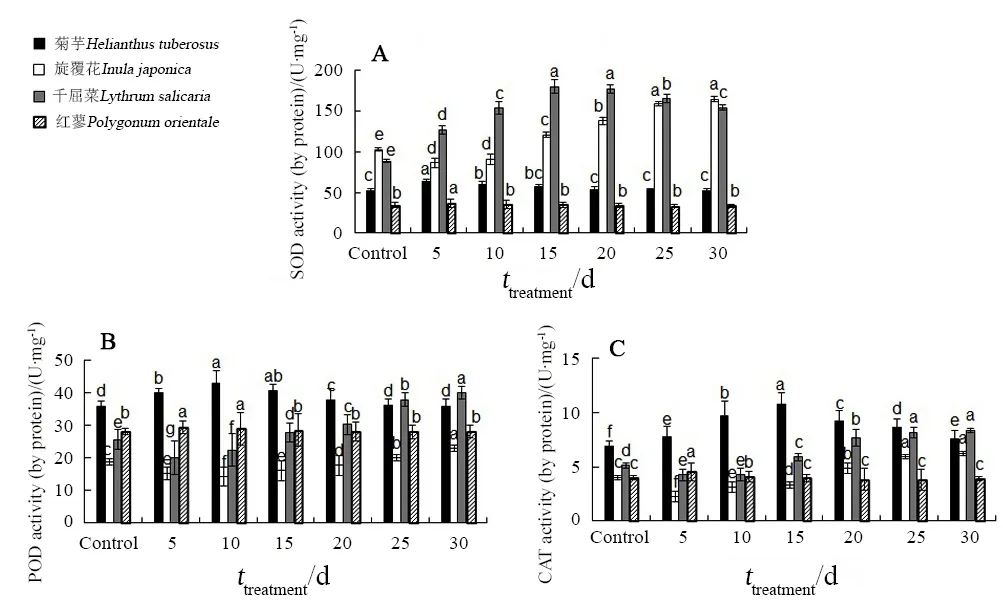
图4 苯胁迫下4种植物体内保护酶的变化Fig. 4 Variations of protective enzymes in the four plants under benzene stress
如图4B所示,菊芋和红蓼体内POD活性随着处理时间的延长呈先升高后下降趋势,且分别在第25天和第15天恢复至对照水平(P>0.05)。旋覆花和千屈菜体内 POD活性则随着处理时间的延长而先降低后升高,分别在第25天和第15天后高于对照(P<0.05)。
如图4C所示,菊芋和红蓼体内CAT活性随着处理时间的延长呈先升高后下降趋势,但菊芋的CAT活性在整个试验期内始终显著高于对照(P<0.05),而红蓼的CAT活性仅在第5~10天内高于对照,此后便回落至对照水平(P>0.05)。
2.5 水体中苯对4种植物体内渗透调节物质的影响
如图5A所示,菊芋和红蓼叶片水势随着处理时间的延长呈先降低后升高的趋势,在第 5~30天之内均低于对照(P<0.05),且在第20天时均达到最小值。千屈菜叶片水势则随着处理时间的延长呈现逐渐下降的趋势(P<0.05)。旋覆花叶片水势在第5~10天高于对照(P<0.05),此后呈下降趋势,第10~30 天内均低于对照(P<0.05)。
如图5B所示,菊芋、千屈菜和红蓼体内的可溶性蛋白含量随着处理时间的延长呈现逐渐升高后趋于稳定的趋势。而旋覆花的可溶性蛋白则在第15天内低于对照(P<0.05),此后呈上升趋势,至第20天后高于对照(P<0.05)。
如图 5C所示,菊芋和红蓼体内游离脯氨酸含量随着时间的延长呈现先升高后下降的趋势,而第30天时红蓼的游离脯氨酸含量恢复至对照水平(P>0.05),菊芋虽有所下降却仍高于对照水平(P<0.05)。千屈菜的游离脯氨酸含量随着时间延长而逐渐上升。旋覆花的游离脯氨酸含量则在第 10天时显著下降后逐渐升高(P<0.05)。
如图5D所示,菊芋、千屈菜和红蓼体内可溶性糖含量随着时间的延长呈现逐渐升高并趋于稳定的趋势(P<0.05),而旋覆花却呈现先升高后下降再升高的趋势(P<0.05)。
2.6 水体中苯对4种植物光合指标的影响
如图6A所示,4种植物的Pn随着处理时间的延长呈现先降低后升高的趋势,其中菊芋和旋覆花在第25天时恢复至对照水平(P>0.05),红蓼则在第10天后恢复至对照水平(P>0.05),而千屈菜虽然不断恢复升高,但第 30天时仍然低于对照水平(P<0.05)。
如图6B所示,4种植物的叶绿素含量也随着处理时间的延长呈现先降低后升高的趋势,其中菊芋和旋覆花在第25天后恢复至对照水平(P>0.05),千屈菜则在第30天时恢复至对照水平(P>0.05),而红蓼在第15天即可恢复至对照水平(P>0.05)。
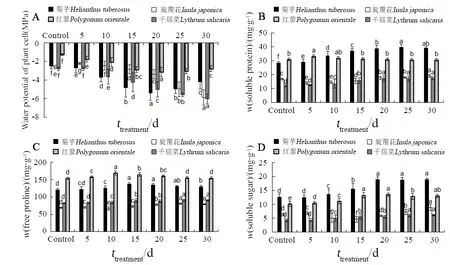
图5 苯胁迫对4种植物体内渗透调节物质的变化Fig. 5 Variations of osmotic regulators in the four plants under benzene stress
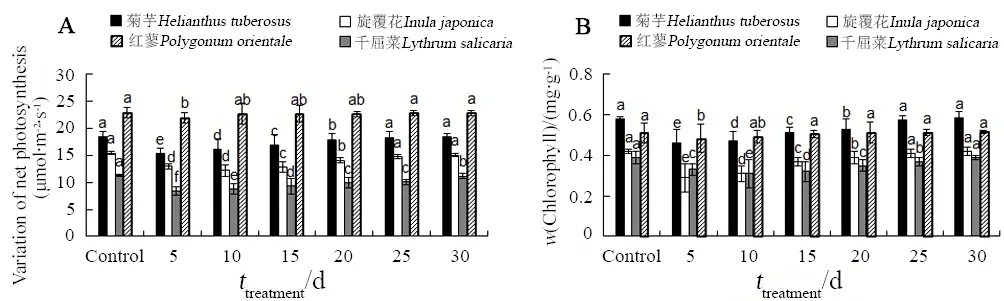
图6 苯胁迫下4种植物光合指标的变化Fig. 6 Variations of photosynthetic indexes of the four plants under benzene stress
3 讨论与结论
3.1 讨论
本研究应用4种观花植物对水体中的苯进行净化处理,结果显示,4种植物对苯具有不同程度的去除效果,按去除能力的大小排序为红蓼>菊芋>旋覆花>千屈菜。于方磊等(2012)研究发现,普生轮藻(Chara vulgaris)、豆瓣菜(Nasturium officinale)和菹草(Potamogeton crispus)对水体中苯的最大去除率分别达到35.26%、69.71%和55.45%。周茜茜等(2013)研究发现,72 h内金边吊兰(Chlorophytum comosum)、常青藤(Hederanepalensis var. sinensis)和绿萝(Scindapsus aureus)3种植物对熏气密封仓中不同浓度苯的去除效果均达到 85%以上,且单位叶面积苯的去除率大小顺序为常青藤>金边吊兰>绿萝。王彦靖等(2014)研究了白鹤芋(Spathiphyllum kochii)等9种室内植物对40 μL苯挥发气体的吸收效果,结果表明,24 h内9种植物对苯气体的去除效果大小顺序为白鹤芋>绿萝>金边虎尾兰(Sansevieria trifasciata)>蟹爪兰(Schlumlergera truncate)>樱花吊兰(Mesembryanthemum cordifolium)>君子兰(Clivia miniata)>巴西美人(Dracaena deremensis)>青苹果竹芋(Calathea rotundifolia)>吊兰(Chlorophytum comosum),其中效果最好的白鹤芋可以达到89.28%。可见,不同植物无论对于水体还是空气中的苯污染均具有一定去除效果。
苯胁迫对本研究4种植物生长状况有不同程度的负面影响,且地上部分和地下部分的受影响程度不同。其中,苯对地上部分影响的强弱顺序为旋覆花>千屈菜>菊芋>红蓼;对地下部分影响的强弱顺序为旋覆花>千屈菜>红蓼>菊芋。生物量(干重)是衡量植物体内有机物和营养成分积累、光合作用和呼吸作用强弱的重要指标,植物在受到逆境胁迫时,通常其生长会受到干扰,可以用植物的生物量来反映植物对逆境胁迫的抗性(Liu et al.,2008;唐宇力等,2017)。合并计算苯胁迫对 4种植物总生物量的影响,初步判断4种植物对苯的耐受能力顺序为红蓼>菊芋>千屈菜>旋覆花。
逆境胁迫会加剧植物细胞膜脂过氧化程度,导致其产生过量的MDA,反映细胞受伤害的程度,这一过程和植物体内H2O2的积累有关(蔡殷楠等,1979)。据报道,青苹果竹芋、吊兰、金边虎尾兰、巴西美人在苯胁迫下MDA含量增幅较大,耐受性较弱;而樱花吊兰则受影响不明显,耐性较强(王彦靖等,2014)。本研究中,菊芋和红蓼在第 30天后 MDA含量低于对照,H2O2含量也恢复至对照水平,耐苯能力较强;旋覆花和千屈菜第30天后 MDA含量仍高于对照,H2O2过量积累,耐苯能力低于前两者。
植物可以通过提高体内保护酶活性来清除自由基,抵御胁迫伤害,但是胁迫过度又会抑制酶的活性(鲍芳等,2007;鲁敏等,2017)。本研究中,SOD、POD和CAT作为植物常见的3种保护酶,其活性均受到苯胁迫的影响。其中,菊芋和红蓼在第30天后可以恢复至对照水平,反映出植物较强的适应恢复能力;旋覆花和千屈菜则在前5天内酶活性受到短暂抑制,此后也可通过提高自身保护酶活性来抵御胁迫危害。按照植物保护酶激活和恢复的变化规律,可以判断4种植物在抵御苯胁迫时酶体系保护能力强弱顺序为红蓼>菊芋>千屈菜>旋覆花。
渗透调节同样是植物提高自身抗逆性的重要途径(赵化银等,2009),本研究中,菊芋、千屈菜和红蓼均可以通过提高体内可溶性蛋白、游离脯氨酸和可溶性糖含量来降低渗透势,防止细胞失水,抵御苯胁迫;而旋覆花则在10 d内表现出渗透条件物质含量下降,合成受到干扰,需适应一段时间后才逐渐恢复渗透调节能力。依据植物体内渗透调节物质含量变化,推测4种植物通过渗透调节来抵御苯胁迫的能力大小为菊芋>红蓼>千屈菜>旋覆花。
植物的Pn和叶绿素含量是反映植物光合作用能力的重要生理指标,容易受到环境胁迫的影响而加速分解(陆长梅等,2001)。周茜茜等(2013)研究证实,苯污染可以使得植物体内叶绿素含量有所下降,陆长根等(2008)、鲁敏等(2016)也报道植物叶绿素含量随着苯浓度的升高而降低。本研究中,苯胁迫条件下 4种植物体内叶绿素含量虽在试验中间阶段有所下降,但30 d后均可以恢复到对照水平,体现出植物对胁迫的适应和光合能力的恢复。同样,Pn也随着时间的延长呈现逐渐恢复的趋势。根据苯胁迫对植物光合作用影响的大小,可以判断植物在苯胁迫下保持和恢复光合作用能力的大小顺序为红蓼>菊芋>旋覆花>千屈菜。
3.2 结论
本研究以菊芋、旋覆花、千屈菜和红蓼4种观花植物为修复材料,对其去除水体中苯的效果及生长状况进行了测定,证明虽然苯胁迫使得植物体生物量的增长有所降低,但4种植物均具有明显的去苯效果,按去除效果大小排序为红蓼>菊芋>旋覆花>千屈菜。
保护酶体系和渗透调节在植物抵御苯的胁迫中均起到积极作用,保证植物可以恢复正常的叶绿素水平、光合能力,防止细胞因膜质过氧化程度加剧而受到伤害。
综上,4种观花植物可以作为植物修复材料净化水体中的苯污染物,且植物能保持良好的生长状况,可以作为含苯污水河的河道绿化植物材料,在现代城市污水综合治理及美化河道景观中具有应用潜力。
参考文献:
CARLETTI R, ROMANO D. 2009. Assessing health risk from benzene pollution in an urban area [J]. Environmental Monitoring and Assessment, 83(6): 776-779.
CHANEY R L. 1983. Plant uptake of inorganic waste constituents [M]//PARR J F, MARSH P B, KIA J M. Land Treatment of Hazardous Wastes. Park Ridge, N J, USA: Noyers Data Corporation, 1983: 50-76.FROOM P. 2008. Proposed method for setting standards for recreational divers diving in benzene polluted waters [J]. Bulletin of Environmental Contamination and Toxicology, 80(3): 251-254.
LIU J N, ZHOU Q X, SUN T S. 2008. Growth responses of three ornamental plants to Cd and Cd-Pb stress and their metal accumulation characteristics [J]. Journal of Hazardous Materials, 151(1): 261-267.
SERGIEV I, ALEXIEVA V, KARANOV E. 1997. Effect of spermine,atrazine and combination between them on some endogenous protective systems and stress markers in plants [J]. Comptes Rendus de l'Academie Bulgare des Sciences, 51: 121-124.
鲍芳, 石福臣. 2007. 互花米草与芦苇耐盐生理特性的比较分析[J]. 植物研究, 27(4): 421-427.
蔡殷楠, 刘泽光. 1979. 依兰香播种育苗研究初报[J]. 云南热作科技,(1): 19-26, 32.
董晓丽, 冯佳, 谢树莲. 2013. 菹草和豆瓣菜去除水体中低浓度苯酚的研究[J]. 科技创新导报, (25): 90-92.
樊兰英, 冯佳, 张猛. 2010. 脆弱刚毛藻对水体中三种苯系物的去除效果[J]. 水土保持通报, 30(3): 73-77.
郝建军, 刘延吉. 2001. 植物生理学实验技术[M]. 沈阳: 辽宁科学技术出版社: 101-102.
胡鹏杰, 李柱. 2014. 我国土壤重金属污染植物吸取修复研究进展[J].植物生理学报, 50(5): 577-584.
来伊楠, 陈波, 卢山. 2015. 天南星科室内观赏植物对苯的净化研究[J].浙江理工大学学报(自然科学版), 33(2): 280-284.
兰国栋, 吕爱华. 2009. 冬季大气中苯系物污染特征及人体暴露水平分析[J]. 环境科学研究, 22(1): 40-46.
鲁敏, 高鹏, 赵洁, 等. 2017. 苯污染胁迫下室内植物POD活性与DMA含量变化分析研究[J]. 山东建筑大学学报, 32(3): 205-211.
鲁敏, 景荣荣, 赵洁, 等. 2016. 苯污染胁迫下室内植物叶绿素含量变化分析研究[J]. 山东建筑大学学报, 31(1): 1-6.
鲁敏, 赵学明, 丁珍, 等. 2016. 9种室内植物对苯污染净化能力的研究[J]. 山东建筑大学学报, 31(6): 527-535.
陆成云, 黎霞, 王代旺, 等. 2015. 花卉修复污染环境的研究现状及发展潜力[J]. 江西农业学报, 27(2): 49-53.
陆长根, 盛宁, 张衡锋. 2008. 4种室内观赏植物对苯气体胁迫的反映[J].安徽农业科学, 36(34): 14869-14870, 14884.
陆长梅, 吴国荣, 周长芳, 等. 2001. 大气污染对悬铃木叶绿素及抗氧化酶系的影响[J]. 城市环境与城市生态, 12(3): 24-26.
路守彦. 2011. 我国苯的生产与市场现状分析[J]. 上海化工, 36(12):32-36.
吕超. 2013. 苯在室内空气中的危害与防治[J]. 科教导报, (3): 155-156.
裴亮宇, 于方磊, 谢树莲. 2013. 苯吸附对三种水生植物叶绿素和抗氧化酶的影响[J]. 中国科技信息, (18): 75-78.
施翔, 陈益泰, 饶龙兵, 等. 2008. 2, 4-二氯酚对杞柳的毒性及在其体内的吸收与讲解[J]. 中国环境科学, 28(10): 921-926.
唐宇力, 钱萍, 张海珍, 等. 2017. 8种观赏水湿生植物对重金属Cd和Pb的吸收固定能力[J]. 环境工程学报, 11(9): 5313-5319.
王彦靖, 解娇, 高海. 2014. 9种室内观赏植物对苯的净化能力[J]. 福建林业科技, 41(1): 60-62.
杨懿. 2009. 装修后室内空气污染的现状及其防治[J]. 绿色大世界, (10):22-23.
尹程, 王荣富, 张云华. 2012. 富营养化污水对美人蕉生理特性的影响[J]. 安徽农业大学学报, 39(6): 989-992.
于方磊, 冯佳, 谢树莲, 等. 2012. 三种水生植物对苯的净化作用及条件优化[J]. 植物研究, 32(5): 609-614.
张宪政. 1992. 作物生理研究法[M]. 北京: 中国农业出版社: 148-149.
张至良. 2003. 植物生理学实验指导[M]. 北京: 高等教育出版社:123-124, 274-277.
赵化银, 蒋小军, 杨远祥, 等. 2009. 铅锌复合胁迫对铅富集植物假繁缕根系活力及碳氮代谢的影响[J]. 陕西农业科学, (5): 58-61.
赵剑英, 孙桂滨. 2009. 有机化学实验[M]. 北京: 化学工业出版社: 119.
周茜茜, 陈成广, 陈碧, 等. 2013. 3种室内观赏植物对苯污染净化能力的研究[J]. 广东农业科学, (16): 143-146.
