猪流行性腹泻病毒与产硫化氢大肠杆菌混合感染的实验室诊断
2018-04-16王云霄徐瑞涛宋勤叶李潭清高玉红
刘 京, 赵 雪, 王云霄, 徐瑞涛, 宋勤叶, 李潭清, 高玉红
(1. 河北农业大学动物医学院 河北省兽用生物制品工程技术研究中心, 河北 保定071000 ;2. 保定市动物疫病预防控制中心, 河北 保定071001 ;3. 河北农业大学动物科技学院, 河北 保定071000)
猪流行性腹泻病毒( PEDV)和大肠杆菌是初生仔猪腹泻死亡的两个重要病原[1]。 PEDV 引起的猪流行性腹泻是一种高度接触传染性肠道传染病,以腹泻、呕吐、脱水为主要临床症状,冬季多发,各种年龄的猪均易感,其中以7 ~10 日龄内的哺乳仔猪受害最为严重。 大肠杆菌可以感染所有生长阶段的猪,但对哺乳仔猪和刚断奶仔猪的危害最为严重。 猪大肠杆菌病主要包括仔猪黄痢、白痢、水肿病和断奶仔猪腹泻等类型,其中仔猪黄痢是导致7 日龄内仔猪死亡的重要原因之一。 2010 年冬季以来,PEDV 变异株在国内外猪场暴发流行,引起仔猪呕吐、腹泻和脱水,7 ~10 日龄内的仔猪发病率90% ~100%,死亡率高达90%以上,给养猪场造成了巨大经济损失[1-2]。 我们实验室对近年临床腹泻病例的病原学检测结果发现,以PEDV和大肠杆菌混合感染非常普遍。 这两种病原的混合感染,导致病情加重,死亡率增高,显著加重了猪场的经济损失。
本文对河北保定某猪场初生仔猪腹泻病例进行了实验室诊断,旨在明确引起该猪场腹泻的病因,为疫病的及时有效防治提供科学依据,同时为仔猪腹泻的病因分析提供参考。
1 材料与方法
1.1 病料来源 2017 年4 月河北保定某猪场,仔猪初生后2 ~3 日龄开始呕吐、拉黄色或水样稀便,病猪被毛粗乱,迅速脱水、衰弱、死亡,发病率80% ~100%,死亡率70% ~90%以上,严重的整窝死亡。 剖检可见,小肠胀满,肠内容物呈黄色水样稀便,肠壁菲薄,肠系膜淋巴结出血、水肿;腹股沟淋巴结出血。 用氟哌酸、链霉素和庆大霉素等抗生素治疗效果不明显。 无菌采取病死猪的肝脏、脾脏、小肠等用于实验室检验。
1.2 实验动物 6 ~8 周龄健康BALB/c 小鼠12只,购自河北医科大学实验动物学部。
1.3 培养基 普通营养琼脂或肉汤、麦康凯、伊红美兰等培养基,购自北京奥博星生物科技有限责任公司;肠杆菌科细菌微量生化鉴定管,抗菌药物敏感性试验用纸片,购自杭州天和微生物试剂有限公司。
1.4 RNA 提取试剂盒与2 ×Taq Master Mix,购自北京康为生物科技有限公司;反转录酶M-MLV,为Promega 公司产品;RNA 酶抑制剂,购自天根生物科技(北京)有限公司;随机引物,由上海生工生物工程技术服务有限公司合成。
1.5 病毒的RT-PCR 检测 根据猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)和猪A 群轮状病毒(RVAV)的已知核酸序列,参考文献[3]合成检测这3 种病毒核酸的特异引物(表1)。 采取病死猪小肠及其内容物剪碎、研磨、冻融后,在4 ℃下以8 000 r/min 离心10 min;取上清液,提取总RNA,反转录为cDNA 后进行PCR 检测。 PCR 反应体系为:cDNA 模板2 μL,2 ×Taq Master Mix 20 μL,上、下游引物各1 μL,无菌三蒸水16 μL;反应程序为:预变性94 ℃3 min,94 ℃45 s,退火55 ℃30 s,延伸72 ℃45 s,共35 个循环;最后72 ℃终延伸10 min。经1.5%琼脂糖凝胶电泳,检测PCR 产物,并对扩增产物进行序列测定与分析。 测序工作由上海生工生物工程技术服务有限公司完成。

表1 PCR 检测病毒核酸用引物
1.6 细菌的分离纯化 取肝脏、脾脏等组织分别划线接种于普通营养琼脂培养基,于37 ℃培养18 ~24 h后,观察菌落的形态特征,挑取单个菌落革兰染色,显微镜检查细菌的染色与形态特征。 挑取单个菌落接种到麦康凯和伊红美蓝琼脂平板鉴别培养基上,进一步培养,观察细菌的培养特性。
1.7 细菌的鉴定
1.7.1 细菌生化特性鉴定 取纯化的菌落接种到肠杆菌科细菌微量生化鉴定管,37 ℃培养24 ~48 h,观察并记录结果。 根据《伯杰氏细菌鉴定手册》对细菌进行鉴定。
1.7.2 16S rRNA 基因序列的PCR 扩增 根据细菌16S rRNA 基因序列设计通用引物16S F∶5′-AGAGTTT GATCCTGGCTCAG-3′,16S R ∶5′-GGTTACCTTGTTACG ACTT-3′。 取纯化的菌液PCR。 PCR 反应体系为:菌液2 μL,2×Taq Master Mix 20 μL,上、下游引物各1 μL,无菌三蒸水16 μL。 反应程序为:预变性94 ℃3 min,94 ℃45 s,退火52 ℃1 min,延伸72 ℃1 min,共35 个循环;最后72 ℃终延伸10 min。 经1%琼脂糖凝胶电泳,检测PCR 产物,并纯化回收目的核苷酸片段,对目的核苷酸进行序列测定与分析。 测序工作由上海生工生物工程技术服务有限公司完成。
1.8 致病性试验 将12 只8 周龄 的BALB/c 小鼠,随机分为感染组(n=8)和对照组(n =4)。 将培养20 h 的纯化菌液经腹腔注射给实验小鼠,每只感染1.06 ×108个菌,对照组以同样途径接种营养肉汤0.2 mL/只。 感染后每隔2 h 观察1 次,记录小鼠发病和死亡情况,并取死亡小鼠的肝、脾和肾等组织进行细菌分离鉴定。
1.9 药敏试验 采用K-B 纸片扩散法进行。 取大肠杆菌的营养肉汤培养物,均匀涂布于营养琼脂板表面,待菌液吸附后,贴上药敏纸片,于37 ℃培养18 h ~24 h,观察结果,测量抑菌圈直径。 按照杭州天和微生物试剂有限公司对药敏试验纸片法的抑菌范围解释标准,判断分离菌对试验用药物的敏感性。
2 结果
2.1 病毒的RT-PCR 结果与序列比对 从病死猪小肠及其内容物中扩增到了预期大小(316 bp)PEDV 核衣壳(N)蛋白基因片段(图1)。 对扩增片段的序列测定结果显示,该核苷酸序列与2010 年以来国内外流行毒株相应核苷酸片段的同源性为99%以上,与之前PEDV 代表株CV777 的同源性为93.67%。 表明此病例中检出的PEDV 为当前流行的PEDV 变异强毒株。 在病料中没有扩增到TGEV和RVA 的核苷酸片段。
2.2 分离菌的培养特性和形态特征 从病死猪的肝脏和脾脏中均分离到了细菌,细菌在普通培养基、血清营养琼脂培养基上生长良好,菌落呈灰白色、圆形、凸起、湿润、边缘整齐;在伊红美蓝琼脂培养基上形成有金属光泽的黑紫色菌落,在麦康凯培养基长成红色菌落(见中插彩版图2A)。 取分离菌涂片、镜检,可见革兰染色阴性、两端钝圆的杆状菌(见中插彩版图2 B)。
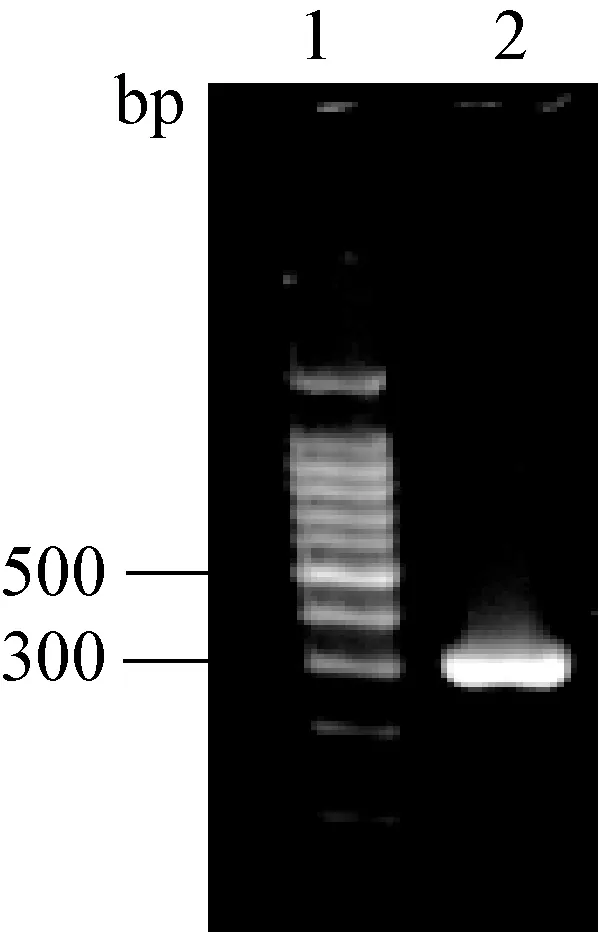
图1 PEDV 核衣壳(N)蛋白基因片段的RT-PCR 产物
2.3 分离菌的生化特性 分离菌株能够发酵葡萄糖、棉子糖、山梨醇,不发酵侧金盏花醇。 靛基质、甲基红试验阳性。 V-P 试验阴性,不利用枸橼酸盐,能利用葡萄糖酸盐。 产生H2S,不分解尿素。 赖氨酸脱羧酶、鸟氨酸脱羧酶阳性,苯丙氨酸脱氢酶阴性(表2)。 根据《伯杰氏细菌鉴定手册》,分离株的上述生化反应结果符合大肠杆菌的生化特性。

表2 分离菌的生化特性
2.4 分离菌16S rRNA 基因序列分析 取纯化的菌液,应用16S rRNA 基因序列特异引物,经PCR 可以扩增到预期大小的核酸产物(图3)。 经过测序与序列比对分析可知,目的核酸序列全长1 502 bp(Gen-Bank 登录号:MG356453),与GenBank 中公布的已知大肠杆菌16S rRNA 基因序列的同源性高达99.9%。 根据细菌16S rRNA 基因序列绘制的系统发育树显示,该大肠杆菌与产肠毒素性大肠杆菌(ETEC,MF919609)处于同一分支(图4)。
2.5 分离菌的致病性 腹腔接种分离菌2 h 后,感染组的小鼠表现精神沉郁、反应迟钝、动作缓慢、皮毛松乱等症状。 感染后5 h 死亡2 只,6 h ~16 h内又陆续死亡5 只,至感染后20 h,最后1 只死亡,死亡率100%(图5)。 取病死小鼠的肝脏、脾脏和肾脏涂片,革兰染色后,显微镜下可见革兰阴性杆菌,并可分离鉴定到大肠杆菌。 试验期间阴性对照小鼠正常。
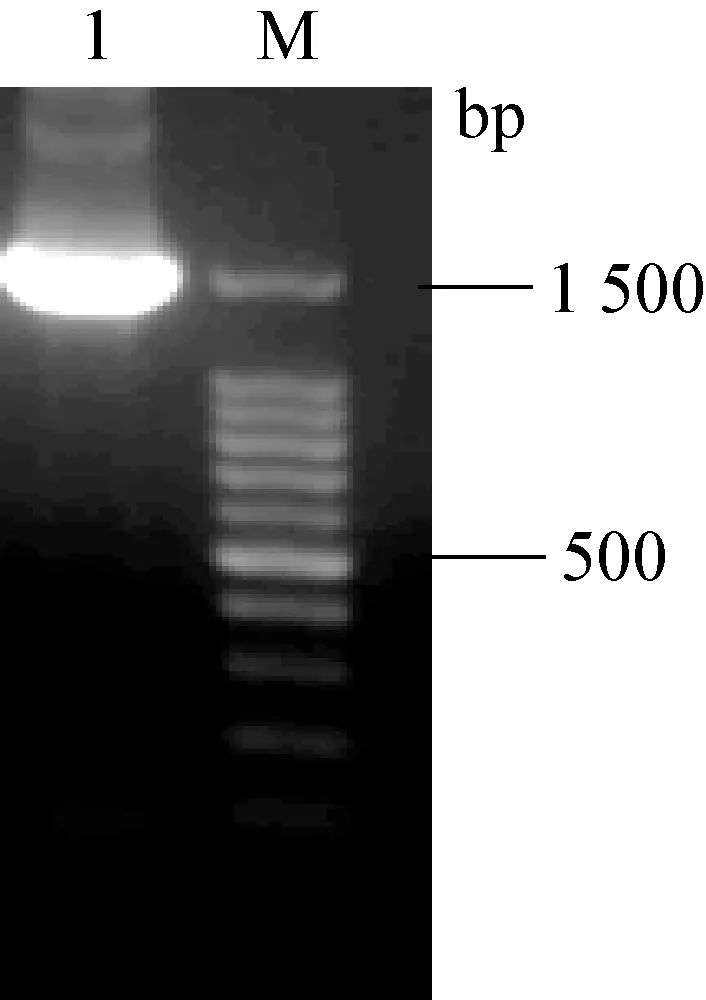
图3 分离菌16S rRNA 基因的PCR 扩增结果
2.6 分离菌的药物敏感性 在测定的15 种药物中,分离菌株仅仅对多黏菌素B 敏感,对头孢噻肟、头孢曲松钠和呋喃妥因中介,对头孢拉定、强力霉素、复方新诺明、呋喃唑酮以及多种氨基糖苷类和喹诺酮类抗菌药物耐药(表3)。

图4 基于细菌16S rRNA 基因的系统发育树
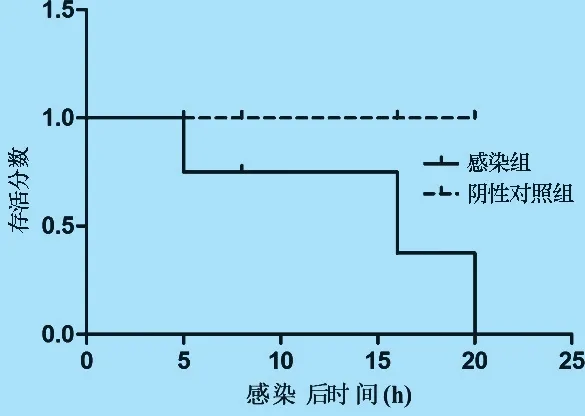
图5 感染分离菌后小鼠的死亡动态
3 讨论
本试验中,首先根据疫情主要危害初生仔猪,发病率和死亡率高,病猪呕吐、腹泻及剖检病变,初步认为该疫情是由传染性因素引起的腹泻,进而从病毒和细菌两方面进行了实验室诊断。 鉴于PEDV、TGEV和RVAV 是引起 仔猪腹泻的常见病毒,本试验首先应用RT-PCR 检测了这3 种病毒,结果从病死猪小肠及其内容物内只检测到了PEDV 核酸,进一步序列分析表明,检测到的核酸序列与当前流行的PEDV 变异株的同源性高达99%以上,而与2010 年之前流行的以CV777 为代表的毒株同源性较低(93.67%)。 该结果说明PEDV 变异株是引起该猪场仔猪腹泻的主要原因。 考虑到大肠杆菌是早期仔猪腹泻的常见致病菌,并且临床上常出现PEDV 与大肠杆菌混合感染的病例[4-7],因此我们对病例进行了细菌学诊断,以便明确该疫情是否为PEDV 与其他细菌混合感染所致。 结果从病死仔猪的肝脏和脾脏中均分离到了细菌,该分离菌的染色、形态特征、培养特性以及生化特性均与常见的大肠杆菌相符。 感染分离菌的小鼠很快出现临床症状,感染后5 h 开始死亡,在20 h 内100%死亡,表明该大肠杆菌具有很强的致病性,其与PEDV 混合感染加剧了病情。 但值得注意的是,大肠杆菌通常不产生H2S,多数文献报道的猪源大肠杆菌通常为H2S 阴性[7-8]。 本研究分离到的大肠杆菌产生H2S,此结果与江智辉等(1988)和张文波等(2013)[9-10]报道的分别从患仔猪白痢粪便和肠胀气母猪肠内分离到H2S 阳性大肠杆菌的结果一致。 此外,已有多篇从腹泻病人粪便中分离到H2S 阳性大肠杆菌的报道,并且发现产H2S 大肠杆菌在医学微生物领域有逐渐增多的趋势[11-12]。 我们此次从发病猪场分离到致病性H2S 阳性大肠杆菌,提示该类菌株很有可能在动物养殖场的流行逐渐增多,需加以关注。
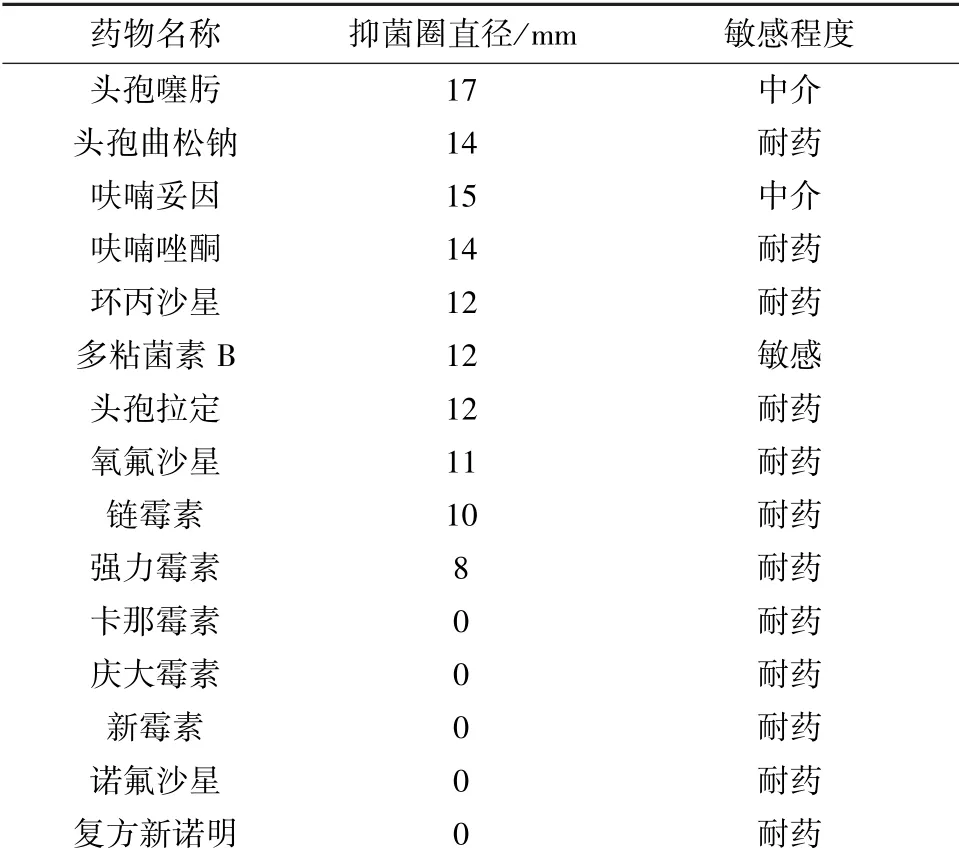
表3 分离菌株的药物敏感性
基于细菌16S rRNA 基因序列的系统发育树分析表明,分离菌与产肠毒素性大肠杆菌的亲缘关系最近,提示分离菌可能为产肠毒素性大肠杆菌,对此需要进一步毒素试验证明。 此外,药物敏感性试验结果显示,该大肠杆菌除了对多黏菌素B 敏感外,对多种头孢菌素、氨基糖苷类药物、喹诺酮类以及强力霉素、复方新诺明等临床常用药物中介或耐药。 此结果提示,当前猪场大肠杆菌的耐药性已相当普遍,应该引起养殖人员、临床兽医和相关部门的高度重视。
