抗猪流行性腹泻病毒卵黄抗体制剂的研究及其临床应用
2018-04-16李桂珍王爱富马春全
李桂珍, 王爱富, 李 舜, 马春全, 付 强
(佛山科学技术学院生命科学与工程学院动物医学系, 广东 佛山528000)
猪流行性腹泻(PED ) 是由猪流行性腹泻病毒(PEDV ) 引起的一种高度接触性急性肠道传染病,其临床主要特征是严重脱水、腹泻、呕吐。 该病容易感染各种年龄猪,且对哺乳仔猪具有高发病率和高致死率,尤其是7 日龄以内的哺育仔猪,感染后死亡率可达100%。 自2010 年以来,PED 在我国多个地区集中暴发流行,目前使用的传统疫苗免疫效果不明显,而市场上尚未出现有效的治疗药物,每年造成仔猪大量死亡,给我国养猪行业带来重大经济损失。
卵黄抗体以其优质高产、安全高效、无毒副作用和生产便利等诸多优点,不仅可以应用于猪病的诊断和防治,还可作为饲料添加剂以提高猪的生产性能,对于增加猪场的效益、促进养猪业健康持久发展具有重大现实意义。 本试验采用喷雾干燥技术和冷冻干燥技术研制卵黄抗体粉和卵黄抗体冻干粉,并利用原核表达的PEDV 重组S 蛋白来建立间接ELISA 检测其抗体效价,应用于动物治疗试验,临床效果良好,为预防和治疗PED 提供了新的解决办法。
1 材料与方法
1.1 病料样品 仔猪小肠采自广东省某一规模化猪场,经RT-PCR 鉴定为PEDV 阳性,-80 ℃保存。
1.2 主要试剂 TRIZol 购自Invitrogen 公司;反转录试剂盒、DNA Marker、Ex Taq DNA 聚合酶、pMD19 -T载体及pET-32a 表达载体,购自宝生物工程(大连)有限公司;胶回收试剂盒,购自Axygen 公司;Trans 5α 感受态细胞、BL21(DE3)感受态细胞及Ni-NTA蛋白纯化柱,购自北京全式金生物技术有限公司;蛋白疫苗由佛山科学技术学院基础兽医研究室制备;50 只初产蛋鸡购自,佛山三水一养鸡场;羊抗猪酶标二抗、兔抗鸡酶标二抗,购自Abcam 公司;TMB显色液,购自天根生化科技(北京)有限公司,其余试剂均为国产分析纯。
1.3 PEDV S1 基因的克隆鉴定
1.3.1 引物设计 参考GenBank 中PEDV S1 基因序列(登录号JN601050.1),利用Primer 5.0 软件设计一对含酶切位点的特异性引物,即S1 - F:5′ -AGGCATTGATAGTGGCG-3′,BamH I;S1 -R:5′ - GGCATTGGCAGCGTAA - 3′,EcoR I;引物由(上海)生工生物工程技术服务有限公司合成,预期扩增产物大小为523 bp。
1.3.2 病毒RNA 的提取及RT -PCR 鉴定 将采集的小肠样品反复研磨匀浆,按TRIZol 试剂使用说明书提取总RNA。 按反转录试剂盒说明书合成cDNA,并以此cDNA 为模板进行PCR 扩增。 扩增体系50 μL: Ex Taq DNA 混合液25 μL,上下游引物(10 μmoL/L)各2.5 μL,cDNA 模板2 μL,dH2O 18 μL。 PCR 反应条件为:95 ℃预变性5 min;94 ℃变性40 s,55 ℃退火35 s,72 ℃延伸1 min,30 个循环;72 ℃再延伸10 min。 扩增产物用1%琼脂糖凝胶电泳鉴定。
1.3.3 S1 基因克隆鉴定 PCR 产物经胶回收后克隆至pMD19 -T 载体中,并转化至DH5α,涂布于氨苄抗性LB 平板上,37 ℃过夜培养,提取阳性菌液质粒pMDTM19T-S1 -523 送往(上海)生工生物工程技术服务有限公司测序。
1.4 PEDV S1 基因表达载体构建及鉴定 将重组质粒pMDTM19T-S1 -523 与pET-32a 空载体利用BamH I 和EcoR I 双酶切并电泳鉴定,目的片段胶回收后16 ℃连接过夜。 连接产物转化至DH5α 感受态细胞,涂布于氨苄抗性LB 平板上,37 ℃过夜培养,提取阳性菌液质粒pET32a -S1 -523 送往上海生工生物工程技术服务有限公司测序。 阳性质粒pET32a-S1 -523 转化至BL21(DE3)感受态细胞,筛选阳性单菌落,扩大培养,-80 ℃保存。
1.5 重组蛋白的诱导表达及纯化 将鉴定正确的重组菌液pET32a-S1 -523 -BL21 于37 ℃、220 r/min扩大培养至OD600值约为0.4,加入终浓度为0.4 mmoL/L IPTG 诱导7 h,12 000 r/min(4 ℃)离心10 min,菌体沉淀超声破碎后,12 000 r/min(4 ℃)离心10 min,留取上清用镍-NTA 蛋白纯化柱纯化,并用SDS-PAGE 鉴定。
1.6 重组蛋白的Western Blot 鉴定 纯化的重组蛋白经SDS-PAGE 电泳后,转印至PVDF 膜上,5%脱脂奶粉室温摇动封闭过夜,加2 000 倍稀释的PEDV 阳性血清室温孵育5 h,加40 000倍稀释的羊抗猪IgG 酶标二抗室温孵育3 h,在ECL 化学发光显色液中避光显色20 min,拍照保存。
1.7 检测卵黄抗体效价间接ELISA 方法的建立 将纯化的重组蛋白稀释成3.2 μg/mL,加入到酶标板中,100 μL/孔,37 ℃孵育2 h 后4 ℃过夜;次日用PBST 洗涤2 次,每次200 μL/孔;加5%脱脂奶粉200 μL/孔,在37 ℃封 闭2 h,用200 μL/孔 的PBST 洗3 次;加卵黄抗体等一抗倍比稀释,37 ℃孵育45 min,用200 μL/孔的PBST 洗3 次;加兔抗鸡IgY 酶标二抗1 ∶5 000 稀释后于37 ℃孵育45 min,之后再用200 μL/孔的PBST 洗5 次;加入TMB 显色液100 μL/孔,于37 ℃避光显色20 min,再加入50 μL/孔的终止液终止反应,立刻用酶标仪测出OD450值。
1.8 卵黄抗体制剂的制备
1.8.1 蛋鸡免疫程序 初产蛋鸡适应性饲养15 d,首次用蛋白疫苗翅下胸肌多点免疫,0.5 mL/只,并于免疫后10、25、55、85 d 加强免疫,1 mL/只。
1.8.2 卵黄抗体粉的研制 将鸡蛋用新洁尔灭水溶液消毒15 min,仔细分离卵黄,卵黄液搅拌混匀,加蒸馏水稀释,加入0.1%葡萄糖、0.03%山梨酸钾和适量鲜牛奶,于140 ℃喷雾干燥处理,卵黄粉存放在阴凉干燥处备用。
1.8.3 卵黄抗体冻干粉的研制 将鸡蛋用新洁尔灭水溶液消毒15 min,仔细分离卵黄,卵黄液搅匀,加蒸馏水1∶7稀释,调节pH 值至5.0 ~5.2,4 ℃静置过夜,加PEG 6000 至终浓度3.5%,混匀静置5 h,加饱和硫酸铵至终浓度40%混匀静置5 h,10 000 r/min(4 ℃)离心10 min,将沉淀冷冻干燥,-20 ℃保存。
1.8.4 卵黄抗体制剂效价检测 用自建的间接ELISA 方法检测卵黄抗体制剂的效价。
1.9 动物治疗试验 应用高效价和高剂量的卵黄抗体制剂对正在发生严重猪流行性腹泻的广东某一规模化猪场和北京某一规模化猪场中患病仔猪进行治疗试验。 患病仔猪以自然出生栏数为单位,随机挑取各试验每栏仔猪数。 卵黄粉抗体组自患病仔猪出生连续3 d 口服进行治疗,共治疗7 栏75 头患病仔猪。 卵黄液抗体组自患病仔猪出生连续3 d 灌服治疗,共计7 栏69 头患病仔猪。 精制卵黄抗体适量稀释后自患病仔猪出生连续3 d 肌肉注射治疗,共计6栏54 头患病仔猪。 所有患病仔猪自治疗试验开始连续7 d 观察仔猪的精神状态、健康程度等,同时记录死亡数和7 日后的健康仔猪数,计算治愈率。
2 结果
2.1 PEDV S1 基因的RT -PCR 鉴定结果 抽提PEDV RNA 反转录合成cDNA,以此cDNA 为模板,利用S1 基因特异性引物扩增出目的条带,大小约523 bp,与预期的目的片段大小一致(图1)。

图1 S1 基因PCR 扩增结果
2.2 重组质粒pET32a -S1 -523 -BL21 双酶切鉴定结果 单酶切结果显示,在5 000 bp 至7 000 bp间有一目的条带,大小约6 413 bp;双酶切结果显示,在5 900 bp 处有一目的条带,与pET32a( +)蛋白表达载体片段大小一致,在513 bp 处有一目的条带,符合预期结果(图2)。
2.3 重组蛋白纯化结果 利用Ni-NTA 柱纯化重组蛋白,经SDS-PAGE 蛋白电泳分析,纯化后的蛋白大小约32.8 kDa,与预期结果一致(图3)。
2.4 重组蛋白Western Blot 鉴定结果 重组蛋白经过Western Blot 鉴定,在PVDF 膜上有一32.8 kDa大小的目的条带,与预期结果相符,说明重组蛋白特异性良好(图4)

图2 重组质粒酶切结果
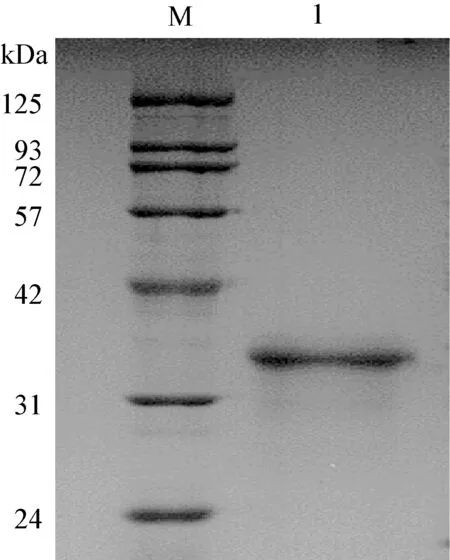
图3 纯化的重组蛋白

图4 重组蛋白的Western Blot 结果
2.5 卵黄抗体制剂效价检测结果 卵黄抗体制剂在第3 次加强免疫后,抗体滴度均维持在较高水平(图5)。
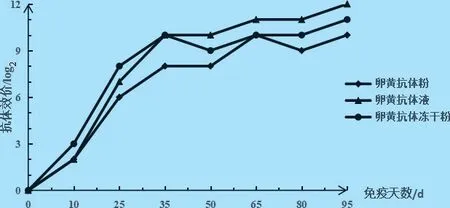
图5 卵黄抗体制剂效价测定结果
2.6 动物治疗试验结果 通过对患病仔猪连续7 d的观察,所有仔猪在出生18 h 后均出现水样腹泻。对照组总计40 头患病仔猪,7 d 时间死亡33 头,仅剩7 头存活,且比较瘦弱。 卵黄抗体粉组经过治疗有56 头恢复健康,治愈率为74.67%。 卵黄抗体液组经过治疗有54 头恢复健康,治愈率为78.26%。卵黄抗体冻干粉组经过治疗有41 头恢复健康,治愈率为75.93%。 说明卵黄抗体制剂的临床应用效果良好(表1)。
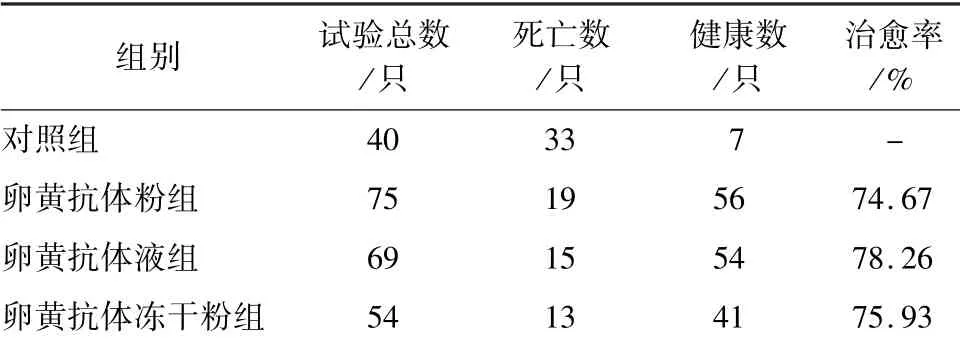
表1 3 种卵黄抗体制剂治疗PED 的治愈率
3 讨论
1971 年在英国首次报道了PED 的流行,其临床症状与猪传染性胃肠炎相似,此后PED 在欧洲暴发[1-2]。 美国在2013 年5 月暴发PED,并迅速侵染全国乃至相邻的墨西哥和加拿大,造成一年近千万头仔猪死亡,经济损失巨大[3-4]。 与我国相邻的韩国、日本等也曾报道过PED 的流行情况[5]。 1984年,宣华等研究证实我国猪群中存在PED,之后一直呈散发状态,未出现大范围流行。 然而2010 年以来,PEDV 在我国多个省份暴发流行[6]。 黄冬妮等通过对8 株PEDV 的ORF3 和M 基因序列比对及遗传分析,结果显示,OPF3 基因和M 基因与经典毒株CV777 的亲缘关系较远,说明广东省流行的毒株以变异的新毒株为主[8]。 罗六龙等将12 个样本的PEDV S1 基因序列与经典毒株CV777 序列对比发现,仅有一个样本氨基酸同源性为100%,证实了近年来广东省流行毒株以变异株为主[8]。 李井春等将分离的PEDV 辽宁株测序分析后,发现该毒株与2013 年美国暴发毒株以及我国2010 年毒株核苷酸和氨基酸同源性较高,而与疫苗株同源性较低,表明辽宁地区PEDV 出现变异[9]。 专家学者们普遍认为PEDV 在我国出现了新的变种,导致现有疫苗免疫无效,每年造成大量哺乳仔猪死亡,给我国养猪业带来巨大经济损失。
PEDV S 蛋白上的抗原决定簇能诱导机体产生良好的免疫反应,其697aa ~742aa 的中和表位免疫原性最强。 本研究选取S1 基因包含了697aa ~742aa 的中和表位,这使得PEDV S 蛋白在调节病毒与特定宿主细胞受体糖蛋白间发挥重要作用,并可介导病毒进入自然宿主细胞,刺激机体产生中和抗体[10-11]。 另外,S 蛋白的同源性非常低,在血清学上不存在交叉反应[12]。 因此PEDV S 蛋白是研制PEDV 蛋白疫苗的首选。 卵黄抗体IgY 稳定性强、耐酸性、耐高温,本试验采用喷雾干燥技术和冷冻干燥技术将卵黄抗体制成卵黄抗体粉和卵黄抗体冻干粉,相比之前液态的卵黄抗体,所占空间小,更易储存和运输。
针对卵黄抗体的临床应用效果,秦文等研制的抗PEDV、TGEV、RV 高免卵黄液治疗以猪流行性腹泻为主的病毒性腹泻,其治愈率高达90.48% ~100%,应用效果显著[13]。 崔焕忠等利用纯化后的抗TGEV 与PEDV 卵黄抗体治疗患病仔猪,其人工感染治愈率高达100%,临床应用治愈率为88%,治疗效果显著[14]。本试验采用高剂量高效价卵黄抗体制剂对患病仔猪进行治疗试验。 结果显示,卵黄抗体粉组的治愈率为74.67%,卵黄抗体液组的治愈率为78.26%,卵黄抗体冻干粉组的治愈率为75.93%。 说明卵黄抗体对猪流行性腹泻仔猪具有一定的治疗作用,但临床应用结果与前人研究存在一定差距,原因可能与本研究试验猪场存在其他传染性疾病病原有关。 本研究采用PEDV 流行毒株S1 蛋白作为免疫原免疫蛋鸡制成3种卵黄抗体制剂,并将高剂量高效价的制剂初步应用于动物治疗试验,证实卵黄抗体制剂具有一定的临床效果。 未来我们还需要进一步研究,以期为防控PED提供简便高效的解决方法。
