复合微生物制剂对猪生产性能、免疫功能和肉质影响
2018-04-14石宝明孟祥宇蔡建成白广栋单安山申汉彬蒋宗勇
石宝明,孟祥宇,蔡建成,滕 腾,白广栋,单安山,申汉彬,王 丽,蒋宗勇
(1.东北农业大学动物营养研究所,哈尔滨 150030;2.黑龙江省兰西县种猪场,黑龙江 兰西 151500;3.广东省农业科学院动物科学研究所,广州 510640)
抗生素作为饲料添加剂在养殖业中存在药物残留、耐药性等问题。抗生素滥用,导致畜禽对病原体产生耐药性,严重影响畜产品质量安全,多国已明令禁止抗生素作为饲料添加剂使用。饲料中添加益生菌替代抗生素可增强畜禽免疫能力,为生产安全、优质畜产品开辟新途径。
动物酵素营养液以新鲜蔬菜、水果为原料,经多种益生菌发酵而成,是富含酶、维生素、矿物质和次生代谢产物复合微生物制剂,由乳酸菌、酵母菌、枯草芽孢杆菌等有益微生物组成,目前动物酵素营养液生猪应用研究样本较少,张艳梅等发现仔猪阶段添加0.5%动物酵素营养液可有效防治呼吸道疾病[1]。王景芳等研究表明,母猪饲料中添加复合微生物制剂可以提高受孕率和仔猪成活率,在小梅山猪二元杂交仔猪保育期饲喂复合微生物制剂可以提高仔猪成活率,减少疾病发生[2]。目前尚无复合微生物制剂对猪饲料中抗生素替代作用全程观察试验。本试验以27日龄二元杂交猪为试验动物,添加复合微生物制剂饲至出栏,记录生产性能、测定相关指标,研究动物酵素营养液替代抗生素对猪生产性能、免疫功能、肉质影响及复合微生物制剂效用,为其替代抗生素奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 供试制剂
动物酵素营养液(主要成分为枯草芽孢杆菌4×108cfu·mL-1、酿酒酵母菌4×108cfu·mL-1),黑龙江省京福龙农牧科技开发有限公司提供。
1.1.2 供试动物
27日龄断奶仔猪(长白×大白)72头,由黑龙江省兰西县种猪场提供。
1.1.3 供试饲粮
试验饲粮配方见表1,由兰西种猪场配制提供。

表1 猪基础日粮配方及营养水平Table 1 Composition and nutrient levelsof basal diets
1.2 试验方法
1.2.1 试验设计
选取健康且体重相近27日龄断奶仔猪(长白×大白)72头,按体重与性别随机分为3组,每组4个重复,每个重复6头猪,各组公母比例一致。空白对照组饲喂无抗基础饲粮,抗生素组在基础饲粮中添加复合抗生素(仔猪料:硫酸粘杆菌素20 mg·kg-1,吉他霉素40 mg·kg-1,喹乙醇75 mg·kg-1;肥猪料:吉他霉素20 mg·kg-1),复合微生物制剂组在基础饲粮中添加0.5%动物酵素营养液。
1.2.2 饲养管理
试验动物饲养于同一封闭猪舍。自由饮水,饲喂粉料,每日饲喂4次,迅速投放饲料以减少应激。按猪场免疫程序接种各种疫苗,保持舍内清洁卫生,加强仔猪保温措施。
1.2.3 生产性能指标
试验开始时以栏为单位,每日称重饲料,记录采食量。每日清晨观察并记录腹泻情况。试验第1、55天及试验结束时称重并统计相关数据。
1.2.3.1 平均日采食量
记录每栏猪总采食量,平均日采食量(ADFI)=(投料总数-所剩饲料)/试验天数。
1.2.3.2 平均日增重
分别于各阶段开始与结束时称取每栏猪重量。平均日增重(ADG)=(试验末期平均体重-试验初期平均体重)/试验天数。
1.2.3.3 料肉比
料肉比(F/G)=平均日采食量(ADFI)/平均日增重(ADG)。
1.2.3.4 腹泻率
试验期间每日记录腹泻仔猪头数与日期。腹泻率=腹泻总天数/(饲养天数×头数)×100%
1.2.4 血液采集与分析
分别于55日龄和试验结束时清晨饲喂前每个重复取1头猪前腔静脉采血5 mL,3 000 r·min-1离心,分离血清,分装于1.5 mL EP管中,-20℃冰箱待测。
采用Unicel DxC 800全自动生化分析仪(Beck⁃man Coulter,USA)测定血浆中总蛋白TP、白蛋白(ALB)、球蛋白(GLB)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、r-谷氨酰转肽酶(GGT)、碱性磷酸酶(AKP)、乳酸脱氢酶(LDH)、尿素氮(BUN)、肌酐(CREA)。
1.2.5 肠黏膜免疫因子采集与测定
屠宰后取空肠,生理盐水冲洗肠道内容物后,刮取空肠粘膜,分装于1.5 mL冻存管中,-80℃冰箱保存待测。采用ELISA酶联免疫法测定,试剂盒购自上海劲马公司。使用352型酶标仪(Labsystems Multiskan MS,Finland),具体操作按照猪酶联免疫检测试剂盒说明书测定。
1.2.6 肉质指标检测
出栏后,每栏取1头猪屠宰,取背腰最长肌检测肉质指标。分别测定胴体重,肉色,pH,剪切力以及滴水损失。肉色利用NR10QC色差仪测定,pH利用哈纳HI8424测试仪测定。
1.3 数据处理
试验数据利用Microsoft Excel整理并初步计算,SPSS20.0统计软件对试验数据作单因素方差分析(One-Way ANOVA),Tukey法多重比较,各组以平均值±标准误(Mean±SEM)表示。P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 复合微生物制剂对猪生产性能的影响
由表2可知,仔猪阶段(27~55日龄),各组仔猪平均日增重、平均日采食量以及料肉比差异不显著(P>0.05),复合微生物制剂组腹泻率极显著低于空白对照组和抗生素组(P<0.01),55日龄3组平均重差异不显著。肥猪阶段(56日龄至出栏),抗生素组猪平均日增重显著高于空白对照组(P<0.05)。复合微生物制剂组与其他两组差异不显著。抗生素组平均日采食量极显著高于复合微生物制剂组和空白对照组(P<0.01)。试验结束时抗生素组和复合微生物制剂组平均体重显著高于空白对照组(P<0.05)。3组料肉比差异不显著(P>0.05)。全阶段(27日龄至出栏),抗生素组平均日增重显著高于空白对照组(P<0.05),复合微生物制剂组与其他两组差异不显著。抗生素组平均日采食量极显著高于复合微生物制剂组和空白对照组(P<0.01)。复合微生物制剂组和抗生素组平均重显著高于空白对照组(P<0.05),两组之内差异不显著(P>0.05)。3组全程料肉比差异不显著(P>0.05)。

表2 微生物制剂对猪生产性能影响Table 2 Effect of compound probiotics on the growth performance of pigs
2.2 复合微生物制剂对猪血液生化指标影响
由表3可知,仔猪阶段复合微生物制剂组血液中碱性磷酸酶含量显著高于抗生素组(P<0.05),其他组血液生化指标各组间差异均不显著(P>0.05)。育肥猪阶段,3组血液生化指标差异不显著(P>0.05)。
2.3 复合微生物制剂对仔猪肠道免疫因子影响
由表4可知,复合微生物制剂组空肠黏膜中SIgA含量极显著高于抗生素组(P<0.01),与空白对照组之间差异不显著(P>0.05)。复合微生物制剂组空肠黏膜中IgG含量极显著高于抗生素组和空白对照组(P<0.01)。复合微生物制剂组空肠黏膜中IL-1含量极显著高于空白对照组(P<0.01)。
2.4 复合微生物制剂对育肥猪肉品质影响
由表5可知,复合微生物制剂组和抗生素组的胴体重显著高于空白对照组(P<0.05),两组差异不显著。3组肉质品质指标差异均不显著(P>0.05)。
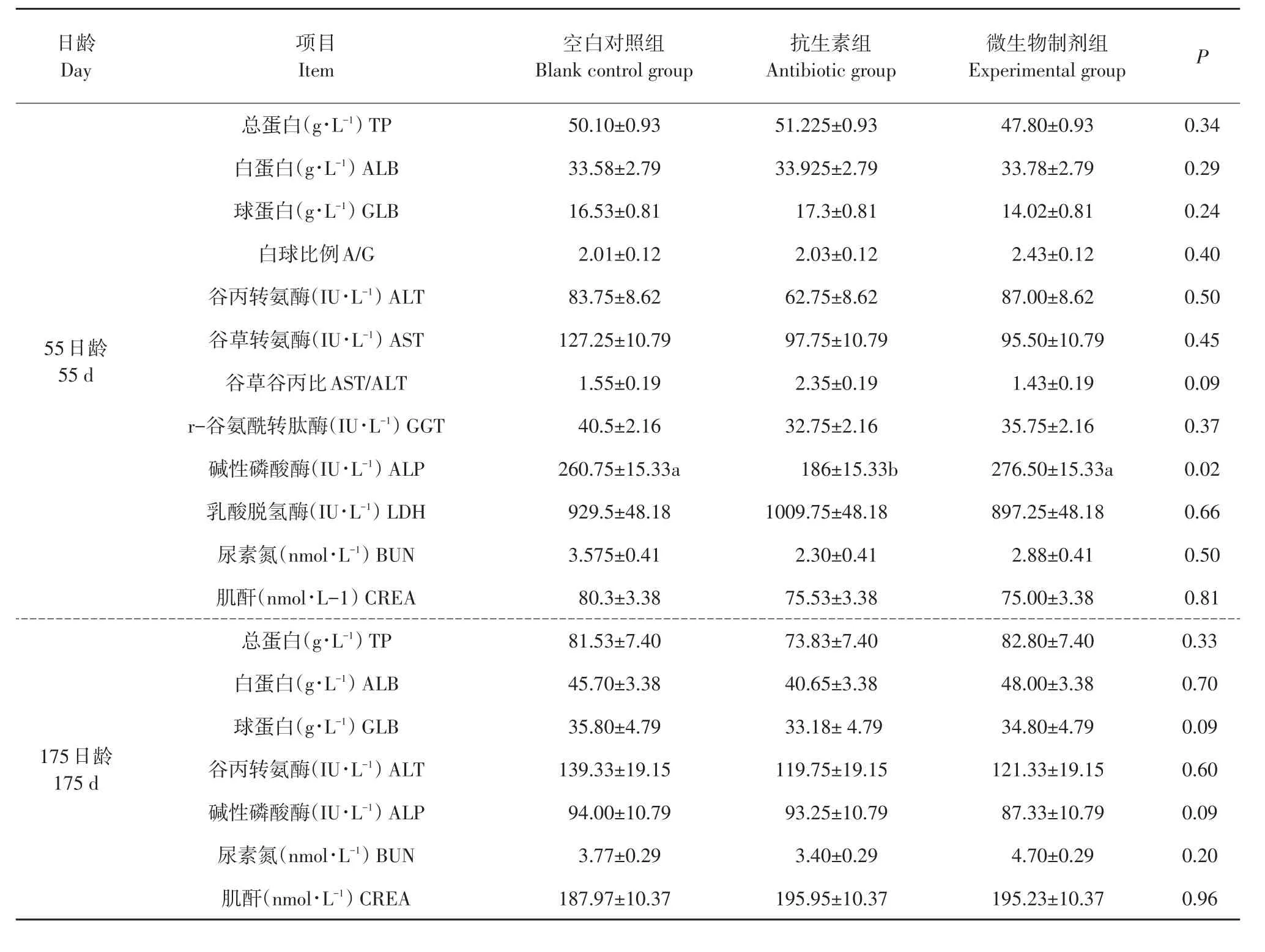
表3 微生物制剂对猪血液生化指标影响Table 3 Effects of compound probiotics on serum biochemical indexes of pigs

表4 复合微生物制剂对猪肠道免疫因子影响Table 4 Effect of compound probiotics on the Intestinal immune factorsof pigs (μg·mL-1)
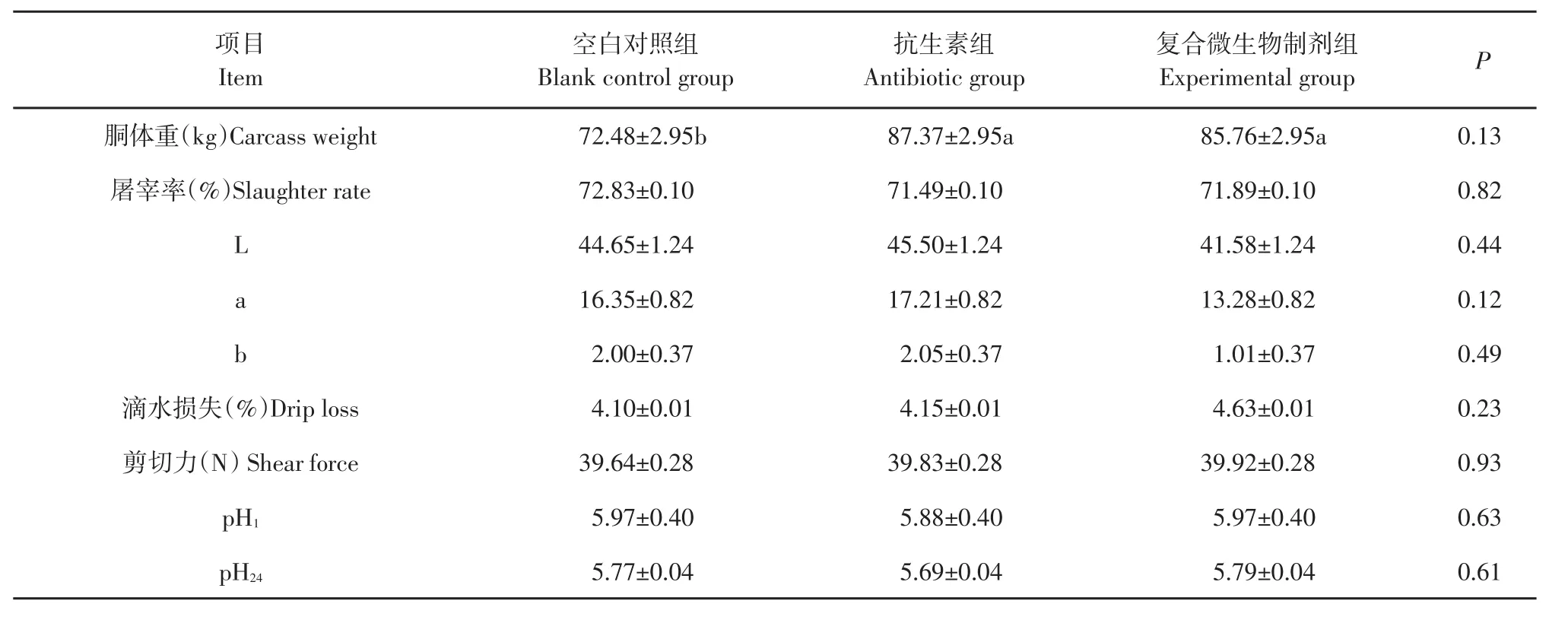
表5 复合微生物制剂对育肥猪肉品质影响Table 5 Effect of compound probiotics on the meat quality of pigs
3 讨论与结论
3.1 复合微生物制剂对猪生产性能影响
本研究发现,仔猪阶段添加复合微生物制剂可显著降低仔猪腹泻率,对其他生产性能影响不显著。肥猪阶段,与空白对照组相比平均日增重和平均日采食量均显著提高。周盟等研究发现,仔猪饲粮中添加复合菌制剂(植物乳杆菌、枯草芽孢杆菌及其复合菌)可显著降低仔猪腹泻率[3];王华等研究发现,在仔猪饲粮中添加乳菌宝益生菌制剂(乳酸菌、酵母菌)可降低仔猪腹泻指数[4]。本研究表明,仔猪阶段添加复合微生物制剂显著降低仔猪腹泻率,与上述研究结果一致,由于断奶后仔猪处于生长发育敏感时期,消化系统免疫系统等尚未发育完全,微生物易在仔猪胃肠道内定植,增强仔猪肠道功能,减少仔猪腹泻率。但生产性能,各时期料重比与平均日增重并未优于抗生素组,刘虎传等研究表明仔猪饲料中添加复合益生菌粉,可显著提高断奶仔猪平均日增重,降低料肉比[5]。刘金阳等研究表明,饲料中添加粪肠球菌和枯草芽孢杆菌可显著提高苏淮猪料重比[6],可能是复合微生物制剂改变饲料适口性,进而影响生产性能。
3.2 复合微生物制剂对猪血液生化影响
血液生化指标表征机体营养代谢情况。碱性磷酸酶为反映成骨细胞活性、骨生成状况和钙、磷代谢重要生化指标。年幼动物血液碱性磷酸酶主要来自骨骼,随动物成熟和骨骼成年化,骨骼碱性磷酸酶逐渐减少[7]。本试验仔猪阶段血液生化中添加复合微生物制剂组血液中碱性磷酸酶含量显著提升,反映该阶段仔猪骨骼细胞活性较高,骨骼发育旺盛。但目前尚无研究表明饲料中添加益生菌可促进动物机体骨骼发育,复合微生物制剂添加对仔猪骨骼发育影响机理有待研究。
3.3 复合微生物制剂对猪免疫能力影响
本试验中,添加复合微生物制剂组中肠道黏膜分泌型免疫球蛋含量均显著提高。SIgA为外分泌液中重要抗体,主要由肠道黏膜固有层中IgA浆细胞分泌,参与粘膜局部免疫,与相应病原微生物结合,组织病原体粘附到细胞表面,在局部抗感染中发挥重要作用[8-9]。胡兴义等研究发现,仔猪饲粮中添加干酪乳酸菌、酿酒酵母菌和枯草芽孢杆菌组成复合益生菌制剂可显著增加仔猪空肠黏膜SIgA含量[10]。李云峰等研究发现,枯草芽孢杆菌可显著提高仔猪肠道黏膜SIgA含量[11]。本试验中,复合微生物制剂组肠粘膜中SIgA和IgG显著高于抗生素组,与以上研究结果一致,表明添加复合微生物可提高仔猪免疫能力。
IL-1是一种细胞因子,属于白细胞介素,由活化巨噬细胞产生,刺激参与免疫反应细胞增殖、分化并提高其功能,在调节肠道炎症时发挥重要作用[12-14]。李云峰等研究发现,枯草芽孢杆菌添加可显著促进肠道中细胞因子IL-1表达[11]。蒋宗勇等研究发现不同酵母可提高仔猪血清中细胞因子水平[15]。本试验中,复合微生物制剂添加显著提高肠黏膜IL-1含量,与以上研究结果一致,表明复合益生菌制剂可刺激细胞因子分泌。
综上所述,复合微生物制剂可提高仔猪免疫能力,降低仔猪腹泻率,提高猪胴体重,可一定程度上替代抗生素。
[参考文献]
[1] 张艳梅,刘丽华,王景芳,等.动物酵素营养液对保育猪呼吸道疾病影响的研究[J].现代畜牧科技,2015(2):30.
[2] 王景芳,薛贵彬,宋雪莹,等.“京福龙动物酵素营养液”(生猪专用)在生猪生产中的应用[J].养殖技术顾问,2013(2):4-5.
[3] 周盟,张乃锋,董晓丽,等.益生菌对断奶仔猪生长性能、免疫器官指数及胃肠道pH的影响[J].动物营养学报,2014,26(2):445-452.
[4] 王华,张淑梅,钟颖婷,等.“乳菌宝”益生菌剂对断奶仔猪肠道生理生化指标的影响[J].东北农业大学学报,2013,44(12):27-31.
[5] 刘虎传,张敏红,冯京海,等.益生菌制剂对早期断奶仔猪生长性能和免疫指标的影响[J].动物营养学报,2012,24(6):1124-1131.
[6] 刘金阳.饲粮中添加益生菌对苏淮猪生长性能、胃肠道pH和肉品质的影响[D].合肥:安徽农业大学,2014.
[7] 王秋颖.碱性磷酸酶特性及其应用研究进展[J].中国畜牧兽医,2011,38(1):157-161.
[8] 王友湘,陈庆森.益生菌和肠道黏膜免疫关系的研究进展[J].食品科学,2007,28(8):537-542.
[9] 车传燕,杨倩.断奶仔猪胃肠道中IgA和IgG分泌细胞的分布[J].畜牧兽医学报,2010,41(5):615-620.
[10] 胡兴义,张双翔,冯旭芳,等.复合益生菌制剂对哺乳仔猪生长性能和免疫水平的影响研究[J].家畜生态学报,2017,38(8):24-28.
[11] 李云锋,邓军,张锦华,等.枯草芽孢杆菌对仔猪小肠局部天然免疫及TLR表达的影响[J].畜牧兽医学报,2011,42(4):562-566.
[12] Scharek L,Guth J,Retter K,et al.Influence of a probiotic Entero⁃coccusfaecium strain on developmentof theimmunesystemof sows and piglets[J].Veterinary Immunology and Immunopathology,2005,105(1-2):151-161.
[13] 刘立峰,刘玉和,沈维高,等.白细胞介素-1的结构、来源、分布、功能及其与疾病的关系[J].北华大学学报(自然科学版),2006,7(5):416-423.
[14] 董强刚.白细胞介素1的研究[J].生理科学进展,1987(3):203-208.
[15] 蒋宗勇.不同形态酵母对早期断奶仔猪免疫功能的影响[C].北京:中国畜牧兽医学会动物营养学分会学术研讨会,2008.
