枯草芽孢杆菌β-BS01诱变株对东北温室常见真菌病害的抑制
2018-04-13王相玉胡贸英吴云飞任国莉
王相玉,胡贸英,吴云飞,李 岚,任国莉*
枯草芽孢杆菌β-BS01诱变株对东北温室常见真菌病害的抑制
王相玉1,胡贸英2,吴云飞2,李 岚1,任国莉2*
(1. 佳木斯大学 理学院,黑龙江 佳木斯 154007;2. 佳木斯大学 农业与环境生物技术研究所,黑龙江 佳木斯 154007)
利用效价测定法通过枯草芽孢杆菌β-BS01诱变和筛选实验,探究枯草芽孢杆菌β-BS01及其诱变株对东北温室常见真菌病害的抑制效果。采用培养基优化和紫外线诱变两种方法对枯草芽孢杆菌β-BS01进行突变,运用随机筛选法挑选出对东北温室常见真菌病原菌抑制性增强的突变株并传代10次验证突变株的遗传稳定。获得了1株抑制东北温室常见真菌病害能力增强的枯草芽孢杆菌突变株UBS-A29,其效价提高到34 AU/mL,提升了约1.7倍。经过处理后的枯草芽孢杆菌进一步加强了对真菌病害的抑制能力,具有控制和削弱温室真菌病害的应用潜力。
枯草芽孢杆菌;抑制作用;东北温室;紫外线诱变;效价
枯草芽孢杆菌是我国建议推广使用的微生物生防菌[1],因其无毒无害,可分泌多种酶类,并具有强抗逆性、优良的抑菌效果,在植物生防方面被认为是较理想的生物防治菌株[2],常被用于促进植物生长和预防植物病害[3]。然而,从自然界中筛选纯化的菌种通常抑菌效果和遗传性状稳定较差,单独依赖微生物群体的自然突变来选育特异性菌株难以满足研究和生产需要[4],因此本实验通过改变培养基成分及紫外诱变的方法筛选高效菌株[5],采用诱变育种不仅可以增强芽孢杆菌对东北温室常见真菌病害的抑制能力,而且还可以改进菌种质量,优化生产工艺,开发新品种[6]。为了进一步控制和削弱东北温室常见的真菌病害,本试验通过以枯草芽孢杆菌β-BS01为原始菌株,进行紫外诱变,测定突变株对指示菌效价的改变,最终获得一株高效抑制东北温室常见真菌病害的生防菌株,旨在为后续工厂化应用提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 供试菌株 实验菌株为枯草芽孢杆菌β-BS01();指示菌为番茄晚疫病(黄瓜枯萎病(sp.Owen)、辣椒炭疽病()、辣椒晚疫病()、茄褐纹拟茎点霉((Sacc. Et Syd.)Harter.)均由吉林农业大学农学院植物病理研究所惠赠。
1.1.2 培养基的配方 活化培养基配方采用BPY培养基[7]:牛肉膏4.6 g/L,酵母膏4.4 g/L,蛋白胨9.6 g/L,葡萄糖4.5 g/L,NaCl 4.5 g/L,琼脂18.0 g/L,pH调至7.2;菌种优化培养基:牛肉膏4.5 g/L,蛋白胨9.5 g/L,NaCl 4.5 g/L,KH2PO41.0 g/L,MnSO4·H2O 0.4 g/L,琼脂17.5 g/L,pH调至7.0;细菌蛋白胨液体诱变培养基(LBS):牛肉膏2.9 g/L,NaCl 0.9 g/L,蛋白胨5.2 g/L,pH调至7.0;细菌蛋白胨培养基(LB):牛肉膏2.9 g/L,NaCl 0.9 g/L,蛋白胨5.2 g/L,琼脂18.5 g/L,pH调至7.0;马铃薯葡萄糖琼脂培养基(PDA):去皮马铃薯200.0 g/L,葡萄糖19.2 g/L,琼脂19.0 g/L,pH自然。
1.1.3 主要试剂 醋酸缓冲液、磷酸缓冲液、0.80%生理盐水和吐温-80溶液(121 ℃灭菌20min)。
1.2 方 法
1.2.1 抑菌谱的测定 以实验室保藏的5种植物病原真菌为指示菌,采用杯碟法测定枯草芽孢杆菌β-BS01发酵上清液对真菌病原菌的抑菌效果。
1.2.2 生长曲线的测定 将4 ℃保存的枯草芽孢菌株β-BS01通过BPY培养基活化,活化后的菌株用接菌环接种于LBS培养基中,于32 ℃下160 r/min恒温培养24~48 h,以体积分数为2%的接种量移取至250 mL液体培养基中。取样间隔2 h,经3倍稀释后,以蒸馏水做对照在波长600 nm下使用紫外分光光度计测OD值,横坐标时间,纵坐标OD值作图,即为枯草芽孢杆菌β-BS01的生长曲线。
1.2.3 枯草芽孢杆菌上清液的处理及病原体孢子悬液的制备 (1)上清液的处理:取10.0 mL培养48 h的枯草芽孢杆菌发酵液加入无菌离心管,12 000 r/min离心12 min,用无菌注射器抽取上清液,0.22 µm无菌滤膜重复过滤3次。
(2)病原菌孢子悬液的制备:病原菌接种于PDA平板上,28 ℃培养。当病原真菌孢子形成时,无菌水冲洗,无菌脱脂棉过滤,得到病原菌孢子悬液。血球计数板观察孢子数,将其浓度稀释到1×104cuf/mL移至无菌瓶中,封口备用。
1.2.4 上清液效价的确定及标准曲线的建立 (1)抗菌物质效价的确定。以pH为6.5的NaH2PO4-Na2HPO4缓冲液对发酵上清液进行倍数稀释,即取样200 μL进行1、1/2、1/3、1/4、1/5梯度抑菌实验,将观察不到抑菌圈出现的最低稀释浓度定义为1个活力单位(1AU),其倒数即原液的抗菌肽效价(AU/mL)。
(2)效价标准曲线的制作。将已知效价发酵液等比稀释成9种浓度:1×10-1、2×10-1、3×10-1、4×10-1、5×10-1、6×10-1、7×10-1、8×10-1、9×10-1和1.0。分别取200 μL加入间隔的6个牛津杯于已制备好的平板A1~A10中。同时另取比例为5×10-1浓度的200 μL加入另外间隔的6个牛津杯于平板B1、B2、B3为对照试验,每个浓度均重复3个平板。横坐标为抑菌圈直径的差值,纵坐标为对应的效价对数,绘制效价曲线。
1.2.5 菌株的紫外线诱变选育 (1)诱变菌悬液的制备:将活化好的菌株β-BS01以2%接种量接入牛肉膏诱变培养基中,培养至指数生长期,取10.0 mL培养液,5 500 r/min离心15 min,弃去上清液,采集菌体,用0.80%生理盐水反复冲洗沉淀后离心,重复3次,将得到的菌悬液加入0.05 mL吐温-80,然后充分振荡混匀即为108个/mL细胞浓度的细胞悬液。
(2)紫外线(UV)诱变处理:开启紫外灯预热20 min,提取已制备的菌悬液10 mL于平板中,置于暗室36 W紫外灯下30 cm处,打开上盖分别照射20、30、45、60、75和120 s,分别进行适当稀释后用涂布器均匀涂布在LB培养基平板上,另做未经紫外照射的菌悬液涂布平板每个实验重复3个平板,于32 ℃遮光条件下培养48~72 h,观察每个平板中菌落数并记录,所有数据均用SPSS16.30处理,做出枯草芽孢菌株β-BS01致死率曲线。
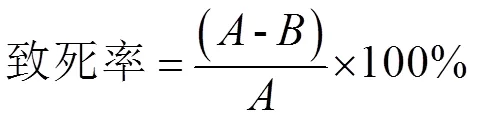
式中:为对照每平板活菌数;为处理后每平板活菌数。
(3)致死率时间选择:选择死亡率在80%~90%下生长出的完整菌落,经无菌水稀释至适当浓度,涂布在平板上,30 ℃培养24 h,从培养基上随机挑选单菌落160 r/min下发酵初筛即挑选出长势较好抑制性较强的菌株30株转接至斜面培养基,以出发菌株为对照,再次进行摇瓶复筛,重复3次,最终计算其效价。
1.2.6 高产菌株传代稳定性试验 为研究诱变的高效抑制东北温室常见真菌病原的菌株遗传特性是否稳定,将经紫外诱变得到的菌株按平板接种的方法,传代10次,将每代得到的性状优良菌株进行液体培养,测定其抑菌圈的直径,计算效价,检测突变菌性能稳定性。
2 结果与分析
2.1 枯草芽孢杆菌β-BS01抑菌谱的测定
枯草芽孢杆菌β-BS01发酵上清液对5种植物病原真菌均具有抑制作用,其中对番茄晚疫病抑制作用最好,抑制圈直径达到了(24.92±0.60) mm(图1)。
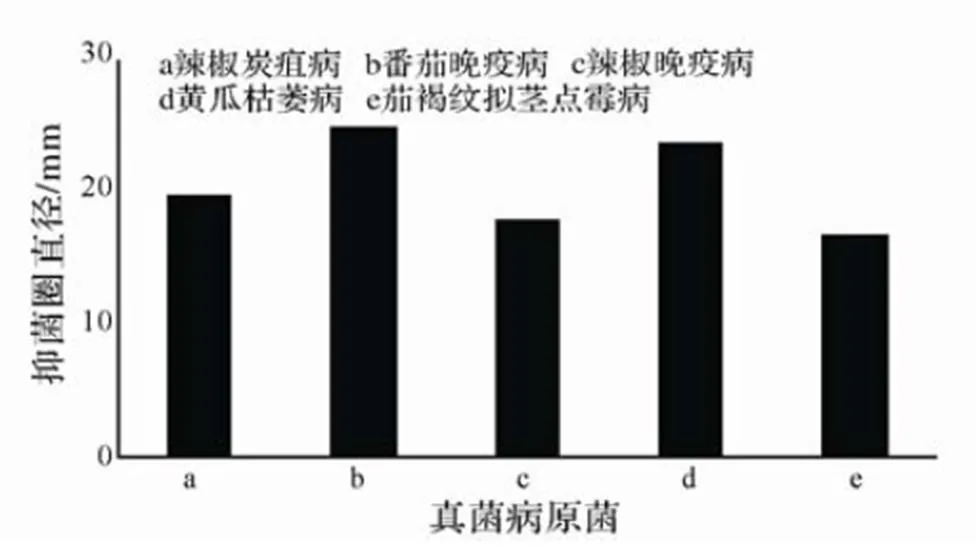
图1 枯草芽孢杆菌β-BS01对部分植物病原真菌抑菌效果
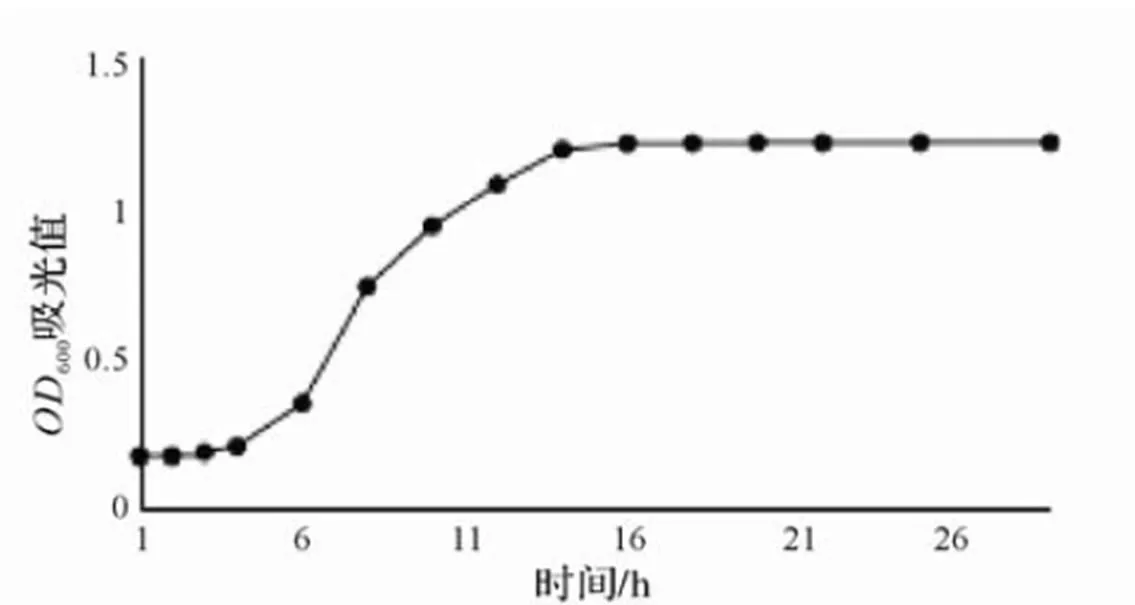
图2 枯草芽孢杆菌β-BS01的生长曲线
2.2 生长曲线的绘制
对枯草芽孢杆菌β-BS01的生长曲线进行了测定,从曲线可以看出在培养4~10 h,细胞快速生长,进入对数生长期,而14 h后菌体吸光度不变即菌体生长速率减缓。因此,要采取培养10~14 h的枯草芽孢杆菌β-BS01进行诱变实验(图2)。
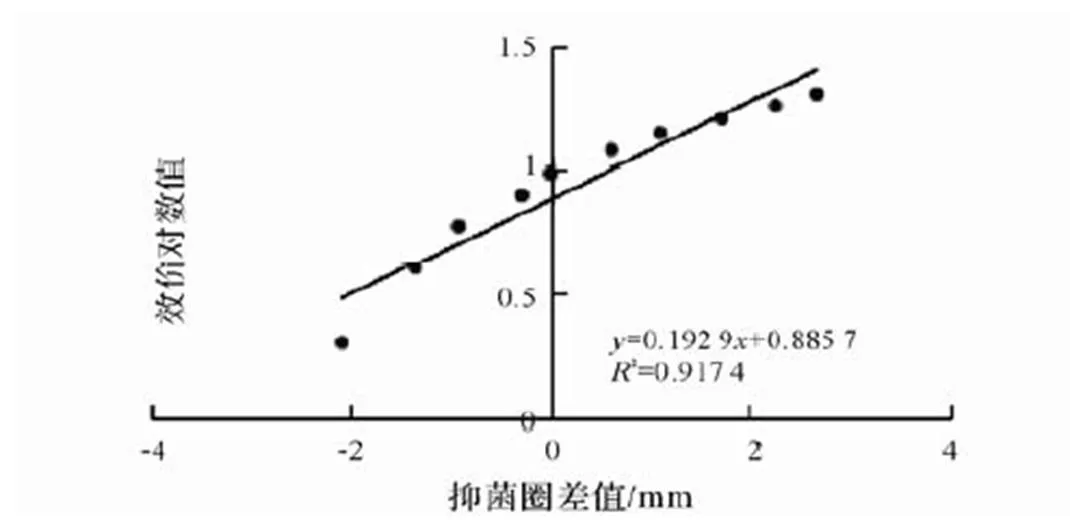
图3 抑菌物质标准曲线
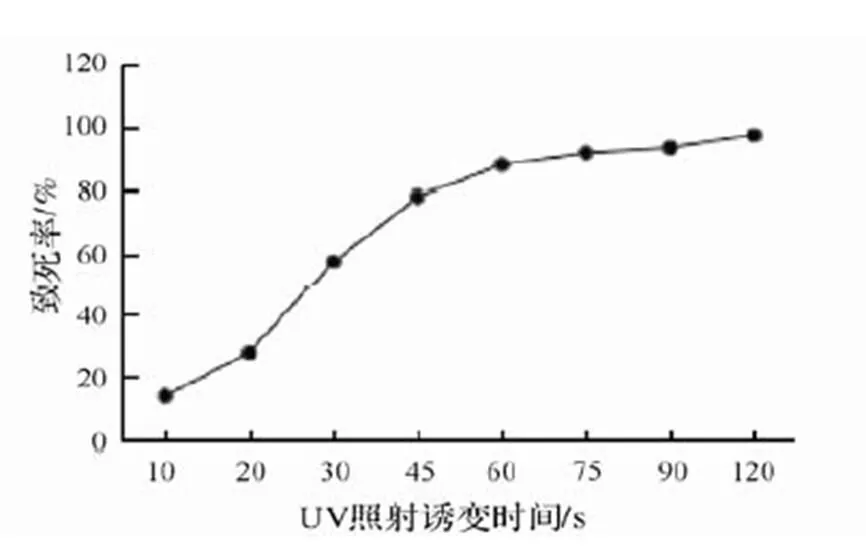
图4 紫外线诱变致死曲线
2.3 效价标准曲线的绘制
通过二倍系列稀释法测定枯草芽孢杆菌β-BS01发酵上清液的效价,离心后稀释1/4倍未出现抑菌圈,发酵上清液点样量为200μL,说明该发酵上清液的一个活力单位为1/20其效价为20AU/mL。曲线回归方程=0.192 9+0.885 7,回归系数2=0.917 4。可知效价对数值与抑菌圈直径差成良好的线性关系。因此该曲线可以作为标准曲线使用(图3)。
2.4 紫外诱变处理
2.4.1 紫外诱变时间的选择 出发菌株的致死率随紫外线照射时间的增加不断增大,照射30 s时,致死率为57.6%;照射60 s时,致死率增大至88.3%;照射120 s致死率高达97.7%。目前国内原始菌株紫外诱变致死率大多选择80%~90%,所以本实验选择照射时间为60~75 s,作为最佳诱变时间(图4)。
2.4.2 紫外诱变正突变株的筛选 利用紫外照射方法得到的枯草芽孢杆菌β-BS01突变菌株,随机筛选30株接种于30 ℃下160 r/min摇瓶发酵复筛,按照1.2.4的方法测量发酵液效价,从中选出3株效价最高的正突变菌株(表1)。

表1 紫外线(UV)诱变筛选结果
2.5 高产菌株传代稳定试验
将诱变后的高效突变株枯草芽孢杆菌UBS-A03与UBS-A29在平板上连续传代10次,每一代平面培养均进行发酵培养,其中UBS-A29的效价比较稳定(表2)。

表2 菌种传代稳定实验
3 讨论与结论
实验结果表明枯草芽孢杆菌β-BS01经培养基优化和紫外线诱变后得到的一株高产突变种UBS-A29具有更高的抑菌效果,其效价由出发菌株的20 AU/mL提高到34 AU/mL,约是初始菌株枯草芽孢杆菌β-BS01的1.7倍且传代10次较为稳定,适合于工业化生产。虽然本实验已在试验田块做中试,但是对于大规模田间推广需要做进一步的研究,尤其是突变株对植物有益菌是否产生毒理作用尚未调查,对于上述问题有待于后续的研究。
[1] 杨森, 王金水, 杨小佳, 等. 枯草芽孢杆菌诱变育种研究进展[J]. 农产品加工(学刊), 2014, 13(5): 76-78.
[2] 曾地刚, 雷爱莹, 彭敏, 等. 枯草芽孢杆菌的分离及其净化水质的研究[J]. 水利渔业, 2007, 27(6): 55-56.
[3]Deepak V, Kalishwaralal S, Ramkumarpandian S, et al. Optimization of media composition for nattokinase production byusing response surface methodology[J]. Biore-source Technology, 2008, 99(17): 8170-8174.
[4] 王晓云, 王慧, 赵燕, 等. 紫外诱变选育高活性蛋白酶枯草芽孢杆菌及其降解饲料能力评价[J]. 中国水产科学, 2016, 23(6): 1351-1357.
[5] 高同国, 贾天瑶, 郭晓军, 等. 枯草芽孢杆菌8-32拮抗菌株的紫外诱变选育[J]. 河北大学学报(自然科学版), 2015, 35(6): 610-615.
[6] 张哲. 改造枯草芽孢杆菌代谢通路制备透明质酸[D]. 长春: 吉林大学, 2017.
[7] 中国科学院微生物研究所. 中国微生物菌种保藏管理委员会普通微生物中心菌种目[M]. 北京: 科学出版社, 1982: 12-14.
Mutation Breeding of Beta Bacillus Subtilis and Its Inhibitory Effectson Common Fungal Diseases in Northeast China
WANG Xiang-yu1, HU Mao-ying2, WU Yun-fei2, LI Lan1, REN Guo-li2*
(1. College of Science, Jiamusi University, Jiamusi, Heilongjiang 154007, China; 2. Institute of Agricultural and Environmental Bio-technology, Jiamusi University, Jiamusi, Heilongjiang 154007, China)
Mutagenesis and screening experiments on Bacillus subtilis β-BS01 were conducted by using the determination of titer, and the inhibitory effects of Bacillus subtilis β-BS01 and its mutants on common fungal diseases in Greenhouses in Northeast China were explored. Mutation of Bacillus subtilis β-BS01 was carried out by two methods of medium optimization and UV mutagenesis, and, a random screening method was used to prick off the mutant strains which could inhibit the growth of common fungal pathogens in the Northeast greenhouses and verified the genetic stability of the mutant 10 generations later. A Bacillus subtilis mutant UBS-A29 which could enhance the ability of common fungal diseases in Northeast greenhouses was obtained, and its titer was increased to 34 AU/mL, which was about 1.7 times higher. The treated Bacillus subtilis further enhanced the ability to inhibit fungal diseases, and had potentials for controlling and weakening the greenhouse fungal diseases.
Bacillus subtilis; inhibition; Northeast greenhouse; UV mutagenesis; titer
Q93-335
A
2095-3704(2018)01-0016-04
2017-11-08
黑龙江省大学生创新创业训练计划重点项目(201710222012)和黑龙江省教育厅基本科研业务费基础研究项目(2016-KYYWF-0546)
王相玉(1997—),男,主要从事环境生物学研究,1251999795@qq.com;
通信作者:任国莉。
王相玉, 胡贸英, 吴云飞, 等. 枯草芽孢杆菌β-BS01诱变株对东北温室常见真菌病害的抑制[J]. 生物灾害科学, 2018, 41(1): 16-19.
