混合盐胁迫对刺槐和绒毛白蜡根系生长及其解剖结构的影响
2018-04-13张瑞芳侯澄辉刘子敬马闯
张瑞芳,侯澄辉,刘子敬,马闯
混合盐胁迫对刺槐和绒毛白蜡根系生长及其解剖结构的影响
张瑞芳,侯澄辉,刘子敬,马闯通信作者
(天津农学院 园艺园林学院,天津 300384)
以刺槐和绒毛白蜡为研究对象,设置不同浓度的NaCl和Na2CO3混合盐胁迫,对比两种植物的生物量分配、盐敏感指数和盐耐受指数的差异,制作石蜡切片观察盐胁迫对根系结构的影响。结果表明:随着盐胁迫程度的增加,刺槐和绒毛白蜡的生长均受到抑制;低浓度(0.2%)的盐胁迫对刺槐的生物量有促进作用,盐敏感指数和耐受性指数最高,而绒毛白蜡在中盐浓度下(0.4%)耐受性最高,在高盐浓度下(0.8%)敏感性较高;在混合盐胁迫下,绒毛白蜡根系周皮比例增加程度大于刺槐,而皮层比例增加程度低于刺槐,绒毛白蜡根系中维管束比例减小,而刺槐趋势相反。说明在盐胁迫下刺槐和绒毛白蜡采取不同的耐盐策略。
刺槐;绒毛白蜡;根系;维管束;皮层
根系是植物生命活动的重要器官,具有支撑和吸收水分及矿物质营养的作用,在全球碳循环和抗性生理等方面的研究价值受到各国学者关注。当根系受到胁迫后,其木质化程度、输导组织、周皮等解剖结构均会发生变化[4]。Imada等[5]研究发现在低浓度的盐处理下,多枝柽柳()细根生物量和长度增加,具有较高的土壤水分可用性,而中盐度处理对细根的分布范围影响较大。张瑞群等[6]研究发现,单盐和水分交互胁迫下多枝柽柳的根系皮层厚度变薄、维管柱变厚。在盐碱土壤中,植物根系不仅在生理上受到单盐毒害和渗透胁迫的影响,而且在生长和结构方面也会受到土壤板结、离子交换能力下降等因素的影响。因此,探究根系在盐胁迫下的生长发育和组织结构的变化,对解释植物耐盐机理、探索植物耐盐潜力具有重要的理论意义。
本研究模拟自然条件下土壤中NaCl和Na2CO3含量,配置不同浓度的混合盐溶液,对刺槐和绒毛白蜡1年生幼苗进行混合盐胁迫,并测定生物量的地上、地下分配状况,观察根系解剖结构变化,分析混合盐胁迫对根系生长和解剖结构的影响,从而进一步阐明这两种植物的耐盐机理。
1 材料与方法
1.1 材料培养
刺槐与绒毛白蜡种子采集于2016年9月,挑选成熟饱满的种子,风干后将种子放入布袋,4℃低温储藏。同年11月,种植于育苗穴盘中,育苗穴规格为上口径4.5 cm×高 4.0 cm×下口径2.0 cm,每盘50穴,每穴点播3~5粒种子。使用干燥蛭石作为培养基质,每穴20 g。播种后将育苗盘置于温室内受自然光照,昼夜平均温度为20.9~28.6 ℃、平均湿度24.9%~30.7%。
1.2 混合盐胁迫处理
种子萌发30 d后,刺槐与绒毛白蜡幼苗均长势旺盛,每穴定植一株。设置Na+浓度为0(对照),0.2%、0.4%、0.6%、0.8%的NaCl和Na2CO3混合盐溶液[7],二者Na+离子质量比值为1∶1,每个处理重复3个育苗盘。采取浓度逐渐递加的方法,以0.2%作为盐胁迫起始浓度,每天递增0.2%,对照组补充等量的蒸馏水,处理组达到目标浓度后,每隔2 d补充一次蒸馏水,将渗出液倒入种植穴中,防止盐分流失。
1.3 测定方法
幼苗生长指标测定 达到预期浓度15 d后取样,将根、茎、叶洗净,将茎、叶烘干保存,使用游标卡尺和电子天平测定长度和生物量,根系置于FAA固定液中保存。
根系解剖结构观测 在试验结束时进行毁灭性取样,选取形态学下端幼苗主根中段2/3的部分,截成1 cm的小段,取3个重复放入FAA固定液中固定,采用常规石蜡切片法制片[8]。在FAA 固定液中固定24 h 以上。将固定材料用梯度乙醇脱水,二甲苯透明,石蜡渗透包埋,Leica RM2235 切片机切片,番红-固绿双重染色,加拿大树胶封片,Leica DM4000B 显微镜观察,Leica DFC450 CCD相机对有代表性的石蜡切片拍照,Motic 3000 成像系统测量皮层厚度、维管束直径和根直径,计算维管束-根直径比。
1.4 盐敏感指数(SSI)和盐耐受指数(STI)计算
根据 Molhtar等[9]和 Khayat等[10]文献中的公式,分别计算混合盐胁迫下刺槐和绒毛白蜡地上、地下盐敏感指数(SSI)和耐受指数(STI):
=[(NaCl-control)/control]×100
那天,初夏的阳光暖暖地照着大地,微微熏风一阵连着一阵,从洞庭湖那边吹过来,吹得村人们一个个昏昏欲睡,都在田畈里薅禾呢,薅了老半天,还没薅出几丈远。就在这时,人们不约而同地听到了喜姑的歌声:
=(NaCl/control)×100
式中,NaCl表示盐处理下植株(地上/地下)干重,control表示对照植株(地上/地下)干重[11]。
1.5 数据分析
不同盐浓度间测定指标采用SPSS 18.0数据处理软件进行一维方差检验(Duncan one-way analysis,<0.05),同一盐浓度下刺槐和绒毛白蜡根冠比采用T-test,使用Sigmaplot 10.0进行柱形图制作。
2 结果与分析
2.1 盐胁迫对刺槐和绒毛白蜡生物量分配的影响
从表1可以看出,随着盐浓度的增加,刺槐和绒毛白蜡的地上部分生长受到抑制。与CK相比,在0.2%盐浓度下刺槐地上部分的生物量增加了69.57%,且差异显著(<0.05),而盐浓度为0.4%、0.6%、0.8%时,地上部分生物量分别减少了39.13%、13.04%和26.09%。与CK相比,绒毛白蜡在盐浓度为0.2%、0.4%、0.6%、0.8%时,生物量分别下降了36.36%,18.18%,45.45%和66.67%,且差异显著(<0.05)。说明低浓度的盐胁迫(0.2%)对刺槐地上部分生长有促进作用。
盐浓度的增加对刺槐和绒毛白蜡的地下部分生物量积累作用效果不同。与CK相比,在盐浓度0.2%时,刺槐地下部分生物量增加了71.43%,且差异显著(<0.05),而盐浓度在0.4%、0.6%、0.8%时,刺槐地下部分生物量变化无显著差异。而绒毛白蜡随着盐浓度增加,与CK相比,地下生物量分别下降了36.36%、21.21%、45.46%、66.67%,差异显著(<0.05)。
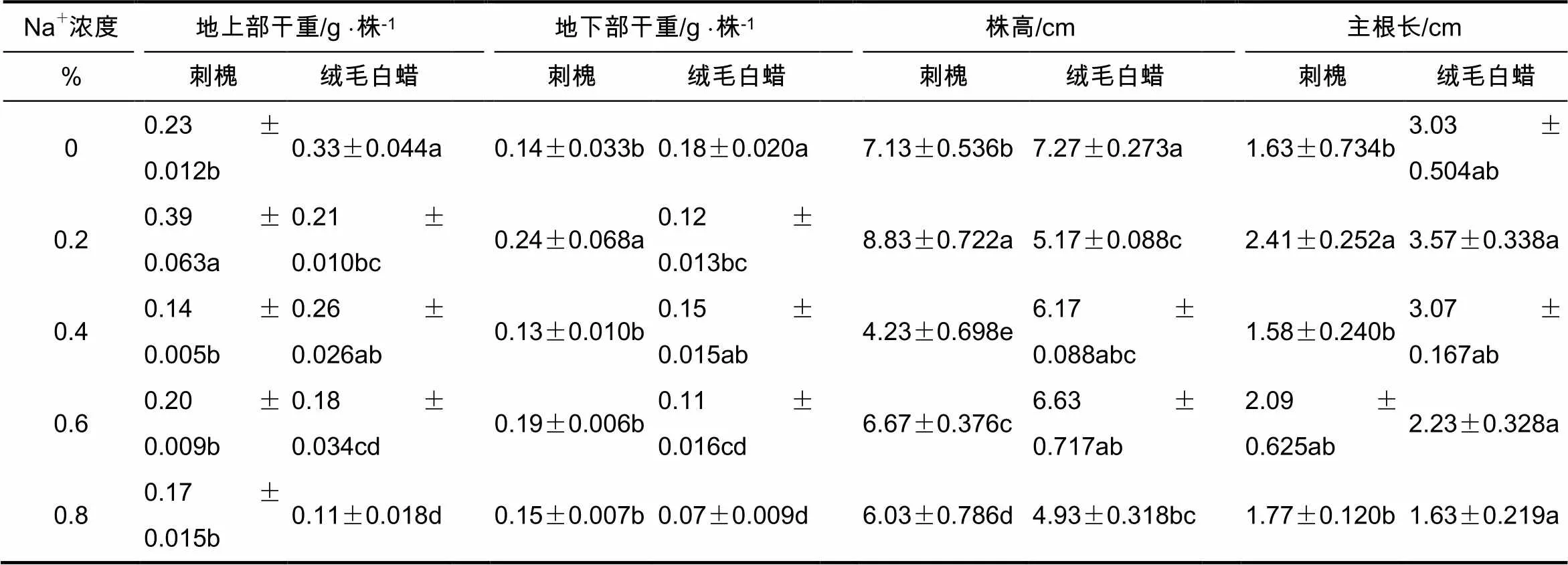
表1 盐胁迫对刺槐和绒毛白蜡地上部和根生物量的影响
注:表中小写字母表示<0.05水平上差异显著,下同
随着盐浓度的增加,刺槐和绒毛白蜡的株高总体呈下降的趋势。与CK相比,在盐胁迫浓度为0.2%时,刺槐株高增加了23.84%,而在盐浓度0.4%、0.6%、0.8%时,刺槐株高分别减少了40.67%、6.45%和15.42%。随着盐浓度增加,绒毛白蜡株高分别下降了28.89%、15.13%、8.81%,18.43%。在盐胁迫浓度为0.2%时,刺槐主根长增加15.31%,其后随盐浓度增加主根长变化不显著。绒毛白蜡主根长在高盐浓度下(0.8%)与对照相比下降了54.34%,差异显著(<0.05)。
根冠比是一个反映植物抗逆性的重要指标。由图1可知,随着盐胁迫浓度的增加,刺槐根冠比呈现先增加后下降的趋势,而绒毛白蜡根冠比呈现增加的趋势。其中,与对照组相比,刺槐根冠比在盐浓度0.2%时增加了30.86%,而在盐浓度为0.4%、0.6%和0.8%时分别下降了1.72%、12.8%和28.99%。与对照组相比,绒毛白蜡根冠比分别增加了3.28%、7.58%、9.89%和22.41%。
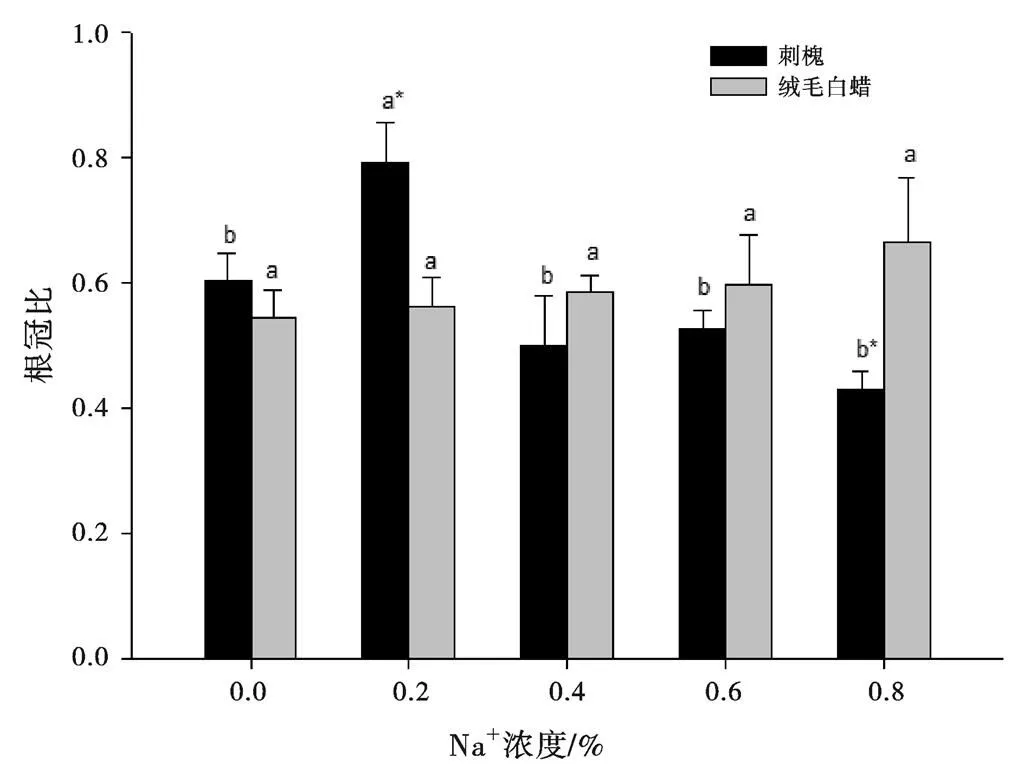
图 1 盐胁迫对刺槐和绒毛白蜡根冠比的影响
在盐浓度0.2%的胁迫下,刺槐与绒毛白蜡的根冠比差异最大(<0.05),刺槐比绒毛白蜡的根冠比多增加了40.68%,而在盐浓度为0.8%的胁迫下,绒毛白蜡比刺槐的根冠比多增加了20.58%。说明低盐浓度(0.2%)促进刺槐根系生长,但高浓度盐胁迫(0.8%)对刺槐根系生长抑制作用大于绒毛白蜡。
2.2 白蜡和刺槐对盐胁迫敏感性和耐受性
植物各部位对盐胁迫有不同的敏感程度,因此盐敏感指数可以反映盐分对植物器官的影响,某一部位敏感指数越小,其对盐胁迫越敏感[11]。由图2可以看出,刺槐地上部位对0.6%的盐胁迫浓度最为敏感,而在盐胁迫浓度为0.2%时敏感性较差。绒毛白蜡地上部位则是在盐胁迫浓度为0.4%时对盐分最敏感,在盐胁迫浓度为0.8%时敏感度下降。从图3可以看出,刺槐地下部位在盐胁迫浓度为0.6%时对盐分最为敏感,而在盐胁迫浓度为0.2%时对盐分敏感性较差。绒毛白蜡地下部分在盐胁迫浓度为0.4%时对盐分最为敏感,0.8%时敏感性较差。可知,刺槐对低盐环境(0.2%)有一定适应性,而绒毛白蜡对高盐环境(0.8%)反应迟钝。
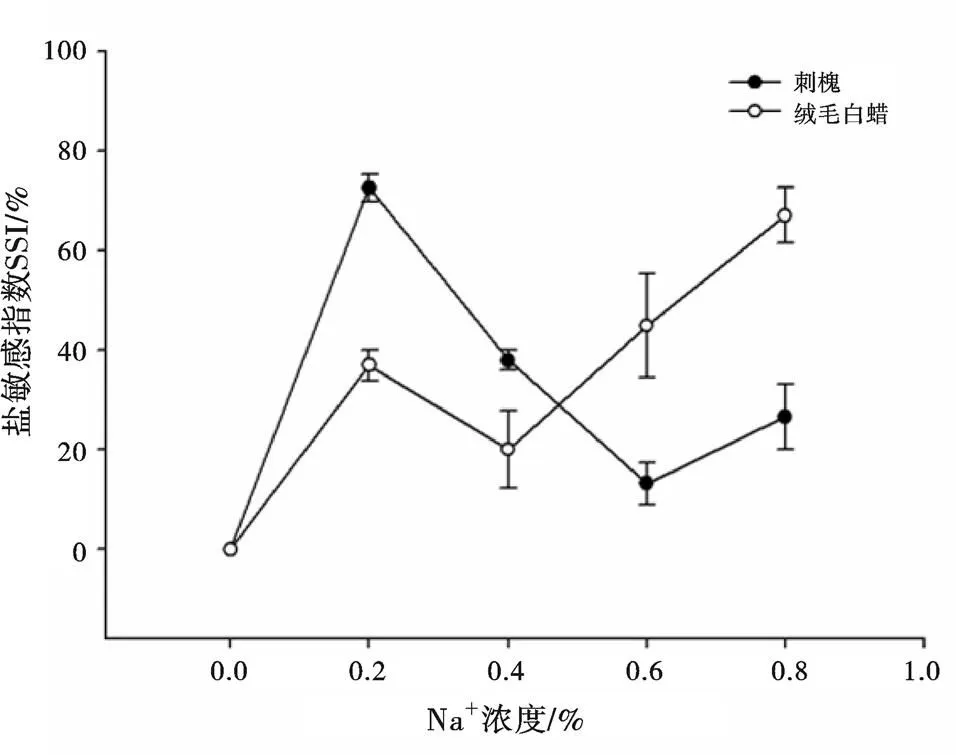
图 2 盐胁迫下刺槐和绒毛白蜡地上部的盐敏感指数
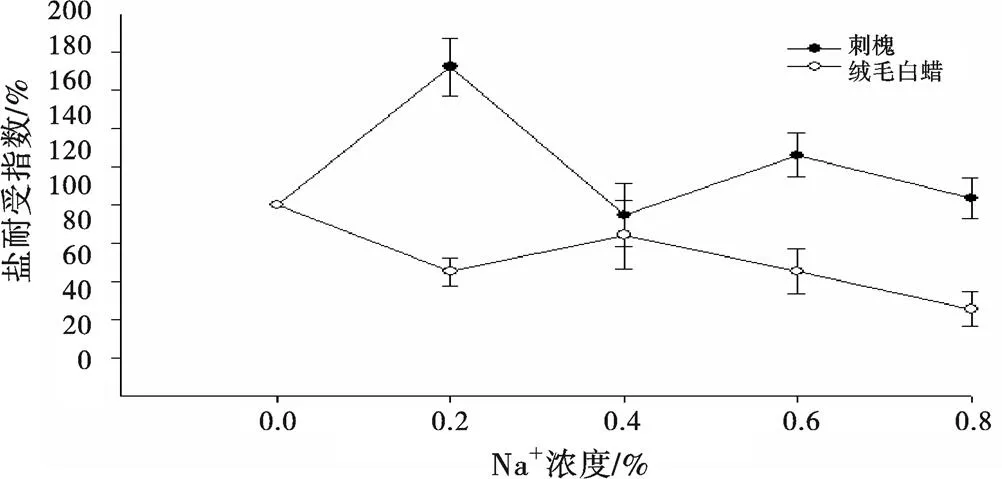
图 3 盐胁迫下刺槐和绒毛白蜡地下部的盐敏感指数
从图4、图5可知,刺槐地下部分盐耐受指数在盐胁迫浓度0.2%时最高,在0.4%时最低;绒毛白蜡在0.4%最高,在0.8%时最低。可知,刺槐和绒毛白蜡地上和地下部分在中、低浓度(0.2%~0.4%)盐胁迫下,耐受性最强,而随着盐胁迫浓度增加,两物种耐受性均下降。
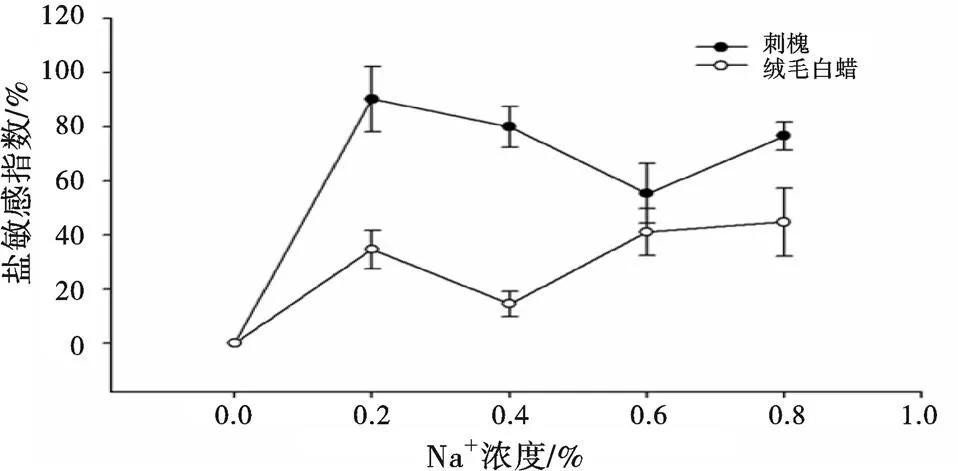
图 4 盐胁迫下刺槐和绒毛白蜡地上部分的盐耐受指数
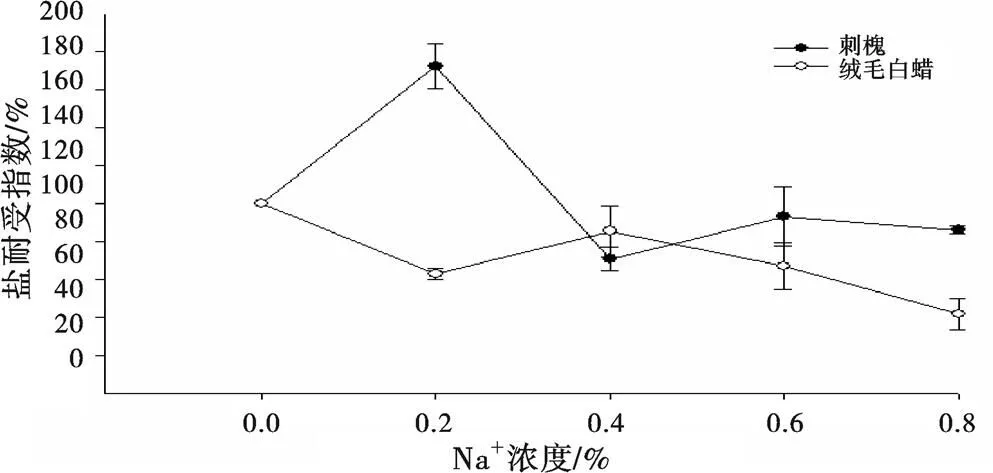
图 5 盐胁迫下刺槐和绒毛白蜡地下部分的盐耐受指数
2.3 盐胁迫对刺槐和绒毛白蜡根系解剖结构的影响
混合盐胁迫使根系不同组织比例发生改变。随着盐胁迫浓度的增加,刺槐和绒毛白蜡的周皮厚度占径比增加。由表2、表3可知,与CK相比,刺槐周皮占径比在盐浓度为0.2%、0.4%、0.6%、0.8%时,分别增加了32.89%、38.21%、35.31%、41.96%。而绒毛白蜡分别增加了56.61%、86.25%、64.75%、65.69%。
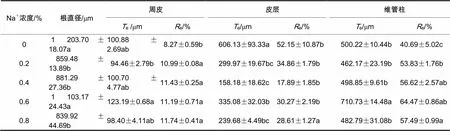
表 2 盐胁迫对刺槐幼苗根系解剖结构的影响
注:e为实际测量值,e为所占根直径百分比,下同
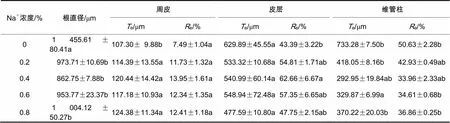
表3 盐胁迫对绒毛白蜡幼苗根系解剖结构的影响
混合盐胁迫使刺槐皮层厚度占径比减小、绒毛白蜡则增加。与CK相比,刺槐皮层占径比随着盐浓度的增加分别减少了33.15%、65.70%、41.96%、45.14%,而绒毛白蜡则分别增加了26.32%、44.41%、32.17%、10.05%。
随着盐胁迫浓度的增加,刺槐维管柱占径比不断增大,而绒毛白蜡则减少。与CK相比,不同浓度下刺槐维管柱占径比分别增加了32.29%、39.15%、58.44%、41.29 %,而绒毛白蜡分别减少了15.21%、32.93%、31.64%、27.20%。
3 讨论与结论
生物量分配策略是植物遭受环境变化时产生的适应机制[6]。在盐分、水分以及低温胁迫时,生物量分配的一般策略是增加地下部分比例而减少地上生长。本研究发现,在混合盐胁迫下,刺槐和绒毛白蜡的生物量总体呈减少趋势,而低浓度盐条件下(0.2%),刺槐的地上、地下生物量增加,根冠比增加,说明低盐胁迫对刺槐根系生长的促进作用大于地上部分。这与王树凤等[11]研究的2 种栎树在盐胁迫下的生长表现一致。根冠比的增加有利于根对水分和营养的获取,稀释细胞内的盐分,提高渗透势,增强植物体在盐环境下的生存能力[12]。
盐敏感度是体现植物对盐环境的快速反应能力的指标,而耐受度是反映植物对盐环境的忍受能力[13-14]。研究发现,刺槐和绒毛白蜡对0.2%~0.4%的混合盐环境具有一定的适应能力,但刺槐地下部分对盐胁迫的敏感程度大于地上部分,而绒毛白蜡趋势相反。根系是来自土壤水分、盐分等胁迫的直接承受体。一般来讲,耐盐性植物通常会通过主动扩大根系分布以适应逆境条件,而敏感植物则主要采取避性机制,通过减少根的分布以最大限度降低逆境条件对植物的毒害[10]。在本研究中,刺槐对盐环境的改变反应迅速,通过调节根系生长,增加根系投入吸收水分;而绒毛白蜡则主要依靠降低地上生物量,减少在低渗环境下的蒸腾。两种植物采取不同的盐环境下的生存机制。
结构植物学研究认为,环境决定植物的形态建成。盐胁迫下植物根系功能的调整与权衡对植物的耐盐性具有重要意义[15]。本研究中发现,刺槐和绒毛白蜡的周皮厚度占径比随着盐胁迫浓度的增加呈上升的趋势。这与张瑞群等人对多枝柽柳根系解剖结构研究结果一致[6]。盐生植物根尖发达的表皮和外皮层及明显加厚的内皮层,大大抑制了有害离子进入根细胞,可以有效缓解盐害[16]。而刺槐的维管柱厚度占径比呈增加趋势,这与发达的木质部可增加输导组织比例以提高水分输送效率有关[17]。而绒毛白蜡周皮厚度增加有利于抵御外界较低渗透势造成的体内水分外渗,避免根系生理干旱的发生,具有典型的耐渗透胁迫型植物特征[18-19]。
综合上述,本项研究认为刺槐和绒毛白蜡在0.2%~0.4%混合盐环境下适应性较好,低盐胁迫对刺槐有一定促进作用,其反应敏感,可通过增加根系中维管束比例,提高水分运输效率,而绒毛白蜡则通过减少地上部分蒸腾,增加根系周皮厚度以提高忍受外界渗透胁迫的能力。因此,在盐胁迫下刺槐和绒毛白蜡采取了不同的耐盐机制。
[1] 孙景宽,张文辉,刘新成. 干旱胁迫对沙枣和孩儿拳头的生理特性的影响[J]. 西北植物学报,2008,28(9):1868-1874.
[2] 武德,曹帮华,刘欣玲. 盐碱胁迫对刺槐和绒毛白蜡叶片叶绿素含量的影响[J]. 西北林学院学报,2007,22(3):51-54.
[3] 杜振宇,刘方春,马丙尧,等. 滨海盐碱地人工刺槐绒毛白蜡混交林的根系分布与细根生长[J]. 林业科学,2014(3):10-15.
[4] Nobel P S. Physicochemical and environmental plant physiology[M]. San Diego:Academic Press,1991.
[5] Imada S,Iviatsuo N,Acharya K,et al. Effects of salinity on fine root distribution and whole plant biomass ofcuttings[J]. Journal of Arid Environments,2015,114(114):84-90.
[6] 张瑞群,马晓东,吕豪豪. 多枝柽柳幼苗生长及其根系解剖结构对水盐胁迫的响应[J]. 草业科学,2016,33(6):1164-1173.
[7] 石德成,盛艳敏,赵可夫. 不同盐浓度的混合盐对羊草苗的胁迫效应[J]. 植物学报,1998,40(12): 1136-1142.
[8] 李和平. 植物显微技术[M]. 北京:高等教育出版社,2009.
[9] Molhtar R,Ahmedou V,Arbi G,et al. Effect of NaCl on the growth and the ionic balance K+/Na+of two populations ofL.(Papilionaceae)[J]. South African Journal of Botany,2007,73(4):623-631.
[10] Khayat P N,Jamaatiesomarin S,Zabihiemahmoodabad R,et al. Screening of salt tolerance canola cultivars(L.)using physiological markers[J]. World Applied Sciences Journal,2010,10(7):817-820.
[11] 王树凤,胡韵雪,孙海菁,等. 盐胁迫对2种栎树苗期生长和根系生长发育的影响[J]. 生态学报,2014,34(4):1021-1029.
[12] 桂枝,高建明. 盐胁迫对6个苜蓿品种脯氨酸含量和超氧化物歧化酶活性的影响[J]. 天津农学院学报,2007,14(4):18-21.
[13] Li F,Xie Y H,Qin Y. Adaptive strategies of wetland plants in salt stress environment[J]. Chinese Journal of Ecology,2009,28(2):314-321.
[14]杜锦,蒙雨莲,向春阳,等. 种子引发对盐胁迫下玉米种子萌发及幼苗生长的影响[J]. 天津农学院学报,2012,19(1):1-6.
[15] 朱宇旌,胡自治. 小花碱茅叶适应盐胁迫的显微结构研究[J]. 中国草地学报,2001,23(2):19-22.
[16] 黄振英,吴鸿,胡正海. 30种新疆沙生植物的结构及其对沙漠环境的适应[J]. 植物生态学报,1997,6(21):521-530.
[17] 杨静,陈金林,徐柏森,等. 盐胁迫对美国白蜡和滨梅根系超微结构的影响[J]. 西南林学院学报,2009,29(5):22-27.
[18] 侯江涛,高启明,克热木·伊力. NaCl胁迫对两种扁桃幼苗根系K+、Na+、Cl-含量和超微结构的影响[J]. 北方园艺,2014(23):1-5.
[19] 王丹,骆建霞,武春霞.两种地被植物解剖结构与抗旱性关系的研究[J]. 天津农学院学报,2005,12(2):15-17.
责任编辑:杨霞
Effects of mixed salt stress on the root growth and natomical structure ofand
ZHANG Rui-fang, HOU Cheng-hui, LIU Zi-jing, MA ChuangCorresponding Author
(College of Horticulture and Landscape, Tianjin Agricultural University, Tianjin 300384, China)
The biomass allocation, salt sensitive index and salt tolerance index were compared betweenandunder the mixed salt stress with different concentrations of NaCl and Na2CO3. The paraffin sections were made to observe the effect of salt stress on the root structure. The results showed that the growth of bothandwere suppressed with the increase of salt stress. The biomass ofincreased at the low concentration of salt stress(0.2%), meanwhileperformed the highest salt sensitive index and tolerance index.performed the highest tolerance index in the moderatesalt concentration(0.4%)and stronger sensitivity under high salt concentration(0.8%). The root periderm proportion ofwas higher than that of’s in the mixed salt stress, while the cortex ratio increased less than.Thevascular bundle proportion ofroot was reduced, while the opposition trend was observed in. Under salt stress,andhave different salt tolerance strategy.
;; root system; vascular bundle; cortex
Q948.113
A
1008-5394(2018)01-0014-05
10.19640/j.cnki.jtau.2018.01.004
2017-09-22
国家自然基金项目(31600499);国家大学生创新创业训练计划资助项目(201610061097);天津市2016年度“131”创新型人才培养工程资项目(无编号);天津农学院高校教师教育改革创新引导发展项目(20170204)
张瑞芳(1994-),女,硕士在读,主要从事植物生理生态学研究。E-mail:1351668229@qq.com。
马闯(1984-),男,博士,讲师,主要从事耐盐植物引种与选育。E-mail:machuang_tjau@126.com。
