不同栽培环境对甘草生长及抗性的影响
2018-04-13范继红李玉舒
范继红, 高 琼, 徐 琰, 李玉舒
(北京农业职业学院,北京 102442)
甘草是我国最常用的大宗药材之一,药用部位是根及根茎,味甘甜,性平和,生用泻火解毒缓急止痛,炙用散表寒补中益气,善于调和药性,解百药之毒,被誉为国之药老,有“十方九草”之说。甘草药材的植物来源主要有3种,分别是甘草(也称乌拉尔甘草)、胀果甘草和光果甘草[1]。甘草作为药食兼用植物,市场需求量巨大,连续多年的掠夺性采挖使我国野生甘草资源日趋枯竭,生态环境严重恶化,通过人工栽培甘草代替野生甘草,将是实现甘草资源可持续利用的根本有效措施[2]。
目前,甘草人工栽培技术已经受到重视并取得阶段成果,如野生变家植驯化、人工栽培和发芽低的问题基本得到解决[3],干旱胁迫、土壤条件、施肥、密度等环境条件对甘草酸产量影响的研究也很普遍[4-7]。本研究着重于不同栽培环境对一年生甘草幼苗生长及抗性指标的影响,为人工栽培甘草的应用提供理论参考。
1 材料与方法
1.1 供试植物及试验地概况
供试植物:乌拉尔甘草和胀果甘草,种子购于北京市大兴区时珍中草药技术有限公司。
试验地点:北京农业职业学院绿色科技示范园,土壤为沙质壤土,土壤有机质含量为1.205%,碱解氮含量为 50.63 mg/kg,速效磷含量为10.38 mg/kg,速效钾含量为130.62 mg/kg,pH值为7.33。
北京地区为温带大陆性气候,年平均气温为11.9 ℃,历史最高气温达43.5 ℃,最低气温仅-26 ℃;年平均降水量582.8 mm,年平均无霜期202 d。
1.2 种子处理
播种前进行种子浸种,浸种前用1%高锰酸钾溶液将种子消毒30 min,以清水浸种1 d,浸种完成后将种子取出,用流水冲洗干净。将种子均匀摊到已高温消毒的湿纱布上,上面再盖1层湿纱布进行催芽,种子露白后进行播种。
1.3 播种及管理
2014年5月,分别在北京农业职业学院科技示范园17号温室内、温室外露地进行播种,平整试验地,采用开沟点播,株距15 cm,行距25 cm,播种深度0.5 cm左右,播后覆土镇压。出苗前喷水保湿,出苗后常规管理。根据试验安排酌情浇水,6至8月之间每隔1月浇1次营养液。
1.4 试验方法
试验样本采样时间分别定在7、8、9月,每个处理以随机取样方式选择5株作为试验样本,样本小心全部挖出,采样后直接回实验室测定。用直尺和游标卡尺测量苗高、主根长度和地径,鲜质量直接称量测定,烘干后测定干质量。叶绿素含量采用丙酮提取法测定,可溶性糖含量采用蒽酮显色法测定,可溶性蛋白含量测定采用考马斯亮蓝G-250法,游离脯氨酸含量采用酸性水合茚三酮显色法测定,丙二醛含量采用硫代巴比妥酸显色法测定。
2 结果与分析
2.1 不同栽培环境对甘草幼苗生长量的影响
分别将乌拉尔甘草和胀果甘草栽植于自然露地环境和温室环境,表1的试验结果显示,不同栽培环境下甘草的苗高、地径、主根长、鲜质量、干质量等生长指标差异显著,自然露地栽培的甘草长势显著优于温室栽培处理,但在同一栽培环境下乌拉尔甘草与胀果甘草之间的差别并不显著。从整体生长量数据来看,乌拉尔甘草在自然露地栽培环境下略弱于胀果甘草,但在温室栽培环境下略优于胀果甘草。
从苗高、地径来看,自然露地栽培与温室栽培相比,苗高平均高10 cm以上,地径平均大2.5 mm以上,差异显著。植物的地上部分与地下部分的生长具有相关性,根系生长的强弱直接影响植物地上部分的生长和代谢,而且根作为甘草药材的药用部位,是考察药材质量的关键部位。自然露地栽培与温室栽培相比,主根长平均长22 cm以上,差异显著。自然露地栽培与温室栽培的甘草相比,鲜质量、干质量等生物量指标都有显著差异。自然露地栽培甘草地上鲜质量是温室栽培甘草的5.8倍以上,地下鲜质量为5.5倍以上,地上干质量也为5.5倍以上,地下干质量为4.4倍以上(表1)。
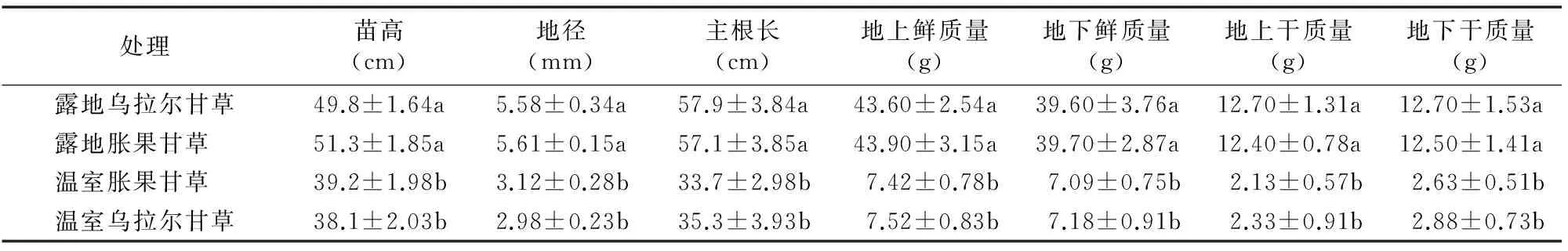
表1 9月测得不同处理甘草生长量指标
注:同列数据后不同小写字母表示在0.05水平上差异显著。
2.2 不同栽培环境对甘草叶绿素含量的影响
从试验结果看,本试验的4个处理之间叶绿素含量差异比较小。由图1可以看出,整体上看,温室栽培甘草叶绿素含量高于自然露地栽培处理,同时无论是自然露地栽培还是温室栽培,乌拉尔甘草叶绿素含量均高于胀果甘草。温室栽培的乌拉尔甘草叶绿素含量最高,叶绿素a含量为2.571 mg/g,叶绿素b含量为0.999 mg/g,总叶绿素含量为3.570 mg/g。

2.3 不同栽培环境对甘草幼苗主要渗透调节物质的影响
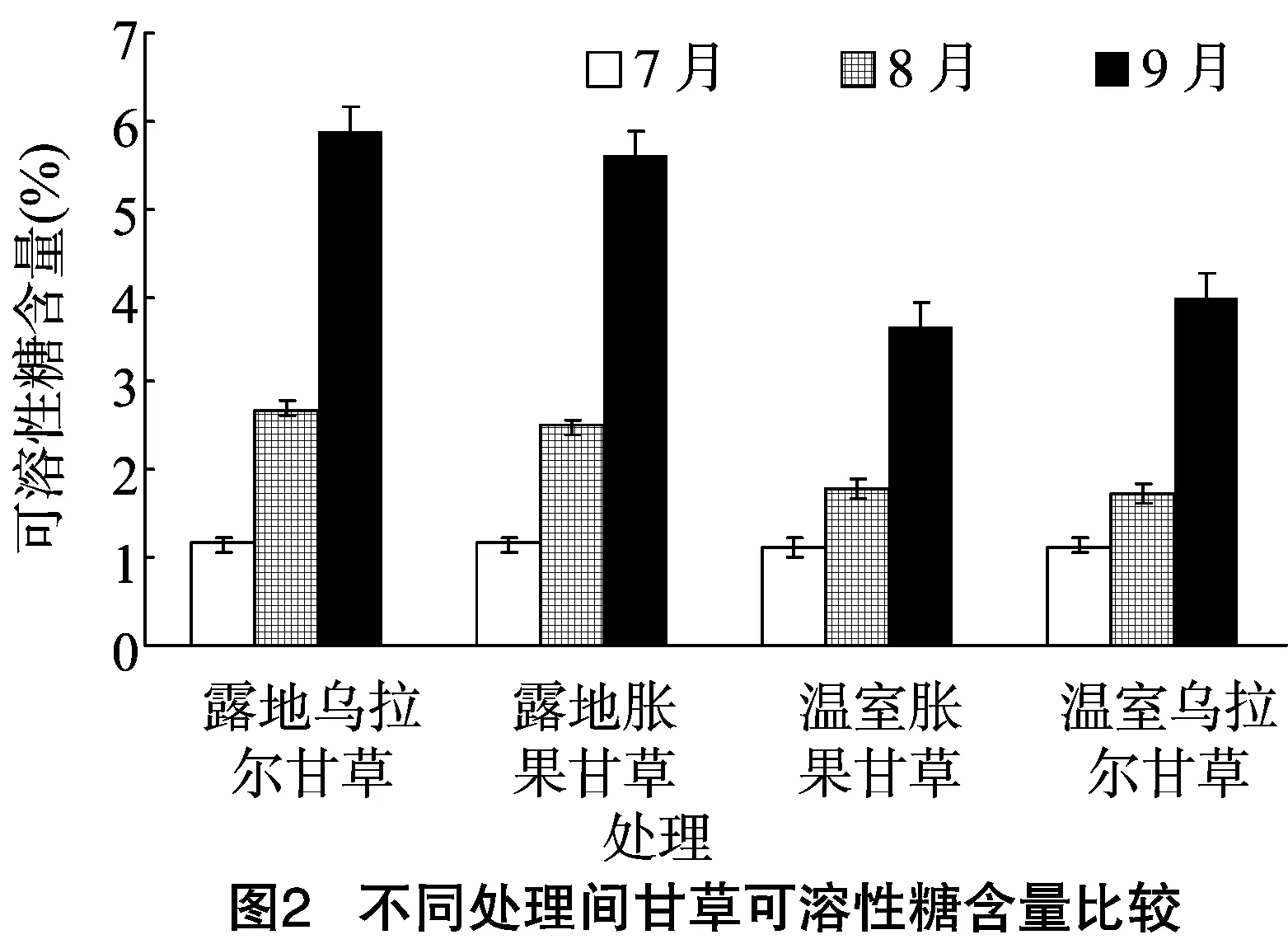
2.3.1不同栽培环境对甘草幼苗可溶性糖含量的影响不同栽培环境对可溶性糖含量影响较大,自然露地栽培的甘草可溶性糖含量最高,乌拉尔甘草和胀果甘草之间差异不明显,但不同生长期可溶性糖含量有明显差异。由图2可知,7月测得4个处理的可溶性糖含量普遍比较低,2个自然露地栽培处理的甘草可溶性糖含量分别为1.158%和 1.153%,2个温室栽培处理的甘草可溶性糖含量则分别为 1.136%、1.139%,4个处理之间差异不明显。8月,甘草可溶性糖含量较7月有明显提高,自然露地栽培处理的甘草可溶性糖含量增加最多,可溶性糖含量分别为2.708%、 2.496%,2个温室栽培处理的甘草可溶性糖含量则分别为 1.780%、1.729%,自然露地栽培处理与温室栽培处理之间差异较明显。9月,4个处理的可溶性糖含量都快速增加,自然露地栽培处理的甘草可溶性糖含量增加明显,2个温室栽培处理的甘草可溶性糖含量虽然也有大幅提高,但可溶性糖总量还是低于前者,且差异明显。乌拉尔甘草可溶性糖含量增加幅度最大,9月乌拉尔甘草的可溶性糖含量比8月明显增加, 达到5.876%,是8月的2.17倍,是7月的5.07倍。
2.3.2不同栽培环境对甘草可溶性蛋白含量的影响不同栽培环境对甘草可溶性蛋白含量影响不是特别明显,温室栽培的甘草可溶性蛋白含量较高,乌拉尔甘草和胀果甘草之间差异不明显,但不同生长期可溶性蛋白含量差异较明显。图3试验结果显示,7月测得4个处理的可溶性蛋白含量都普遍较低,2个自然露地栽培处理的甘草可溶性蛋白含量分别为 2.311、2.282 mg/g,2个温室栽培处理的甘草可溶性蛋白含量分别为2.669、2.949 mg/g,温室栽培处理可溶性蛋白含量高于自然露地栽培处理,但4个处理间差异不明显。8月甘草可溶性蛋白含量较7月有明显提高,温室栽培处理的甘草可溶性蛋白含量增加较多,乌拉尔甘草、胀果甘草可溶性蛋白含量分别为4.749、4.883 mg/g,自然露地栽培处理的甘草可溶性蛋白含量则分别为4.349、4.183 mg/g,自然露地栽培处理与温室栽培处理之间差异不明显。9月,4个处理的甘草可溶性蛋白含量都快速增加,温室栽培处理的甘草可溶性蛋白含量增加明显,可溶性蛋白含量分别为8.792、8.689 mg/g,自然露地栽培处理虽然也有大幅提高,但可溶性蛋白含量还是低于温室栽培处理,差异较明显。
2.3.3不同栽培环境对甘草脯氨酸含量的影响不同栽培环境对甘草脯氨酸含量影响不是特别明显,乌拉尔甘草和胀果甘草之间差异不明显,不同生长期脯氨酸含量略有差异。图4试验结果显示,7月和8月甘草脯氨酸含量变化很小,而且8月比7月略有降低,脯氨酸含量在92~107 μg/g,自然露地栽培处理与温室栽培处理之间差异不明显。9月,4个处理的甘草脯氨酸含量都有明显提高,乌拉尔甘草脯氨酸含量增加较明显,胀果甘草温室栽培处理的脯氨酸含量增加最少,不同时期差异也不明显。


2.4 不同栽培环境对甘草幼苗丙二醛含量的影响
植物器官在逆境下受到伤害,通常发生膜脂过氧化,其中丙二醛是膜脂过氧化最重要的产物之一,丙二醛的积累可能对膜和细胞造成一定的伤害。本试验发现,自然露地栽培处理与温室栽培处理之间丙二醛含量差异不明显,自然露地栽培甘草丙二醛含量略高于温室栽培处理。7月,丙二醛含量最高,8月、9月逐渐下降。自然露地栽培处理丙二醛含量较高,胀果甘草7月丙二醛含量为0.069 μmol/g,乌拉尔甘草7月丙二醛含量为0.065 μmol/g,温室栽培处理丙二醛含量较低。8月,各处理间丙二醛含量差别很小,丙二醛含量在0.044~0.048 μmol/g。9月,自然露地栽培处理丙二醛含量降低,温室栽培处理丙二醛含量相对较高。

3 结论与讨论
在一定的自然环境中,某些环境因子对生物的生长与消亡起着关键作用,不同的栽培环境会导致光、温、水气等环境因子的变化,往往对植物的生长发育产生很大影响。本研究选择自然露地栽培和温室栽培2种常见栽培方式,通过乌拉尔甘草和胀果甘草在生长及抗性方面的差异,分析适宜甘草生长的环境。
研究结果表明,在不同栽培环境下,甘草一年生实生苗苗高、地径、主根长、鲜质量、干质量等生长指标都有明显的差异,自然露地栽培的甘草长势显著优于温室栽培处理,但在同一栽培环境下乌拉尔甘草与胀果甘草之间的差异并不显著。从整体生长量数据来看,乌拉尔甘草在自然露地栽培环境下的生长量略低于胀果甘草,但在温室栽培环境下略高于胀果甘草。
叶绿素是光合作用中光能吸收、传递与转换的主要物质,不同植物叶绿素的含量与组成有差异,栽培措施、营养状况等条件的改变都会通过影响叶绿素的状况而影响光合作用。从叶绿素含量来看,乌拉尔甘草叶绿素含量高于胀果甘草,温室栽培甘草叶绿素含量高于自然露地栽培,这可能与温室弱光环境有关,植物要用更多的叶绿素来完成光合作用,具体有待进一步试验研究。
在逆境条件下,植物体内会积累大量的渗透调节物质,细胞内游离脯氨酸及可溶性糖、可溶性蛋白等与植物抗逆性之间呈正相关性。从可溶性糖含量看,自然露地栽培的甘草可溶性糖含量较高,乌拉尔甘草可溶性糖含量增加幅度最大,乌拉尔甘草9月的可溶性糖含量是8月的2.17倍,是7月的 5.07 倍。可溶性蛋白含量却是温室栽培的处理较高,9月温室栽培的甘草可溶性蛋白含量增加明显,胀果甘草可溶性蛋白含量为8.792 mg/g。在不同栽培环境下,游离脯氨酸含量差别不大。
丙二醛能强烈地与细胞内的各种物质发反应,丙二醛的积累能引起细胞膜的严重损伤。在本试验中,丙二醛含量在自然露地栽培与温室栽培之间差异并不明显,从时间上看7月丙二醛含量较高。
综合来看,乌拉尔甘草在不同栽培环境下,生长及抗性指标的表现更具优势,在环境适应性方面具有更大的适应范围。但是本试验中也发现抗性表现不明显或不稳定的现象,可能与温室栽培弱光高湿的环境有关,还有待进一步试验分析。
参考文献:
[1]国家药典委员会.中华人民共和国药典:一部[M]. 北京:化学工业出版社,2005:148.
[2]魏胜利,王文全,王海. 我国中西部地区甘草资源及其可持续利用的研究[J]. 中国中药杂志,2003,28(3):202-206.
[3]徐良,叶定江,徐鹤良. 中药无公害栽培加工与转基因工程学[M]. 北京:中国医药科技出版社,2000:216-230.
[4]刘长利,王文全,李帅英,等. 干旱胁迫对甘草生长的影响[J]. 中国中药杂志,2004,29(10):931-934.
[5]刘长利,王文全. 外源钙对人工培育甘草药材中甘草酸积累的影响[J]. 中华中医药学刊,2009,27(11):2281-2283.
[6]孙志蓉,翟明普,王文全,等. 密度对甘草苗生长及甘草酸含量的影响[J]. 中国中药杂志,2007,32(21):2222-2226.
[7]刘艳华,傅克治. 不同土壤环境生长乌拉甘草主要化学成分含量测定[J]. 中国兽药杂志,1996,30(4):25.
