紫外线对小麦叶锈病病菌流行学因素的影响
2018-04-13许换平郭慧杰闫红飞孟庆芳
许换平, 郭慧杰, 张 林, 闫红飞, 孟庆芳
(河北农业大学植物保护学院/国家北方山区农业工程技术研究中心/河北省农作物病虫害生物防治工程技术研究中心,河北保定 071000)
由专性寄生菌小麦隐匿柄锈菌(Pucciniatriticina)引起的小麦叶锈病是小麦生产上的重要病害之一,是世界上分布范围较广的病害,一般造成产量损失5%~45%,有时甚至更高[1]。我国曾在1969年、1973年、1975年、1979年、1990年发生流行小麦叶锈病[2]。2015年、2016年,笔者所在研究室的人员在采集小麦叶锈病病菌标样的过程中发现,小麦叶锈病发病率较高,尤其是2015年的发病率较高,发病面积较广。尤其是在淮河以南地区,小麦叶锈病发病早,严重度高,严重影响了小麦的产量。
小麦叶锈病在我国的侵染循环包括越夏、秋苗发病、越冬、春季流行等4个过程。小麦叶锈病病菌可以产生性孢子、锈孢子、夏孢子、冬孢子、担孢子等5种孢子,其中夏孢子在病害循环中占有重要的地位,我国小麦叶锈病的发生主要依靠夏孢子的侵染和传播,在夏孢子传播和侵染过程中,环境条件的改变会影响其存活及病害的发生情况,特别是紫外线会导致毒性的变化[3-5]和病菌的死亡[6-7]。但由于人为原因导致臭氧层空洞,使得地球表面上的紫外线强度越来越强,不断加强的紫外线会影响植物病原菌、寄主植物和植物病害[8]。当前,紫外线已经被认为是影响植物病害发生和流行的最重要的环境因素之一[9-10]。因此,加强研究紫外线对植物病原菌和植物病害的影响,已经成为控制植物病害和保证粮食安全的重中之重。紫外线诱变也是获得锈菌突变菌株的重要手段。Flor等采用紫外诱变的方法,获得了致病性发生变化的亚麻锈菌菌株[11-12]。Maddison等研究了自然条件下紫外线对锈病病菌远距离传播的影响[13]。紫外线诱变在条锈病病菌研究中的应用较多,商鸿生等通过紫外线诱变获得了多个毒性发生突变的菌株[3,14];黄丽丽等对突变菌株进行了随机扩增多态性DNA标记遗传多样性分析,初步认为紫外线可以使小麦条锈病病菌基因组DNA发生较大的变化[4]。在小麦叶锈病病菌研究中,鹿巍对小麦叶锈病病菌05-5-46单孢菌株进行紫外诱变,获得了3株稳定遗传的小麦叶锈病病菌突变菌株Mut1、Mut2、Mut3[15]。本研究采用紫外诱变法,获得毒性发生变异的突变菌株,并进一步探究紫外线对小麦叶锈病病菌孢子萌发和流行学因素的影响,以期为小麦叶锈病病菌致病性的研究提供材料和理论基础。
1 材料与方法
1.1 试验材料
1.1.1供试菌株小麦叶锈病病菌单孢菌株12-5-1384-1和诱变菌株1384-10-B-1,由河北农业大学小麦叶锈病研究室保存。其中,单孢菌株12-5-1384-1在鉴别寄主TcLr1上的侵染型为“;”,诱变1384-10-B-1菌株是由菌株12-5-1384-1在1 600 μW/cm2紫外强度下照射10 min后筛选得到,在鉴别寄主TcLr1上的侵染型为“3”。
1.1.2供试小麦品种小麦品种为郑州5389,由河北农业大学小麦叶锈病研究室保存。
1.1.3试验时间与地点试验于2015年11月至2016年5月,在河北农业大学植物保护学院分子植物病理学与生物防治实验室完成。
1.2 试验方法
1.2.1诱变剂量及方法取10 mg新鲜的小麦叶锈病病菌夏孢子,置于直径为9 cm的培养皿中,保湿水化12 h后,在 1 600 μW/cm2紫外强度下,分别照射10、20、30 min,以未照射处理作为对照,照射后用毛笔收集夏孢子,均匀抖落在1%的水琼脂培养基(10 g琼脂粉+1 L蒸馏水)平板上,加盖后放在20 ℃黑暗环境中,6 h后显微镜下检查夏孢子的萌发情况。每个处理随机检查300个孢子,以夏孢子芽管长度超过夏孢子直径一半作为萌发的记载标准[16],每个处理重复3次。计算孢子萌发率和相对萌发率,孢子萌发率=萌发孢子数/检查孢子总数×100%,相对萌发率=处理组孢子萌发率/对照组孢子萌发率×100%。根据前人对最适诱变剂量的研究,原始菌株的夏孢子经紫外线照射后,致死率为90%左右时确定为最适诱变剂量。
1.2.2诱变菌株和原始菌株流行学研究将10 mg诱变菌株和原始菌株的夏孢子分别水化后,在1 600 μW/cm2紫外强度下分别照射0、10、20、30 min,将处理后的新鲜夏孢子收集于装有10 mL 稀释1 000倍的吐温-20水溶液的小喷壶中,均匀喷洒于郑州5389小麦幼苗叶片上,叶片旁边放置载玻片,以观察记录单位面积喷洒小麦叶锈病病菌的夏孢子数。16~20 ℃黑暗保湿14~16 h后,移入16~20 ℃的温室内培养。观察并记录流行学指标[潜育期、侵染效率、病斑扩展率、产孢量、病情发展曲线下面积(area under the disease-progress curve,简称AUDPC)等]。试验设置3次重复。
1.2.2.1潜育期的标准将夏孢子接种于叶片至叶片上第1个夏孢子堆突破表皮时的时间为潜育期,在叶片出现褪绿斑后,每天观察叶片病斑的变化,记录第1个夏孢子堆突破表皮的时间。
1.2.2.2侵染效率的计算显微观察记录载玻片上单位面积喷洒的夏孢子数量,作为喷洒于叶片上的单位面积的夏孢子数量。用毫米尺测量叶片的长度和最宽处的宽度,计算叶片面积。当叶片上出现侵染点后,统计叶片上侵染点的数量,并计算侵染效率。叶片面积=叶片长×叶片宽×0.8;侵染效率=叶片上侵染点数量/(单位面积接种夏孢子的数量×叶片面积)。
1.2.2.3病斑扩展率计算在接种夏孢子的叶片刚刚出现孢子堆时,选择只有单个孢子堆的叶片,用电子游标卡尺测量孢子堆的长、宽,并记录,计算病斑面积,每2 d测1次,直到孢子堆不再扩展为止。
病斑扩展率=(第2天病斑面积-第1天病斑面积)/第1天病斑面积。
1.2.2.4产孢量待叶片上的孢子堆突破表皮后,每2 d收集1次夏孢子,直至不再产生新的夏孢子,将收集的夏孢子悬浮于10 mL无菌水中,用血球计数板统计每个处理的产孢量。

2 结果与分析
2.1 紫外线对小麦叶锈病病菌夏孢子萌发率的影响
由表1可知,在同一紫外线强度下,随着紫外线照射时间的延长,2种菌株的相对萌发率均在逐渐降低。处理时间为 0 min 时,菌株12-5-1384-1夏孢子的萌发率为96.98%,而诱变菌株1384-10-B-1夏孢子的萌发率仅为72.94%;当处理时间为10 min时,菌株12-5-1384-1夏孢子的萌发率低于诱变菌株1384-10-B-1夏孢子的萌发率,说明原始菌株对紫外线较敏感。随着处理时间的延长,2种菌株的相对萌发率逐渐接近,说明随着照射时间的延长,突变菌株的抗紫外线能力逐渐降低。
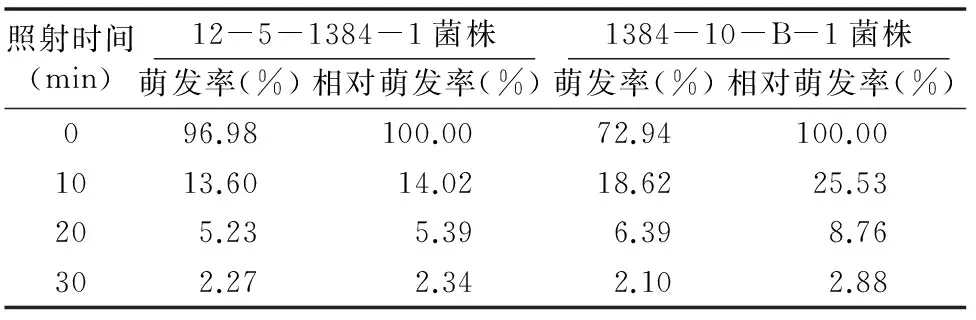
表1 紫外线对小麦叶锈病病菌夏孢子萌发率的影响
2.2 紫外线对小麦叶锈病病菌流行学参数的影响
2.2.1紫外线对小麦叶锈病病菌潜育期的影响由图1可知,处理时间为0 min时,菌株12-5-1384-1的潜育期为 9 d,诱变菌株1384-10-B-1的潜育期为7 d,潜育期缩短 2 d;处理时间为10、20、30 min时,菌株12-5-1384-1的潜育期分别为10、10、11 d,每个处理中,诱变菌株1384-10-B-1的潜育期均缩短2 d。随着处理时间的延长,2种菌株的潜育期均延长,说明紫外线可以延长小麦叶锈病病菌的潜育期。

2.2.2紫外线对小麦叶锈病病菌侵染效率的影响由图2可知,处理时间为0 min时,菌株12-5-1384-1的侵染效率为30.33×10-5,诱变菌株1384-10-B-1的侵染效率为38.96×10-5,诱变菌株的侵染效率提高了28.45%。处理时间从0 min增加到10 min时,菌株12-5-1384-1的侵染效率降低了89.17%,诱变菌株1384-10-B-1的侵染效率降低了91.13%。随着处理时间的进一步增加,2种菌株的侵染效率均逐渐降低,对照组(处理0 min)与各处理组之间差异显著(P<0.05),各处理组之间差异不显著;处理时间相同时,诱变菌株的侵染效率总是高于原始菌株。
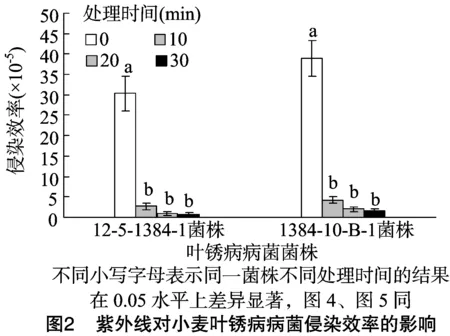
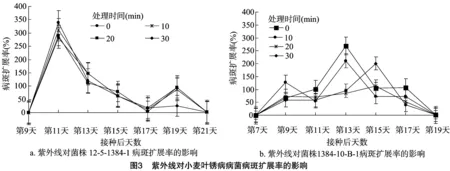
2.2.3紫外线对小麦叶锈病病菌病斑扩展率的影响由图3可知,菌株12-5-1384-1的病斑扩展率变化较规律,各处理之间的变化趋势一致,病斑扩展率均在接种后第11天达到最高,之后随着时间的增加,病斑扩展率逐渐降低,至第19天时又出现1个小高峰。菌株1384-10-B-1处理 0 min 组和10 min组的最大病斑扩展率均出现在接种后第13天,且在第17天时又出现1个小高峰;处理20 min组和 30 min 组,最大病斑扩展率均出现在第15天,后期没有出现小高峰。
2.2.4紫外照射对叶锈病病菌产孢量的影响由图4可知,处理时间为0 min时,菌株12-5-1384-1的产孢量为 116.39×104个,诱变菌株1384-10-B-1的产孢量为145.46×104个,诱变菌株的产孢量提高了24.98%。处理时间从0 min增加至10 min时,菌株12-5-1384-1和诱变菌株1384-10-B-1的产孢量分别降低了84.11%、83.83%;随着处理时间的进一步增加,2种菌株的产孢量均逐渐降低,对照组(处理0 min)与处理组之间差异显著(P<0.05),各处理组之间差异不显著;处理时间相同时,诱变菌株的产孢量总是高于原始菌株。
2.2.5紫外线对小麦叶锈病病菌AUDPC的影响由图5可知,随着接种后时间的延长,各处理的AUDPC均在增加,且对照组(处理0 min)显著高于各处理组(P<0.05)。就同一菌株而言,接种后相同时间内随着照射时间的延长,菌株的AUDPC逐渐降低。同一菌株接种后相同时间内对照组的AUDPC与各处理组之间差异显著(P<0.05),各处理组之间差异不显著。紫外线照射时间相同时,原始菌株12-5-1384-1的AUDPC总是低于诱变菌株1384-10-B-1的AUDPC。

3 结论与讨论
突变是促使病原菌发生遗传多样性变化的基本因素,因此在研究中,对菌株进行诱变,筛选突变体是研究致病机制和某些基因功能的基本方法[17-18]。紫外线导致DNA发生变异的根本在于入射光子的波长[19-23],紫外线诱导的DNA变异可以由紫外线B或紫外线A吸收,以及光敏作用直接触发[19,22,24],发生的变异是非定向的,正向的毒性突变是导致抗病品种丧失抗锈性的原因,而反向的非毒性变异在筛选过程中容易丢失。本研究采用紫外诱变的方法,以TcLr1为鉴别寄主,选择在TcLr1上侵染型为“;”的12-5-1384-1单孢菌株为原始菌株,经紫外线诱变后,筛选出侵染型变为“3”的菌株,进一步研究紫外线对其流行学参数的影响。
本研究的结果表明,紫外线照射会抑制叶锈病病菌夏孢子的萌发,2株叶锈病病菌对紫外线照射的容忍度是不同的,诱变菌株的容忍度大于原始菌株;在紫外线照射之后,菌株的侵染效率、病斑扩展率、产孢量和AUDPC均下降,潜育期增长,紫外线照射在某种程度上伤害了叶锈病病菌夏孢子,导致一部分夏孢子不能萌发、甚至死亡,但即便如此,仍有一些幸存的夏孢子能够萌发,曾有多名研究者报道过紫外线辐射可以延迟幸存真菌分生孢子的萌发[25-27];另外,真菌孢子自身的某些生理条件可能会帮助其抵抗紫外照射的损害并修复其带来的伤害[28],但这个过程需要时间,这可能是处理时间越长,潜育期越长的原因。这些结果表明,诱变菌株和原始菌株相比,原始菌株对紫外线照射更加敏感,在同样的紫外线照射条件下,突变菌株更具生存优势。在此研究中突变菌株被命名为诱变菌株1384-10-B-1,自然界中该生理小种的毒性高于单孢菌株12-5-1384-1这一生理小种,近几年诱变菌株1384-10-B-1出现的比例高于单孢菌株12-5-1384-1,可能是因为诱变菌株1384-10-B-1比单孢菌株12-5-1384-1更适合现在的生存环境。因此,可以初步认为紫外线可能是造成叶锈病病菌生理小种不断进化的一个重要因素,但还须做进一步的研究。
参考文献:
[1]Kolmer J A. Genetics of resistance to wheat leaf rust[J]. Annual Review of Phytopathology,1996,34:435-455.
[2]董金皋. 农业植物病理学[M]. 2版.北京:中国农业出版社,2007:57-61.
[3]商鸿生,井金学,李振岐. 紫外线诱导小麦条锈菌毒性突变的研究[J]. 植物病理学报,1994,24(4):347-351.
[4]黄丽丽,王欣丽,康振生,等. 紫外线诱导小麦条锈菌毒性突变及突变体的RAPD分析[J]. 菌物学报,2005,24(3):400-406.
[5]王欣丽,朱飞,黄丽丽,等. 紫外线诱变对小麦条锈菌致病性突变的影响[J]. 核农学报,2009,23(3):375-379.
[6]Rotem J,Wooding B,Aylor D E. The role of solar radiation,especially ultraviolet,in the mortality of fungal spores[J]. Phytopathology,1985,75(5):510-514.
[7]Raviv M,Antignus Y. UV radiation effects on pathogens and insect pests of greenhouse-grown crops[J]. Photochemistry and Photobiology,2004,79(3):219-226.
[8]Manning W J,Tiedemann A V. Climate change:potential effects of increased atmospheric carbon dioxide(CO2),ozone(O3),and ultraviolet-B(UV-B)radiation on plant diseases[J]. Environmental Pollution,1995,88(2):219-245.
[9]Willocquet L,Colombet D,Rougier M,et al. Effects of radiation,especially ultraviolet B,on conidial germination and mycelial growth of grape powdery mildew[J]. European Journal of Plant Pathology,1996,102(5):441-449.
[10]吴杏春,林文雄,郭玉春,等. 植物对UV-B辐射增强响应的研究进展[J]. 中国生态农业学报,2001,9(3):52-55.
[11]Flor H H. Mutations in flax rust induced by ultraviolet radiation[J]. Science,1956,124(3227):888-889.
[12]Schwinghamer E A. The relation between radiation dose and the frequency of mutations for pathogenicity inMelampsoralini[J]. Phytopathology,1959,49:260-269.
[13]Maddison A C,Manners J G. Sunlight and viability of cereal rust uredospores[J]. Transactions of the British Mycological Society,1972,59(3):429-443.
[14]Johnson R,Priestley R H,Taylor E C. Occurrence of virulence inPucciniastriiformisfor Compair wheat in England[J]. Cereal Rusts Bulletin,1978,6:11-13.
[15]鹿巍. 紫外线及EMS方法诱导小麦叶锈菌毒性突变研究[D]. 保定:河北农业大学,2007.
[16]方中达. 植病研究方法[M]. 3版.北京:中国农业出版社,1998:146-155.
[17]郭宏文,王艳,江成英,等. 酸性α-淀粉酶菌种的诱变选育[J]. 江苏农业科学,2016,44(3):356-357.
[18]任友花,王羿超,李娜,等. 微生物肥料高效解磷菌筛选及解磷机理探究[J]. 江苏农业科学,2016,44(12):537-540.
[19]Kielbassa C,Roza L,Epe B. Wavelenght dependence of oxidative DNA damage induced by UV and visible light[J]. Carcinogenesis,1997,18(4):811-816.
[20]Douki T,Reynaud-Angelin A,Cadet J,et al. Bipyrimidine photoproducts rather than oxidative lesions are the main type of DNA damage involved in the genotoxic effect of solar UVA radiation[J]. Biochemistry,2003,42(30):9221-9226.
[21]Schuch A P,Galhardo R D,de Lima-Bessa K M,et al. Development of a DNA-dosimeter system for monitoring the effects of solar-ultraviolet radiation[J]. Photochemical & Photobiological Sciences,2009,8(1):111-120.
[22]Cadet J,Mouret S,Ravanat J L,et al. Photoinduced damage to cellular DNA:direct and photosensitized reactions[J]. Photochemistry and Photobiology,2012,88(5):1048-1065.
[23]Karentz D. Beyond xeroderma pigmentosum:DNA damage and repair in an ecological context. A tribute to James E. Cleaver[J]. Photochemistry and Photobiology,2015,91(2):460-474.
[24]Cadet J,Douki T,Ravanat J. Oxidatively generated damage to cellular DNA by UVB and UVA radiation[J]. Photochemistry and Photobiology,2015,91(1):140-155.
[25]Rasanayagam M S,Paul N D,Royle D J,et al. Variation in responses of spores ofSeptoriatritici,andS.nodorum,to UV-B irradiationinvitro[J]. Mycological Research,1995,99(11):1371-1377.
[26]Nascimento É,Silva S H D,Marques E D R,et al. Quantification of cyclobutane pyrimidine dimers induced by UVB radiation in conidia of the fungiAspergillusfumigatus,Aspergillusnidulans,MetarhiziumacridumandMetarhiziumrobertsii[J]. Photochemistry & Photobiology,2010,86(6):1259-1266.
[27]Costa L B,Rangel D E,Morandi M A. Impact of UV-B radiation onClonostachysroseagermination and growth[J]. World Journal of Microbiology and Biotechnology,2012,28(7):2497-2504.
[28]赵颖,祖艳群,李元. UV-B辐射增强对水稻稻瘟病菌(Magnaporthegrisea)生长和产孢的影响[J]. 农业环境科学学报,2010,29(增刊1):1-5.
