不同离子强度下SiO2胶体对磺胺嘧啶土壤吸附迁移行为的 影响*
2018-04-13邵珍珍徐绍辉
邵珍珍 林 青 徐绍辉
(青岛大学环境科学与工程学院,青岛 266071)
磺胺类药物有广泛的抗菌作用,据统计2 013年我国磺胺类抗生素年总用量为7 920 t,其中磺胺嘧啶(Sulfadiazine,SDZ)年用量为1 260 t[1]。然而,由于抗生素不能被生物体全部吸收利用,近70%的抗生素以母体的形式,随粪便与尿液排放到环境[2]。据估算在我国近46%的抗生素最终进入土壤[1],释放到土壤中的SDZ可以诱导土壤中微生物产生抗性基因[3],或者通过土壤运输[4]、地表径流[5]以及植物吸收[6]等方式最终进入食物链。由于磺胺类抗生素只含有苯胺基和酰胺基两个离子型官能团,在土壤中的吸附作用较弱,分配系数Kd值较低,容易迁移进入地下水[7],对饮用水源有极大的污染风险,因此研究磺胺类抗生素在土壤中吸附迁移行为具有重要意义。目前,对抗生素的研究主要集中于各种类型抗生素在不同类型土壤、不同理化因素影响下的吸附迁移行为等方面。
胶体普遍存在于土壤中,具有巨大的比表面积及双电层结构,能够对污染物产生更强的吸附作用。同时,胶体的稳定性容易受离子强度[8-9]、pH、有机质[10]等土壤理化性质的影响,进而影响共存污染物的运移方式[11]。目前,胶体对污染物迁移的研究主要集中于胶体对放射性元素[12-14]、重金属离子迁移行为的影响[15-16],并有少量关于有机胶体或纳米颗粒对有机污染物迁移行为影响的报道[17-18]。
施用禽畜粪便时,不仅会将抗生素带入土壤,同时一些阴阳离子也会进入土壤[19],其中比较显著的影响是局部离子强度的升高。离子强度能够影响土壤中胶体的稳定性,同时金属离子也会与抗生素发生阳离子键桥作用、螯合作用、竞争吸附作用等。目前,关于离子强度对土壤中胶体迁移行为、释放的研究较多,并且多数研究表明离子强度在很大程度上影响胶体的活性,因此离子强度是研究胶体、抗生素时优先考虑的因素。
由于关于胶体对抗生素吸附迁、移行为的研究报道较少,离子强度对两者有较大影响,研究不同离子强度下胶体对磺胺类抗生素在土壤中吸附迁移行为,有助于更全面地了解抗生素在土壤中的运移机制。本研究以中性硅 溶胶为供试外源胶体,以SDZ为目标污染物,选取棕壤土为吸附介质及土柱出流实验多孔介质,采用室内批平衡吸附实验和土柱出流实验,通过改变离子强度研究二氧化硅胶体对SDZ吸附迁移行为的影响,旨在探讨磺胺嘧啶在土壤中 吸附迁移行为的机理,进而指导磺胺类抗生素的风险评估及防治。
1 材料与方法
1.1 材料与仪器
供试土壤为青岛市移风店镇农田表层棕壤(0~20 cm),其理化性质见表1。其中,土壤有效硅是以0.025 mol L-1柠檬酸为提取剂,1∶10水土比,于30 ℃恒温箱中保温5 h,每隔1 h摇动1次,过滤上清液,用ICP测定Si含量[20]。

表1 土壤理化性质Table 1 Basic properties of the tested soil
SDZ购于Aladdin,纯度为98%,pKa1=1.57、pKa2=6.50、logKow=-0.09,其结构与不同形态的分布见图1。实验时,为防止SDZ的降解与光解,每次实验均新配制SDZ储备液,同时,由于实验周期短,微生物对SDZ的降解影响可忽略,实验过程均未做抑菌处理[21]。
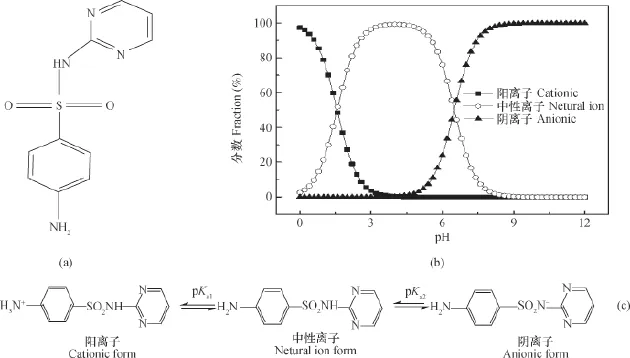
图1 SDZ的结构(a)、其在不同pH下的形态图(b)[22]和离子化公式(c)[23]Fig. 1 Chemical structure (a), morphostructure relative to pH (b) and ionization formula (c) of sulfadiazine
二氧化硅胶体购于广州市富尔化工有限公司,是工业中性硅溶胶WL2-1530,为高分子二氧化硅(mSiO2·nH2O)微粒分散于水中 的胶体,具有亲水性表面,对极性分子的吸附量大,其指标见表2。Si标准溶液购买于济南泉东标准物质研究所,石英砂、氢氧化钠、硝酸、无水氯化钙均为分析纯,实验用水均为二次蒸馏水,双圈定性滤纸(中速),脱脂棉。

表2 中性硅溶胶理化性质Table 2 Basic properties of the neutral silica sol
本次研究中用到的主要实验仪器有:FR224CN型电子天平,奥豪斯仪器(上海)有限公司;UV9100C PC型紫外可见分光光度计,北京莱博泰克仪器有限公司;HS-3C型pH计、;ORP电极、雷磁DDB-303A电导率仪,上海精科仪器有限公司;Optima 8000型ICP,PerkinElmer公司;有机玻璃土柱,高20 cm,内径为4.5 cm;BT100-1F型蠕动泵,保定兰格恒流泵有限公司;BSZ-100型部分收 集器,上海沪西分析仪器厂;TDL-4A离心机,上海菲恰尔分析仪器有限公司。
1.2 等温吸附实验
先准确称取1 g土于圆底塑料离心管中,分别配制以CaCl2(离子强度分别为0.001、 0.003、0.005、0.010 mol L-1)为背景溶液的加胶体/不加胶体的SDZ溶液,并调节pH在6.38±0.03,其中SDZ的浓度为0、10、20、30、40、50 mg L-1,加胶体时胶体浓度为112.0±3.0 mg L-1,以20∶1的水土比将配制好的溶液加入土壤中,加盖后放入气浴恒温振荡器于25±0.5 ℃下恒温震荡24 h,取出后于4 000 r min-1的离心机中离心5 min过滤得上清液,由紫外分光光度计于254 nm波长下测定上清液的SDZ浓度[21-24],检出限为0.142 μg mL-1,RSD为0.0150%~0.108%,加标回收率为82.730%~112.960%。以上实验均设置3个重复。
SDZ 在土壤中的吸附量Se由式(1)计算,SDZ在土壤中的 分配系数Kd由式(2)计算。采用Freundlich、Linear和Langmuir模型对本实验结果进行模拟,公式及模型如下:
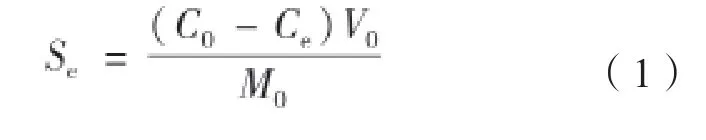

式中,Se为吸附平衡时土壤对SDZ的吸附量(mg kg-1),C0为加入到土壤中SDZ的浓度(mg L-1),Ce为吸附平衡时上清液中SDZ含量(mg L-1),V0为加入到土壤中的液体体积(L),m0为用于吸附的土壤质量(kg)。KD为线性分配系数,KF为Freundlich吸附系数,代表吸附容量,与吸附能力有关,其值越大,则吸附速率越快;1/n为吸附经验参数。
1.3 土柱迁移实验
土柱填装时,取415 g预先风干、研磨、过2 mm筛的土壤,平均分5次填装,每次按设定容重,压实至固定高度(3.4 cm每层),尽可能减少不均;为了减小边缘效应,防止土壤颗粒堵塞进出水口,在土柱的上端与下端各添加1.5 cm厚的石英砂,进出水口处加脱脂棉,同时脱脂棉与石英砂间加一层定性滤纸,使液体均匀流入、流出土柱。
土柱迁移实验以1 L烧杯供水,调节蠕动泵转速为3.5 r min-1,由下而上,通20 h设定浓度的CaCl2背景溶液来饱和土柱,排尽土柱中的空气,经预实验,此时土壤中可溶解性硅酸盐含量较少且趋于稳定;然后调整入流方向,调节流速(5.03 cm h-1),待形成稳定流场后,以脉冲的方式,由土柱上端通入有/无胶体的SDZ溶液20 h,然后用背景溶液冲洗30 h结束实验。实验中,所有溶液的pH均为6.38±0.03,SDZ浓度均为30 mg L-1。离子强度分别设为0.001、0.003、0.005、0.010 mol L-1CaCl2,胶体浓度为116 mg L-1;出流液用自动部分收集器定时收集,测定出流液中SDZ、二氧化硅胶体浓度,并测定pH、电导率、氧化还原电位。实验设置2次重复。以无量纲的孔隙体积PV(Pore volume)表示时间。
2 结果与讨论
2.1 SDZ在土壤中的等温吸附
图2表示四种不同离子强度下,加/不加胶体时SDZ在土壤中的等温吸附曲线。由图可以看出,离子强度为0.001 mol L-1、0.003 mol L-1CaCl2时,胶体的加入抑制了SDZ在土壤中的吸附。而离子强度为0.005 mol L-1、0.010 mol L-1CaCl2时,胶体的加入对SDZ在土壤中吸附的影响与SDZ浓度有关。当离子强度为0.005 mol L-1、SDZ初始浓度<30 mg L-1时SDZ在土壤中的吸附作用被抑制,当离子强度为0.005 mol L-1CaCl2、SDZ初始浓度>30 mg L-1时能够促进SDZ在土壤中的吸附作用。当离子强度为0.010 mol L-1CaCl2、SDZ初始浓度为30 mg L-1或50 mg L-1时,均表现为抑制吸附。这可能是由 于溶液的pH为4.09~4.75,由图1可知,此时SDZ主要以中 性离子兼少量阴离子的形式存在。由于离子强度低时(0.001 mol L-1、0.003 mol L-1CaCl2)胶体的双电层未被压缩,胶体能自由分散,胶体的硅烷醇基团与SDZ(中性分子形态)的氨基通过氢键作用结合,因此,二者共同保留在溶液中。高离子强度(0.005 mol L-1、0.010 mol L-1CaCl2)时,一方面,胶体双电层被压缩而絮凝沉淀,沉淀的胶体能够吸附一部分SDZ,胶体与SDZ共同附着于土壤表面;另一方面,低pH条件下Ca2+能够与SDZ竞争吸附点位,Ca2+竞争作用的强度会随Ca2+浓度的增加先增强最后达到稳定。因此,两种作用力共同影响SDZ在土壤中的吸附,当Ca2+的竞争作用强时就表现出抑制了SDZ在土壤中的吸附。
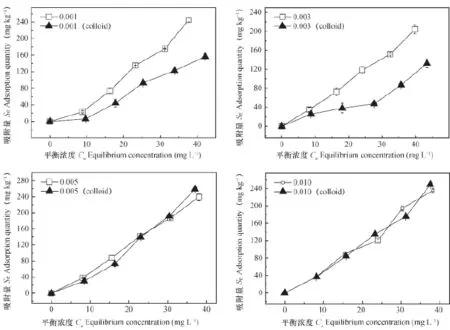
图2 不同离子强度下加/不加胶体时SDZ在土壤中的等温吸附曲线Fig. 2 Isotherm al adsorption curve of sulfadiazine in soil with/without addition of colloid relative to ion strength
表3为四种不同离子强度下,加/不加胶体时SDZ在土壤中的Kd(L kg-1)值,Kd值高表明SDZ在土壤中的吸 附能力强,低则相反。总体而言Kd值< 7,数值较低与大多数的研究结果一致[25-26],这主要是由SDZ的结构所决定,与其他抗生素相比SDZ含有的基团较少,因此其吸附能力弱,易于迁移,存在污染地下水的风险。
用Freundlich、Linear、Langmuir模型对不同离子强度下加/不加胶体时土壤对SDZ的吸附进行拟合,其中Langmuir模型不收敛,其他两个模型的拟合结果见表4。Freundlich模型拟合得到的1/n在1.117~1.884之间,KF在0.877~4.131之间,决定系数R2为0.958~0.997。Linear模型拟合得到的吸附系数KD在3.743~7.121之间,决定系数R2为0.902~0.996。通过决定系数R2来看,Freundlich模型拟合效果较好,并且,不加胶体时1/n在1.117~1.410之间,吸附为偏线性吸附,加入胶体后1/n在1.275~1.885,非线性吸附更显著。

表3 不同离子强度下加/不加胶体时SDZ在土壤中的Kd 值Tab le 3Kd value of sulfadiazine in soil relative to ion strength and addition of colloid (L kg-1)
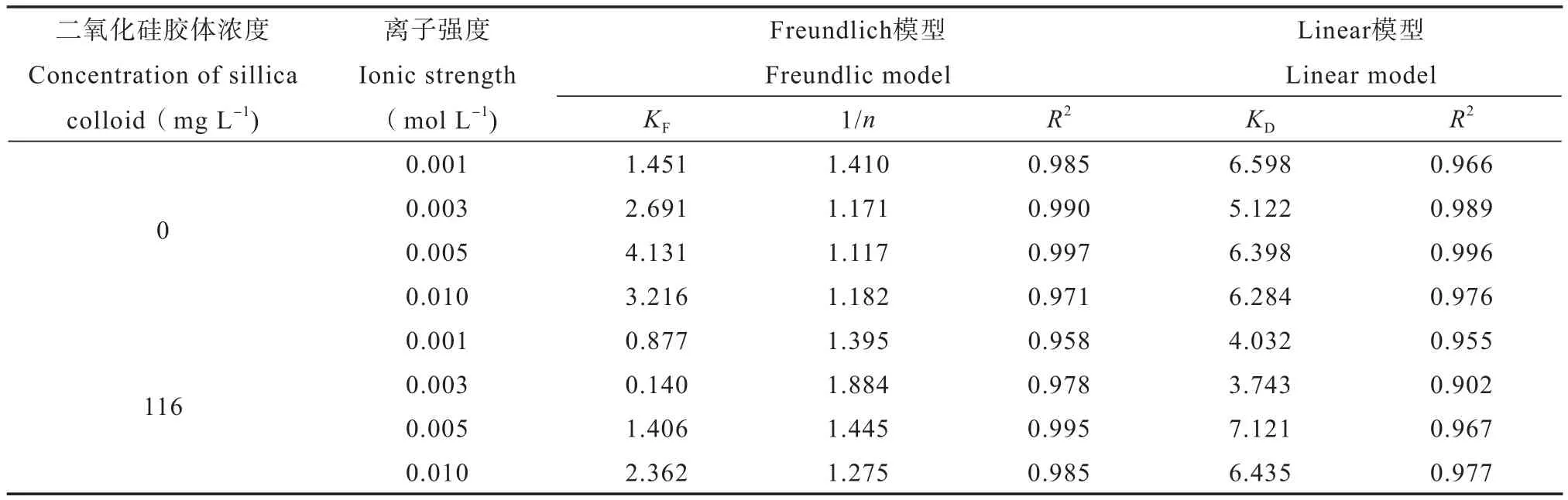
表4 吸附等温线模型拟合参数Table 4 Fitting parameters of the isotherms model
2.2 等温吸附溶液Ca、电导率、pH 变化特点
图3为四种不同离子强度下加/不加胶体时平衡溶液中Ca、电导率(EC)、pH 的变化曲线。由图3a可以看出Ca的浓度变化总体情况为随离子强度升高溶液中Ca的浓度升高。当离子强度为0.001 mol L-1CaCl2时,加胶体条件下溶液中Ca浓度较高,离子强度为0.010 mol L-1CaCl2表现为未加胶体条件下溶液中Ca浓度高于加胶体条件下。这主要是由于Ca以Ca2+的形式存在带正电荷,二氧化硅胶体带负电荷,相比于土壤,Ca2+更倾向亲和胶体。当离子强度低时不足以使胶体的双电层压缩,胶体能够自由移动,此时,胶体与Ca2+共同存于溶液中,因此溶液中Ca含量高于不加胶体时。而高离子强度时,Ca2+压缩胶体双电层并与胶体共同沉淀至土壤表面,因此溶液中Ca含量低于不加胶体时。由图3b看出EC的变化情况与CaCl2的加入情况一致,离子强度越高电导率越高,胶体的加入影响不明显,CaCl2是该溶液中EC的主要贡献者;由图3c看出pH的变化规律不明显,这与土壤对pH的缓冲能力有很大关系。

图3 平衡溶液中Ca (a)、电导率EC(b)、pH(c) 变化曲线Fig. 3 Breakthrough curves of Ca (a)、EC(b) and pH(c)in equilibrium solution
2.3 不同离子强度下二氧化硅胶体对SDZ运移的影响
图4是未添加外源胶体时,四种不同离子强度情况下,SDZ在土壤中的穿透曲线。总体而言,各穿透曲线均出现“拖尾”现象,说明存在非平衡吸附。当离子强度为0.010 mol L-1CaCl2时,SDZ出流较早,出流液达到相对浓度峰值所需的时间少于较低离子强度时,相对浓度峰值达0.91,且持续时间最长,说明高离子强度促进了SDZ在土壤中的迁移。这是由于高离子强度时,CaCl2以(CaCl)+的形态附着于黏土矿物表面,与SDZ竞争吸附点位,这一现象与Ca2+影响诺氟沙星在土壤中的吸附相似[19]。当离子强度低于0.005 mol L-1时,离子强度的减小对SDZ的影响不明显,说明此时SDZ在土壤中的吸附作用强于CaCl2。拖尾现象表明,一旦吸附,SDZ在土壤中的解吸就相对缓慢。这与有关学者研究的SDZ以及大多数有机污染物在土壤或底泥上的吸附解吸结果一致,解吸量往往小于吸附量[27]。研究表明离子形态制约了抗生素在土壤中的吸附能力[28],SDZ的离子形态与吸附能力的关系为:阳离子形态 (pH<pKa1) >中性离子形态(pKa1<pH<PKa2) >阴离子形态(pH>pKa2)[29]。由于实验中土壤pH为4.42,在洗脱阶段溶液pH范围是4.11~4.80,此时SDZ主要以中性兼少量阴性分子的形态存在,中性离子形态的SDZ通过疏水作用吸附于土壤有机质,阴性离子形态的SDZ通过桥键作用吸附于土壤以及与Ca2+结合沉淀到土壤表面,因此会有部分抗生素不能被洗脱。
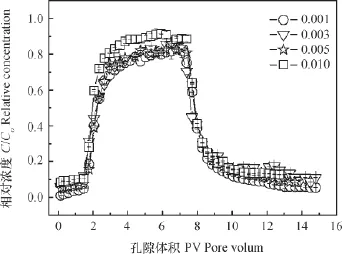
图4 不同离子强度下SDZ的穿透曲线Fig. 4 Breakthrough curves of sulfadiazine relative to ion strength
图5为不同离子强度条件下,加胶体与不加胶体时SDZ穿透曲线。可以看出当离子强度为0.001 mol L-1CaCl2时,胶体的存在会促进SDZ的迁移,S DZ出流早、相对浓度峰值变高、更难洗脱。这是由于低离子强度下,胶体双电层未被压缩,胶体的硅烷醇基团与SDZ的氨基结合后两者共同运移,并且土壤与胶体的表面 均带有负电荷,两者相互排斥,因而促进SDZ在土壤中的迁移。 而离子强度增加至0.010 mol L-1CaCl2时,胶体的加入会抑制SDZ的迁移,出流液中SDZ相对浓度峰值降低且更难洗脱。这可能是由于高离子强度下,胶体双电层被压缩并絮凝,絮凝的胶体携带其结合的SDZ一起沉降附着于土壤颗粒表面,因而迁移量表现出减少的趋势,这与卡马西平在石英砂上的吸附机理相似[18]。
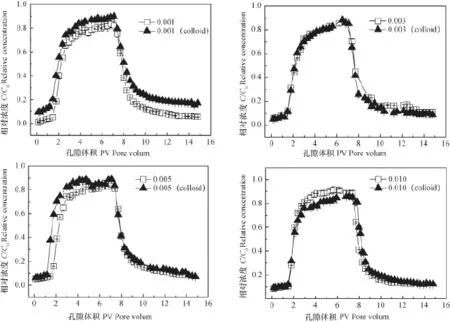
图5 不同离子强度下加/不加胶体时S DZ的穿透曲线Fig. 5 Breakthrough curves of sulfadiazine with/without colloids relative to ion strength
2.4 出流液中二氧化硅胶体、Ca、氧化还原电位、pH、电导率变化特点
图6a为四种不同离子强 度下二氧化硅胶体的变化曲线,空白实验结果表明不加胶体时淋洗出的二氧化硅胶体的量极小,因此可以排除土壤本身胶体的影响。从图中可以看出,加入胶体后,二氧化硅胶体浓度随离子强度的增加而降低。低离子强度下二氧化硅胶体出流较早,浓度峰值高,峰值持续时间,而高的离子强度抑制了二氧化硅胶体的出流。0.001 mol L-1CaCl2时,二氧化硅胶体于1.18 PV开始出流,浓度峰值达到138.0 mg L-1,峰值持续时间达8.58 PV。0.003 mol L-1CaCl2时出流时间推移至6.51 PV,浓度峰值降低至60.21 mg L-1,峰值持续时间急 剧 缩短。当离子强度增加至0.005、0.010 mol L-1CaCl2时,绝大部分二氧化硅胶体滞留于土壤中,只有极少量流出,相比于不加胶体二氧化硅胶体的检出量相差无几。这与刘庆玲等[30]研究的二氧化硅胶体在多孔介质中吸附迁移的结果一致,随离子强度的增大,胶体出流难度增加。吕俊佳[31]研究了土壤 胶体及菲在石英砂中的运移时,发现当CaCl2浓度为0.5、 0.1 mm ol L-1时,红壤胶体全部截留在多孔介质。这是由于胶体的吸附能力 很大程度依赖于它的带电性质,在实验条件下,二氧化硅胶体带有负电荷,随着Ca浓度的增高,Ca2+会与二氧化硅胶体的硅羟基结合,在二氧化硅胶体表面形成复合物,减少负电荷并且压缩胶体的双电层,因而随着 离子强度的增加,二氧化硅胶体出流量减少,出流时间延后。

图6 不同离子强度下SiO2胶体(a)、Ca (b)、氧化还原电位ORP(c)、pH(d)和电导率EC(e)在加/不加胶体时的穿透曲线Fig. 6 Breakthrough curves of SiO2 colloid(a)、Ca (b)、ORP(b)、pH(d) and EC(e) with/ without colloid relative to ionic strength
图6b为出流液中Ca浓度变化特点,低离子强度时,Ca浓度先降低最终持平,高离子强度时,先降低后增高。这是由于低离子强度时,土壤对Ca的吸附点位比较丰富,仍有空余吸附点位;而高离子强度不加胶体时,前期Ca2+与土壤进行阳离子交 换作用,含量下降趋势明显,后期吸附点位已被完全占据,而CaCl2以不变的浓度持续通入土柱,因此Ca含量表现出增加至一定量后保持平缓的趋势。其中,当离子强度为0.010 mo l L-1CaCl2时,Ca在加胶体时含量明显低于不加胶体时,这是由Ca2+参与了胶体的絮凝导致。
图6c为四种不同离子强度下,加/不加胶体出流液ORP变化曲线,总体而言,氧化还原电位都集中于230~320 mV之间无规律波动,属于氧化条件,主要以氧化反应为主。
图6d为不同离子强度下,加/不加胶体时出流液pH变化曲线,除 0.005 mol L-1CaCl2时,加/不加胶时pH发生较大差异外,其他差异不明显。pH总体上呈降低的趋 势,且离子强度越低pH降低的时间越晚,最后稳定的pH越高。这主要是由于 土壤通过阳离子交换作用吸附Ca2+,释放出H+,使pH降低。低离子强度时,Ca2+含量较低,因此置 换出的H+少,pH最终稳定的值高,高离子强度时置换出的H+多,因此pH最终稳定值较低。
图6e为不同离子强度下,加/不加胶体时出流液EC变化曲线,由图可以看出离子强度越高电导率越高,CaCl2是电导率的主要贡献者,其次胶体的加入也会在一定程度度上影响电导率。
3 结 论
Freundlich模型能较好地拟合SDZ在土壤中的吸附情况。相比于不加二氧化 硅胶体,胶体加入后,低离子强度时抑制SDZ在土壤中的吸附,随离子强度增加SDZ在土壤中的吸附能力受SDZ初始浓度影响。SDZ在土柱中的迁移能力受 离子强度与胶体影响,未加外源胶体时,由于Ca2+与SDZ竞争土壤的吸附点位,离子强度的增加促进了SDZ在土柱中的迁移。而加入胶体后,低离子强度下土壤排斥携带有SDZ的胶体,抑制了SDZ在土壤中的吸附促进了其在土柱中的迁移,随着离子强度的增加,Ca2+对胶体双电层的压缩作用逐渐增强,导致胶体絮凝沉淀,抑制了 SDZ在土柱中的迁移。
[ 1 ] Z h a n g Q Q,Yi n g G G,P a n C G,e t a l.Comprehensive evaluation of antibiotics emission and fate in the river basins of china:Source analysis,multimedia modeling,and linkage to bacterial resistance. Environmental Science & Technology,2015,49(11):6772—6782
[ 2 ] Kummerer K. Antibiotics in the aquatic environment—A review—Part I. Chemosphere,2009,75(4):417—434
[ 3 ] 罗义,周启星. 抗生素抗性基因(ARGs)一种新型环 境污染物. 环境科学学报,2008,28(8):1499—1505 Luo Y,Zhou Q X. Antibiotic resistance genes(ARGs)as emerging pollutants(In Chinese). Acta Scientiae Circumstantiae,2008,28(8):14 99—1505
[ 4 ] Ha mscher G,Pawelzick H T,Hoper H,et al.Different behavior of tetracyclines and sulfonamides in sandy soils after repeated fertilization with liquid manure. Environmental Toxicology and Chemistry,2005,24(4):861—868
[ 5 ] Davis J G,Truman C C,Kim S C,et al. Antibiotic transport via runoff and soil loss. Journal of Environmental Quality,2006,35(6):2250—2260
[ 6 ] Dolliver H,Kumar K,Gupta S. Sulfamethazine uptake by plants from manure—amended soil. Journal of Environmental Quality,2007,36(4):1224—1230
[ 7 ] 齐会勉,吕亮,乔显亮. 抗生素在土壤中的吸附行为研究进展. 土壤,2009,41(5):703—708 Qi H M,Lü L,Qiao X L. Progress in sorption of antibiotics to soils(In Chinese). Soils,2009,41(5):703—708
[ 8 ] Bradford S A,Kim H. Implications of cation exchange on clay release and colloid—facilitated transport in porous media. Journal of Envi ronment Qual ity,2010,39(6):2040—2045
[ 9 ] Kim I,Taghavy A,DiCa rlo D,et al. Aggregation of silica nanoparticles and its impact on particle mobility under high—salinity conditions. Journal of Petroleum Science and Engineering,2015,133:376—383
[10] Cheng T,Saiers J E. Effects of dissolved organic ma tter on the co—transport of mineral colloids and sorptive contaminants. Journal of Contaminant Hydrology,2015,177/178:148—157
[11] 刘 庆玲,徐绍辉. 地下环境中胶体促使下的污染物运移研究进展. 土壤,2005,37(2):129—135 Liu Q L, Xu S H. Colloid—facilitaed transport of contaminants in subsurface environment(In Chinese). Soils,2005,37(2):129—135
[12] Basu H,Singhal R K,Pimple M V,et al.Association and migration of uranium and thorium with silica colloidal particles in saturated subsurface zone.Journal of Radioanalytical and Nuclear Chemistry,2014,303:2283—2290
[13] Crancon P,Pili E,Charlet L. Uranium facilitated transport by water—dispersible colloids in field and soil columns. Science of Total Environment,2010,408(9):2118—2128
[14] Solovitch—Vella N,Garnier J M, Ciffroy P. Influence of the colloid type on the transfer of 60Co and 85Sr in silica sand column under varying physicochemical conditions. Chemosphere,2006,65(2):324—331
[15] Tran E,Klein Ben—David O,Teutch N,et al.Influence of heteroaggregation processes be tween intrinsic colloids and carrier colloids on cerium(Ⅲ)mobility through fractured carbonate rocks. Water Research,2016,100:88—97
[16] Wikiniyadhanee R,Chotpantarat S,Ong S K. Effects of kaolinite colloids on Cd2+transport through saturated sand under varying ionic strength conditions:Column experiments and modeling approaches. Journa l of Contaminant Hydrology l,2015,182:146—156
[17] Zhang M,Engelhardt I,Simunek J,et al. Co—transport of chlordecone and sulfadiazine in the presence of functionalized multi—walled carbon nanotubes in soils. Environmenta l Pollution,2017,221:470—479
[18] 张思,何江涛,朱晓婧. 有机质胶体对卡马西平在多孔介质中迁移影响模拟实验. 环境科学,2016,37(12):4651—4661 Zhang S,He J T,Zhu X J. Simulation exp eriment:Effect of organic colloid on carbarmazepine transport in porous media. Environmental Science,2016,37(12):4651—4661
[19] 张劲强,董元华. 阳离子强度和 阳离子类型对诺氟沙星土壤吸附的影响. 环境科学,2007,28(10):2383—2388 Zhang J Q,Dong Y H. Inuence of strength and species of cation on adsorption of norfloxacinin in typical soils of China. Environmental Science,2007,28(10):2383—2388
[20] 鲁如坤. 土壤农业化学分析方法. 北京:中国农业科学技术出版社,1999 Lu R K. Analytical methods for soil and agro—chemistry(In Chinese). Beijing:China Agricultural Science and Technolo gy Press,1999
[21] 文春波. 磺胺嘧啶在土壤中的迁移和降解研究. 郑州:郑州大学,2007 Wen C B. Migration and degradation of sulfadiazine in soil(In Chinese). Zhengzhou: Zhengzhou University,2007
[22] Teixidó M,Pignatello J J,Beltrán J L,et al.Speciation of the ionizable antibiotic sulfamethazine on black carbon(biochar). Environmental Science &Technology,2011,45(23):10020—10027
[23] Sukul P,Lamshöft M,Zühlk e S,et al. Sorption and desorption of sulfadiazine in soil and soil—manure systems. Chemosphere,2008,73(8):1344—1350
[24] 尚尔宁,沈惠明,樊祥堃. 分光光度法测定磺咳合剂中磺胺嘧啶的含量. 抗感染药学,2004,1(2):84—85 Shang E N,Shen H M,Fan X K. Dete rmination of sulfadiazine content in sulfadiazine anticough mixture by spectrophotometry(In Chinese). Anti—Infection Pharmacy,2004,1(2):84—85
[25] Boxall A B A,Blackwell P,Cavallo R,et al. The sorption and transport of a s ulphonamide antibiotic in soil systems. Toxicology Letters,2002,131(1/2):19—28
[26] Thielebruhn S,Seibicke T,Schulten H R,et al.Sorption of sulfonamide pharmaceutical an tibiotics on whole soils and particle—size fractions. Journal Environmental Quality,2004,33(4):1331—1342
[28] 张劲强,董元华. 诺氟沙星的土壤吸附热力学与动力学研究. 土壤学报,2008,45(5):978—986 Zhang J Q,Dong Y H. Therm odynamics and kinetics of norfloxacin adsorption in typical soils of China(In Chinese). Acta Pedologica Sinica,2008,45(5):978—986
[29] Gao J,Pedersen J A. Adsorption of sulfonamide antimicrobial agents to clay minerals. Environmental Science & Technology,2005,39(24):9509—9516
[30] 刘庆玲,徐绍辉,刘建立. 饱和多孔介质中高岭石胶体和SiO2胶体运移行为比较. 土壤学报,2008,45(3):445—451 Liu Q L,Xu S H,Liu J L.Comparison between kolinite and SiO2colloid in transport behavior in saturated porous media(In Chinese). Acta Pedologica Sinica,2008,45(3):445—451
[31] 吕俊佳. 土壤胶体及菲在饱和多孔介质中运移作用研究. 辽宁:辽宁工程技术大学,2012 Lü J J. Study on soil colloid and phenanthrene transportation through saturated porous media(In Chinese). Liaoning:Liaoning Technical University,2012
