镁合金轮毂螺栓连接的电偶腐蚀行为
2018-04-11,,,
,,,
(1. 燕山大学 车辆与能源学院,秦皇岛 066004; 2. 中信戴卡股份有限公司,秦皇岛 066011)
环境污染和能源短缺促使日益发达的汽车工业大力推进构件轻量化,镁合金是最轻的结构材料之一,构件采用镁合金制造可以在减重的同时不降低结构强度,受到汽车工业的青睐。轮毂作为汽车的主要组成部件,其轻量化是汽车节能减排的有效途径。镁合金具有高的比强度和比刚度,减震性能优异,降噪效果良好,而且具有优异的铸造性能,这些优点使得镁合金在轮毂轻量化方面具有广阔的应用前景[1]。但是,镁合金具有非常活泼的化学和电化学特性,而且在实际应用中不可避免与铝、钢、铜等常用金属接触,镁合金会发生严重的电偶腐蚀,加速零部件的腐蚀破坏,这成为镁合金零部件应用于汽车工业的一个主要障碍[2-3],汽车轮毂服役环境比较恶劣,这使得其电偶腐蚀的问题更加凸显。
有限差分法、有限元法和边界元法等数值仿真方法在电偶腐蚀仿真研究中的应用越来越广泛,研究发现,边界元数值仿真在电偶腐蚀电流密度的预测上应用前景较好[4-5]。JIA等[6]通过试验和边界元数值仿真的方法研究了几何因素对AZ91D镁合金和钢发生电偶腐蚀的影响; THÉBAULTA等[7]验证了数值仿真研究电偶腐蚀过程的有效性; DESHPANDE[8]应用边界元方法研究了铝合金垫片对镁合金和碳钢电偶对电偶腐蚀的影响;刘贵昌等[9]评估了应用分段非线性边界模型预测阴极保护和电偶腐蚀的可行性;高福勇等[10]应用数值方法模拟研究了镁合金在NaCI溶液中的微区电偶腐蚀行为,并通过试验验证了此方法可以对镁合金的电化学腐蚀行为进行较好的预测和判断。
本工作针对镁合金轮毂与其钢质紧固螺栓接触发生电偶腐蚀这一问题,应用数值仿真的方法研究了螺栓沉孔几何因素对电偶腐蚀的影响,并通过全浸试验后电偶腐蚀区域与数值模型仿真预测电偶防腐蚀区域对比验证了采用边界元模型仿真来预测构件电偶腐蚀区域的有效性,以期为后续镁合金轮毂-螺栓连接的电偶腐蚀行为研究提供参考。
1 镁合金轮毂-螺栓连接电偶腐蚀仿真模型
1.1 物理模型
图1为镁合金轮毂-螺栓连接的三维简化模型示意图。由图1可见:当轮毂的螺栓沉孔中积存电解质时,由于镁合金和钢质紧固螺栓直接接触,而且通过电解质环境构成回路,会形成腐蚀原电池,造成镁合金轮毂腐蚀加速。

图1 轮毂-螺栓连接的模型Fig. 1 Model of hub-bolt joint
选用3.5%(质量分数,下同)NaCl溶液作为电解质溶液,为了进一步简化模拟,采用理想的二维轴对称模型代替三维模型,简化方法如图2所示,选取abcd区域为研究对象,阴极边界简化为螺栓头部在垂直方向的投影线段,dc段长度为螺栓沉孔深度H,bc段长度为螺栓沉孔半径R。二维轴对称模型网格划分图如图3所示,对电解质区域进行网格划分,由于阳极腐蚀时发生电化学溶解,为了准确模拟阳极腐蚀深度,在边界处采用较密的网格划分。

图2 三维模型简化方法示意图Fig. 2 Schematic of the 3-D numerical model

图3 二维轴对称模型网格划分图Fig. 3 Mesh for the 2-D numerical model
1.2 数学模型
为了使所建立的模型能够准确模拟腐蚀行为以及研究主要几何因素对电偶腐蚀的影响,在DESHPANDE[11]的研究基础上建立数学模型,模拟AE44镁合金轮毂与MS钢质紧固螺栓连接在3.5% NaCl溶液中的电偶腐蚀行为。
1.2.1 控制方程
本模型电解液中物质i的传递可用Nernst-Plank方程描述:
(ciφ)+·ciV
(1)
式中:ci为i离子的浓度(mol/m3);Ni为i离子的通量(mol·m-2·s-1);Di为i离子的扩散系数(m2/s);zi为i离子的电荷数;F为法拉第常数(C/mol);μi为i离子的淌度(m2·s-1·V-1);φ为电解质电位(V);V为对流速率(m/s)。本文中考虑以下假设:
(1) 电解质溶液充分搅拌,离子浓度是均匀的;
(2) 电解质溶液不可压缩,密度变化可以忽略,不考虑对流对离子传质的影响;
(3) 电解质为电中性的。
基于以上假设,式(1)可简化为
2φ=0
(2)
即采用Laplace方程作为电位分布的描述方程。
1.2.2 边界条件
求解电偶腐蚀过程模型时,电极表面的边界条件为求解腐蚀速率的关键,要求通过数值方法描述电极材料工作时电流密度与电位之间的极化关系作为电极表面的边界条件。采用Tafel方程描述这一关系,AE44镁合金和MS低碳钢的极化曲线参考DESHPANDE[12]的测量结果,极化动力学参数列于表1。
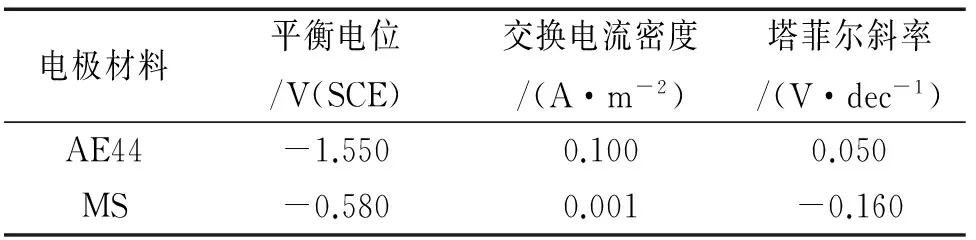
表1 Tafel曲线的拟合参数Tab. 1 Fitting parameters of Tafel curves
阳极表面的边界条件为
-σnφ=fa(φ)
(3)
式中:σ为电解质溶液电导率(S/m);fa(φ)为阳极电流密度(A/m2),通过阳极Tafel公式描述。
同理,阴极表面的边界条件为
-σnφ=fc(φ)
(4)
其他边界应用绝缘边界条件为
nφ=0
(5)
根据以上边界条件求解Laplace方程(2),求得电极表面各节点处的电位和电流密度分布。本文运用COMSOL MultiPhysics中的任意拉格朗日欧拉(ALE)方法求解移动边界问题,通过求解方程(6)和(7)获得网格位移。
(6)

(7)

(8)

本文假设阴极不发生腐蚀,即阴极边界的移动速度为零。
2 仿真结果与讨论
利用二维轴对称模型模拟研究室温下AE44镁合金-MS低碳钢电偶对在3.5% NaCl溶液中浸泡72 h,镁合金表面腐蚀深度随时间的变化如图4所示。其中,阴极边界宽度为10 mm,沉孔半径(R)为20 mm,螺栓沉孔深度(H)为5 mm。

图4 电偶对在3.5% NaCl溶液中浸泡不同时间后,镁合金腐蚀深度随时间的变化曲线Fig. 4 Corrosion depth of magnesium alloy vs. time curves after galvanic coupling being immersed in 3.5% NaCl solution for different times
浸泡72 h后,镁合金表面距偶接位置越近,蚀坑越深,在阴阳极接触区域附近出现一圈很深的腐蚀坑,蚀坑深度大于1 mm,随着与接触位置距离增加,腐蚀速率变缓。在电偶腐蚀初期,腐蚀会迅速沿横向扩散,随着电偶腐蚀的进行,腐蚀主要沿垂直方向扩展,形成腐蚀坑。
2.1 螺栓沉孔深度对电偶腐蚀的影响
螺栓沉孔半径为20 mm,改变螺栓孔深度,室温下螺栓沉孔内充满3.5% NaCl溶液,浸泡偶对金属72 h后,考察镁合金的腐蚀深度分布情况。若不考虑沉孔侧壁的腐蚀,即假设模型中cd段绝缘,如图5所示:随着H的增加,在阴阳极接触位置的最大腐蚀深度由1.32 mm减小到1.17 mm,但与接触点距离超过1.5 mm后,腐蚀深度随H的增大而增大。这主要是由于当H减小时,沉孔内电解质溶液的厚度减小,溶液电阻增大,抑制电流流到远离接触位置的区域[13],从而造成电偶电流的分布不均匀,在远离阴阳极金属接触位置的阳极金属腐蚀深度随之减小;另外,电解质溶液厚度越小,阴阳极金属接触位置附近溶液中的电位梯度增大,则带电离子运动的速率增加,电化学反应速率增加,造成接触位置附近的阳极金属腐蚀深度随之增大。当H增大,电偶电流的分布范围变广,腐蚀变得均匀。不同H时镁合金表面电偶电流密度的分布如图6所示。
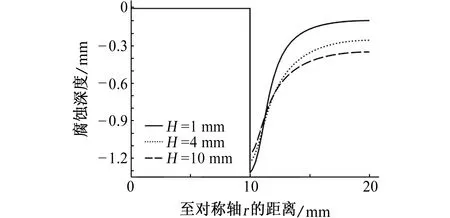
图5 不同H电偶对在3.5% NaCl溶液中浸泡72 h后,镁合金腐蚀深度随时间的变化曲线Fig. 5 The curves of corrosion depth of magnesium alloy with time after galvanic coupling being immersed in 3.5% NaCl solution for 72 h with different H
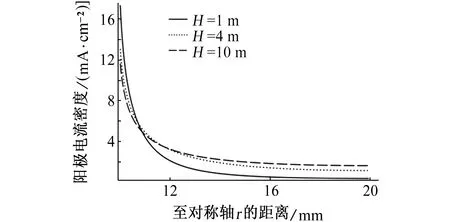
图6 不同H电偶对在3.5% NaCl溶液中浸泡72 h后,镁合金阳极电流密度随时间的变化曲线Fig. 6 The curves of anode current density with time after galvanic coupling being immersed in 3.5% NaCl solution for 72 h with different H
不考虑沉孔侧壁的腐蚀,镁合金平均腐蚀深度随H的变化如图7(a)所示,H小于10 mm时,随着沉孔深度增加,沉孔内电解质厚度增加,平均腐蚀深度增加;H大于10 mm时,平均腐蚀深度变化不显著。实际环境中,沉孔的侧壁作为阳极金属参与电偶腐蚀,将模型中的cd段设置为参与电偶腐蚀过程的阳极金属,随着H增加,电偶腐蚀的阴阳极面积比减小,电偶腐蚀程度会有所减弱。在电解质溶液厚度和阴阳极面积比的共同影响下,镁合金平均腐蚀深度随H的变化规律如图7(b)所示,H小于5 mm,H变化引起的电解质溶液厚度的变化是影响腐蚀平均深度的主要因素;H大于5 mm,电解质溶液厚度变化对平均腐蚀深度的影响不再明显,H变化引起的阴阳极面积比变化成为影响平均电偶腐蚀深度的主要因素。
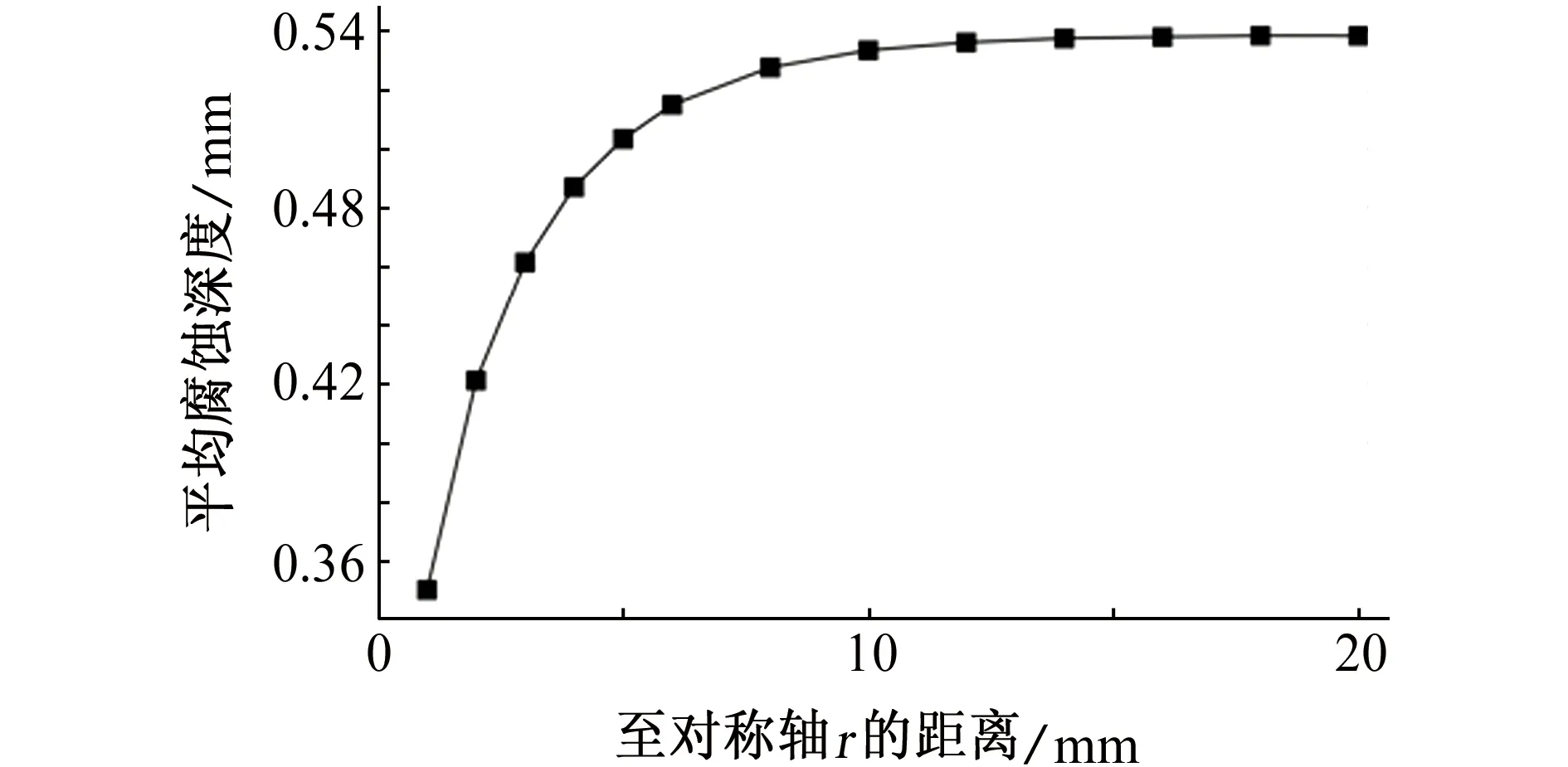
(a) 不考虑侧壁腐蚀
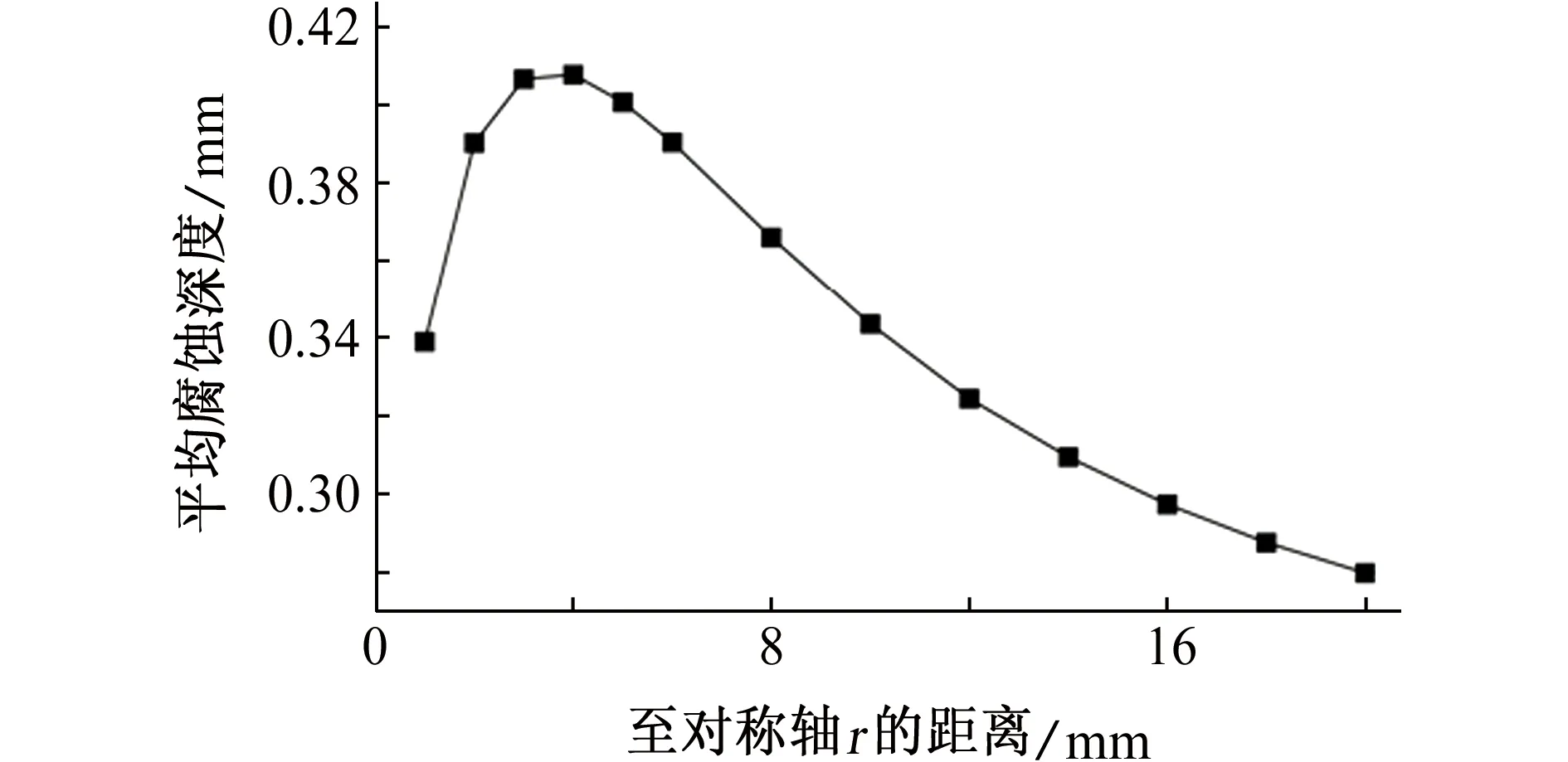
(b) 考虑侧壁腐蚀图7 不同H电偶对在3.5% NaCl溶液中浸泡72 h后,镁合金腐蚀深度Fig. 7 The corrosion depth of magnesium alloy after galvanic coupling being immersed in 3.5% NaCl solution for 72 h with different H:(a) not considering the corrosion of side wall; (b) considering the corrosion of side wall
2.2 螺栓沉孔半径对电偶腐蚀的影响
实际使用环境中,轮毂螺栓沉孔内积存的雨水、泥土等电解质的体积一定,不同沉孔半径(R)会造成积存电解质的厚度发生变化,同时也会改变电偶腐蚀偶对金属的阴阳极面积比,从而影响电偶腐蚀的严重程度。模拟研究室温下螺栓沉孔内积存恒定体积2 000 mm3的3.5% NaCl溶液,浸泡偶对金属72 h后,不同R对镁合金的腐蚀深度分布情况的影响,见图8。

图8 不同R电偶对在3.5% NaCl溶液中浸泡72 h后,镁合金腐蚀深度随时间的变化曲线Fig. 8 The curves of corrosion depth of magnesium alloy with time after galvanic coupling being immersed in 3.5% NaCl solution for 72 h with different R
由图8可见:R的变化对腐蚀深度的影响主要表现在距离接触点一定距离之后,腐蚀深度随着R的增大而减小。平均腐蚀深度的变化规律如图9所示,图10给出了接触点附近的最大腐蚀深度随着R的变化规律,随着R增大,电解质厚度减小的同时阴阳极面积比减小,镁合金平均腐蚀深度逐渐减小,接触位置附近最大腐蚀深度先明显增加,R大于15 mm后,最大腐蚀深度近似保持不变。

图9 不同R电偶对在3.5% NaCl溶液中浸泡72 h后,镁合金腐蚀深度Fig. 9 The corrosion depth of magnesium alloy after galvanic coupling being immersed in 3.5% NaCl solution for 72 h with different R
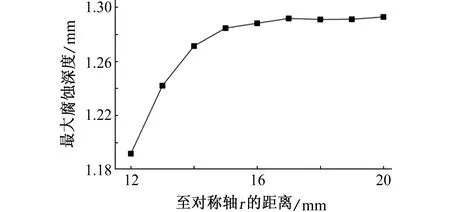
图10 不同R电偶对在3.5% NaCl溶液中浸泡72 h后,镁合金的最大腐蚀深度Fig. 10 The maximum depth of magnesium alloy after galvanic coupling being immersed in 3.5% NaCl solution for 72 h with different R
3 试验结果与仿真结果的对比
试验所用偶接件的阳极材料为未经表面处理的AE44镁合金,阴极材料为表面发黑处理的钢质螺栓。在镁合金基体上加工尺寸为R35 mm×35 mm
的沉孔,然后在沉孔中心加工螺纹孔,镁合金电偶对的装配示意如图1所示。在室温下对装配好的镁合金-钢质螺栓电偶对进行24 h 3.5% NaCl溶液全浸试验。镁合金-钢质螺栓浸入3.5% NaCl溶液后,有大量气泡冒出,随着浸泡时间延长,溶液浑浊程度逐渐加重。分别纪录浸泡不同时间后各试样沉孔底面腐蚀形貌,并与模拟的腐蚀形貌结果对比,见图11。24 h后,取出偶接件,镁合金表面有白色絮状腐蚀产物附着,清洗腐蚀产物后,表面上有肉眼可见的蚀坑,其腐蚀形态为点蚀,且距偶接位置越近,蚀坑越深,在螺栓周围区域出现一圈很深的腐蚀坑。由图11对比可得,模拟预测的镁合金电偶腐蚀区域扩展变化过程与试验所得电偶腐蚀区域变化过程具有较好的一致性。
4 结论
(1) 边界元数值仿真结果与全浸试验结果具有较好的一致性,仿真结果在预测镁合金与紧固螺栓的电偶腐蚀分布和腐蚀性能方面具有较好的应用;利用数值仿真方法可以更有效地研究单一因素对电偶腐蚀的影响,为避免实际应用中的电偶腐蚀破坏提供参考。
(2) 若沉孔内充满电解质,随着沉孔深度增加,镁合金表面平均腐蚀深度先增加后减小,H小于5 mm,H变化引起的电解质溶液厚度变化是影响腐蚀性能的主要因素;H大于5 mm,H变化引起的阴阳极面积比变化成为腐蚀性能的主要影响因素。
(3) 若沉孔内电解质体积恒定,随着螺栓沉孔半径增大,镁合金表面平均腐蚀深度近似线性减小,接触位置附近最大腐蚀深度先增加至最大值后基本不变。设计合理的轮毂连接结构,主要考虑降低电解质的积存和防止大阴极小阳极,可以在一定程度上减缓电偶腐蚀的发生。

(a) 3 h (b) 6 h (c) 12 h (d) 24 h图11 浸泡试验和仿真试验结果对比Fig. 11 Comparison between immersion test results and simulation test results
参考文献:
[1]卫英慧,许并社. 镁合金腐蚀防护的理论与实践[M]. 北京:冶金工业出版社,2008.
[2]张新,张奎. 镁合金腐蚀行为及机理研究进展[J]. 腐蚀科学与防护技术,2015(1):78-84.
[3]曾荣昌,陈君,张津. 镁合金电偶腐蚀研究及其进展[J]. 材料导报,2008,22(1):107-109.
[4]CROSS S R,GOLLAPUDI S,SCHUH C A. Validated numerical modeling of galvanic corrosion of zinc and aluminum coatings[J]. Corrosion Science,2014,88(88):226-233.
[5]THAMIDA S K. Modeling and simulation of galvanic corrosion pit as a moving boundary problem[J]. Computational Materials Science,2012,65(3):269-275.
[6]JIA J X,SONG G,ATRENS A. Influence of geometry on galvanic corrosion of AZ91D coupled to steel[J]. Corrosion Science,2006,48(8):2133-2153.
[7]THÉBAULT F,VUILLEMIN B,OLTRA R,et al. Reliability of numerical models for simulating galvanic corrosion processes[J]. Electrochimica Acta,2012,82(21):349-355.
[8]DESHPANDE K B. Effect of aluminium spacer on galvanic corrosion between magnesium and mild steel using numerical model and SVET experiments[J]. Corrosion Science,2012,62(9):184-191.
[9]刘贵昌,孙文,王立达. 海水中牺牲阳极阴极保护的分段非线性边界数学模型[J]. 腐蚀与防护,2012(10):876-879.
[10]高福勇,赵明,何广平,等. AZ31镁合金微区电偶腐蚀的数值研究[J]. 北京科技大学学报,2013,35(5):634-641.
[11]DESHPANDE K B. Experimental investigation of galvanic corrosion:comparison between SVET and immersion techniques[J]. Corrosion Science,2010,52(9):2819-2826.
[12]DESHPANDE K B. Validated numerical modelling of galvanic corrosion for couples:magnesium alloy (AE44)-mild steel and AE44-aluminium alloy (AA6063) in brine solution[J]. Corrosion Science,2010,52(10):3514-3522.
[13]SONG G,JOHANNESSON B,HAPUGODA S,et al. Galvanic corrosion of magnesium alloy AZ91D in contact with an aluminium alloy,steel and zinc[J]. Corrosion Science,2004,46(4):955-977.
