高寒草甸土壤微生物功能多样性对氮肥添加的响应
2018-04-11字洪标杨有芳阿的鲁骥罗雪萍王长庭
代 迪, 字洪标, 杨有芳, 阿的鲁骥, 陈 焱, 罗雪萍, 王长庭
(西南民族大学 生命科学与技术学院, 成都 610041)
自19世纪工业革命以来,人类活动正日益改变着全球氮循环,化石燃料的大量燃烧、肥料在农田系统中的过度使用以及固氮植物的大量种植皆导致生态系统中的氮储量迅速增加[1]。外源氮的输入不仅影响陆地生态系统可利用氮素的状况,还会导致土壤生态系统结构与功能的改变,进而产生诸如土壤富营养化等一系列环境问题[2]。而青藏高原高寒草甸远离工业区,因此受到N素破坏相对较少,从而成为研究N素对生态系统影响的理想区域。目前已有一些研究报道,如:王长庭等[3]研究发现过高氮肥(≥40 g/m2)的添加会使草地生态系统达到氮饱和状态,从而降低草地生态系统生产力和物种组成;王伟等[4]研究发现外源氮(硫酸铵、尿素、硝酸钙)的输入会促进植物生长,提高生产力,且当硫酸铵施肥量为20 g/m2时增产效果最明显;宗宁等[5]研究发现施N肥会改变地下生物量分配模式;曹文侠等[6]研究发现不同氮肥梯度的添加是通过改变土壤养分含量等特性,来改变植物群落物种的组成及生产力,使对氮肥敏感的植物个体增大,群落密度降低。因此,氮肥添加不仅影响地上植物群落结构和功能,而且显著改变了地下生态系统特别是土壤微生物群落,如:Compton等[7]发现草地土壤微生物量在施N后呈降低趋势;Clegg等[8]研究发现放线菌的磷脂脂肪酸(PLFA)在添加氮肥后升高,而真菌的磷脂脂肪酸(PLFA)对氮肥响应却很小。Yao等[9]研究表明,随着氮沉降速率增加土壤微生物的多样性降低。但是就青藏高原高寒草甸不同梯度施肥处理对土壤微生物多样性和组成的影响研究比较缺乏,限制了施肥对高寒草甸土壤生态功能和过程的认识,也不利于地上和地下部分相互关系的深入探讨。
因此,本研究以连续2 a施氮肥的川西北高寒草甸为研究对象,并运用Biolog法对微生物进行培养、观测,试图解决以下科学问题:(1) 施加不同梯度氮肥CO(NH2)2对高寒草甸土壤微生物群落代谢功能多样性有何影响?(2) 在不同的施氮肥梯度中最适宜的施肥量是多少?(3) 造成这一结果的影响机制是什么?旨在为高寒草地生态系统土壤微生物功能多样性对N肥添加的响应提供一定数据参考和理论依据。
1 材料与方法
1.1 研究区概况
研究区位于四川省阿坝州红原县西南民族大学生态保护与畜牧业高科技研发基地(32°49.823′N,102°35.237′E),海拔3 494 m,该区气候属于大陆性高原寒温带半湿润季风气候,日温差大,霜冻期长,四季变化不明显,年平均气温1.1℃,最高温度在7月,平均为10.9℃,最低温度在1月,平均为-10.3℃。干湿季节分明,年降水量为650~800 mm,长日照时期主要集中在5—9月,年平均日照2 417.9 h。草甸类型主要是矮嵩草草甸,其盖度在80%以上,其中莎草科主要有四川嵩草(Kobresiasetchwanensis)和高山嵩草(Kobresiapygmaea)等,有关植物群落组成等详见文献[10]。
1.2 试验设计与样品采集
试验样地选择地势相对平坦、植被分布均匀的未退化矮嵩草草甸(冬春草场)区域,且四周用围栏保护。于2012年5月下旬在围栏内选择面积为100 m×100 m地势平坦样区,分成4个30 m×20 m的试验样区,样区间距为3 m,各样区四角用木桩标记。以随机区组试验设计施N肥处理,施肥水平为0 g/m2(CK),10 g/m2(N10),20 g/m2(N20),30 g/m2(N30)4个施肥水平,每个施肥水平有6个3 m×3 m的小样方,共计24 (4×6)个小样方,小样方之间间隔2 m作为缓冲区。所施肥料为尿素CO(NH2)2,含氮量为46%。从2012年5月下旬开始第一次施肥,此后每年5月下旬施肥1次。施肥在多云的阴天进行(因为在多云的阴天施肥,施肥当天或次日会有降雨,这就保证了所施肥料在短期内能溶于土壤中),用手将肥料均匀地洒在小样区。
于2014年8月中旬,在3 m×3 m的样方内,分层(0—10 cm和10—20 cm)钻取土壤样品,土钻内径为5 cm,2个3 m×3 m中的土壤样品共计2×5钻均匀混合为一个土壤样品,重复3次,做好标记,把土壤样品分成两部分,一部分风干后测定土壤养分,另一部分拣去石头和草根等杂物做好标记,迅速放入保鲜盒,保存于4℃的冰箱,测定土壤微生物功能多样性。
1.3 测定方法
1.3.1土壤理化性质测定土壤含水量(soil moisture content,SMC)测定采用TDR土壤水分测定仪(Time Domain Reflectometry,Midwest-G,JZZ1-TDR-3,Peking,China),单位为%,即体积含水量。土壤有机质(soil organic matter,SOM)含量测定采用重铬酸法(外加热法),土壤全氮(total nitrogen,TN)含量测定采用凯氏定氮法,土壤速效氮(available nitrogen,AN)含量测定采用扩散皿法[11],钼锑抗比色法测定土壤全磷(total phosphorus,TP)含量,土壤速效磷(available phosphorus,AP)含量测定采用碳酸氢钠浸提—钼锑抗比色法[12]。采用土钻法测定根土重量比,在每个观测样方用内径5 cm土钻在0—20 cm土层每10 cm为1层取样,共2层,每层“V”字型取10钻,重复5次,不同土层样品过筛得到土壤样品并称重,清水冲洗得到根系样品,分别在60℃和105℃烘至恒重,称干重质量,根土重量比=根重量/土壤重量[13]。养分测定均进行3次重复。
1.3.2土壤微生物多样性的测定与计算土壤微生物多样性的测定采用Biolog-ECO(Biolog Inc,USA)板,具体操作步骤见向泽宇等[14]描述。平均颜色变化率(Average well color development,AWCD)和微生物多样性计算公式如下:
AWCD值的计算:
(1)
Shannon-Weiner指数(H):
H=-∑PilnPi
(2)
Pielou均匀度指数(J):
J=(-∑PilnPi)/lnS
(3)
McIntosh指数(U):
(4)
式中:Ci为第i孔的590,750 nm下的吸光值之差;R为对照孔的吸光值;n为Biolog微平板的碳源种类的数目(n=31);Pi为第i孔的相对吸光度值与整个平板相对吸光度值总和的比率;S为产生颜色变化的孔的数目;ni为第i孔的相对吸光度值[15]。
1.4 数据处理
采用SPSS 19.0 software (SPSS Inc.,version 19.0)和CANOCO for Windows 4.5软件对数据进行分析。
2 结果与分析
2.1 施N肥对高寒草甸土壤养分的影响
施N肥后土壤养分发生了改变(表1)。在0—10 cm土层,土壤水分在N30处理显著增加,而N10和N20处理显著降低;AP含量表现为N30和N20处理显著大于N10和CK;AN含量表现为N30>N20>CK>N10,且存在显著差异;TP含量显著提高,但TN含量无显著变化;根土比表现为N20>N30>N10>CK,且存在显著差异。在10—20 cm土层,AP,TP和TN的含量无显著影响;土壤水分在N10和N20处理显著降低;AN含量在N20和N30处理显著增加;根土比表现为N20>N10>N30>CK,且在N10和N20处理显著提高。
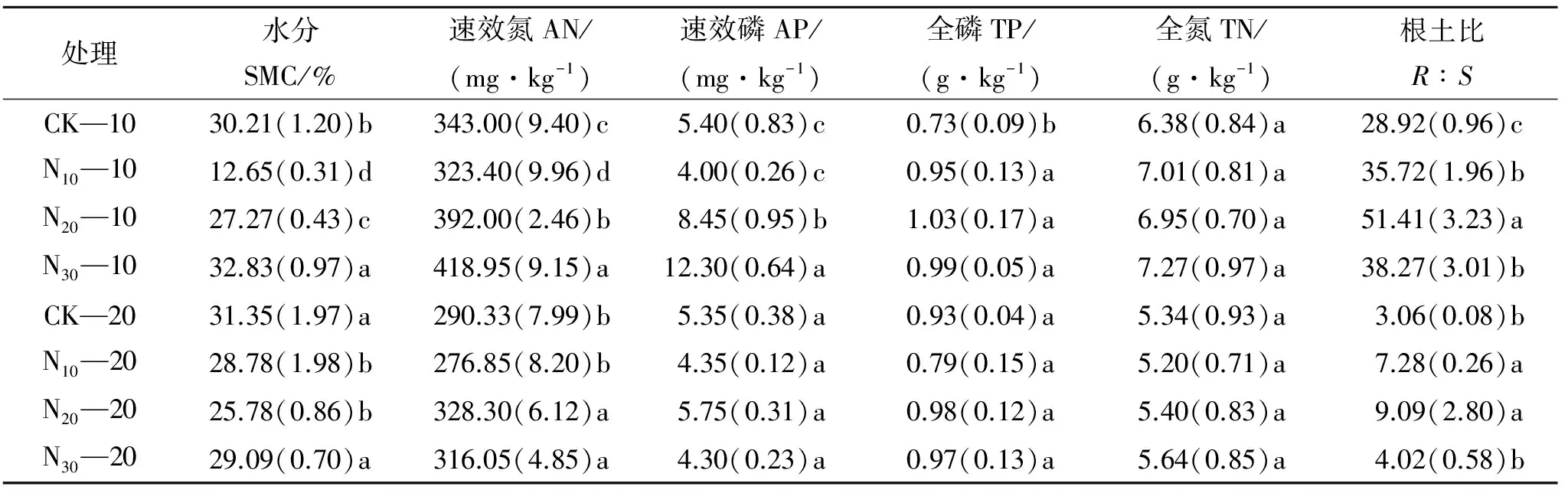
表1 施N肥对高寒草甸土壤养分的影响
注:CK—10,N10—10,N20—10,N30—10分别代表不同施肥梯度样地0—10 cm土层;CK—20,N10—20,N20—20,N30—20分别代表不同施肥梯度样地10—20 cm土层。括号里面的数字表示标准误差,小写字母代表不同施肥梯度间差,下表同。
2.2 施N肥后高寒草甸土壤微生物功能多样性的变化
由图1可知,在0—10 cm土层,从接种开始到培养24 h,AWCD值在不同施N肥梯度下无明显变化;但培养24~148 h内,AWCD值均在不同施肥梯度下快速增加,且表现为CK最大,N10最低;在148~172 h时段内,CK和N20增长缓慢,趋于停止,N10和N30仍在增长(图1A)。在10—20 cm土层,在0~24 h时段不同施肥梯度的AWCD值均无明显变化,但在24~172 h时段内,各梯度的AWCD值均呈现出明显的增长趋势,且表现出施肥处理显著高于CK,其中N20处理最大,N10和N30的增长速度趋于一致(图1B)。

图1不同N肥梯度高寒草甸土壤微生物AWCD值
由表2可知,不同施N肥梯度高寒草甸土壤微生物群落功能多样性存在显著差异。在0—10 cm土层,培养72 h的Pielou指数在不同施肥梯度下无显著差异,但是McIntosh指数在N10处理显著降低;Shannon指数在N10和N20处理显著降低(p<0.05)。在10—20 cm土层中,McIntosh指数表现为N20>N30>N10>CK且N20处理显著高于其他处理;Shannon指数和Plelou指数均表现为施肥显著增加其多样性,且均在N20处理下最大。
2.3 土壤微生物碳源利用特征的变化
根据化学基团的性质,将ECO板上的31种碳源分成糖类、氨基酸类、酯类、醇类、胺类和酸类。发现不同施肥梯度下土壤微生物对6类碳源类型利用不同。在0—10 cm土层,土壤微生物对糖类的利用表现为N30>CK>N20>N10,且N10处理显著降低;胺类为N20>N30>CK>N10,且N20显著增加;氨基酸类和醇类表现为N30处理显著降低,而酯类、酸类的利用无显著变化(图2A)。在10—20 cm土层,N肥的添加明显提高了糖类、氨基酸类、酯类、胺类和酸类的利用,且均表现为在N20处理下最高,醇类在施肥处理下无显著变化(图2B)。
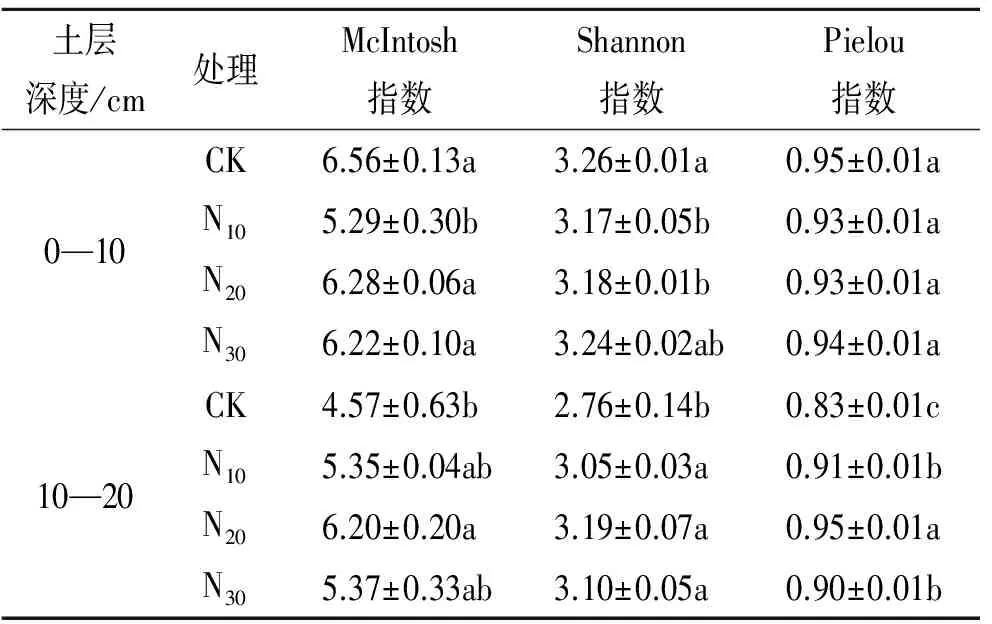
表2 不同施N肥梯度高寒草甸土壤微生物群落功能多样性
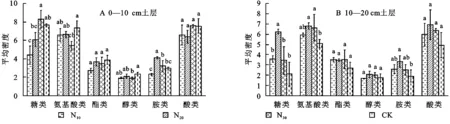
注:不同小写字母表示各处理间差异显著(p<0.05),下图同。
图2不同施N肥梯度高寒草甸土壤微生物对不同碳源利用图谱
2.4 土壤微生物利用碳源的主成分分析
采用PCA(Principal component analysis)对添加不同梯度氮素的高寒草甸样地培养72 h的土壤微生物的每孔吸光值进行主成分分析。结果表明,在0—10 cm土层,主成分1,2对土壤微生物功能多样性的贡献率分别为51.3%和15.9%,累计贡献率为67.2%(图3A)。PCA图中代表不同N肥梯度处理的土壤微生物群落分布存在差异,N30和CK样品主要分布集中在一、四象限,而N20和N10样品集中在二、三象限,说明N30和CK与N10和N20土壤微生物对利用碳源种类、水平和代谢多样性方面存在差异(图3A)。在10—20 cm土层中,主成分1对土壤微生物功能多样性的贡献率为45.1%,主成分2的贡献率为18.1%,累积贡献率为63.2%(图3B)。同时,CK,N10,N20和N30分布在不同区域中,说明不同施N处理,土壤微生物群落发生改变,其中N20和N30之间无显著差异(图3B)。综上所述,不同施N肥梯度处理下土壤微生物群落发生改变,说明土层深度也是影响土壤微生物的一个主要因素。
荷载因子分析(表3)表明在0—10 cm土层,β-甲基-D-葡萄糖苷、i-赤藻糖醇、肝糖、D-氨基葡萄糖酸、衣康酸、D-纤维糖与PC1轴相关性较大,其中i-赤藻糖醇l和衣康酸与PC1轴呈正相关,β-甲基-D-葡萄糖苷、肝糖、D-氨基葡萄糖酸和D-纤维糖与PC1轴呈显著正相关;D-半乳糖醛酸、吐温40、D-木糖、D-半乳糖醛酸、D-甘露醇、苯乙基胺、腐胺与PC2相关性较大,其中D-木糖、D-半乳糖醛酸与PC2轴呈负相关,苯乙基胺与PC2轴呈显著负相关,D-半乳糖醛酸与PC2轴呈正相关,吐温40和D-甘露醇和PC2轴呈显著正相关。在10—20 cm土层中,与PC1轴具有较高相关性的碳源有14个,且都为正相关,其中D-半乳糖酸γ内酯、N-乙酰基-D-葡萄胺、a-环状糊精、r-羟基丁酸、吐温80、甘氨酰-L-谷氨酸和D-苹果酸与PC1轴呈正相关,吐温40、2-羟苯甲酸、L-苯基丙氨酸、4-羟基苯甲酸、D-纤维二糖、α-D-葡萄糖-1-磷酸盐和D,L-a-甘油与PC1轴呈显著正相关;与PC2轴有高相关性的碳源有4个,均为正相关,其中L-丝氨酸、肝糖和甘氨酰-L-谷氨酸与PC2轴呈正相关,丙酮酸甲酯与PC2轴呈显著正相关。
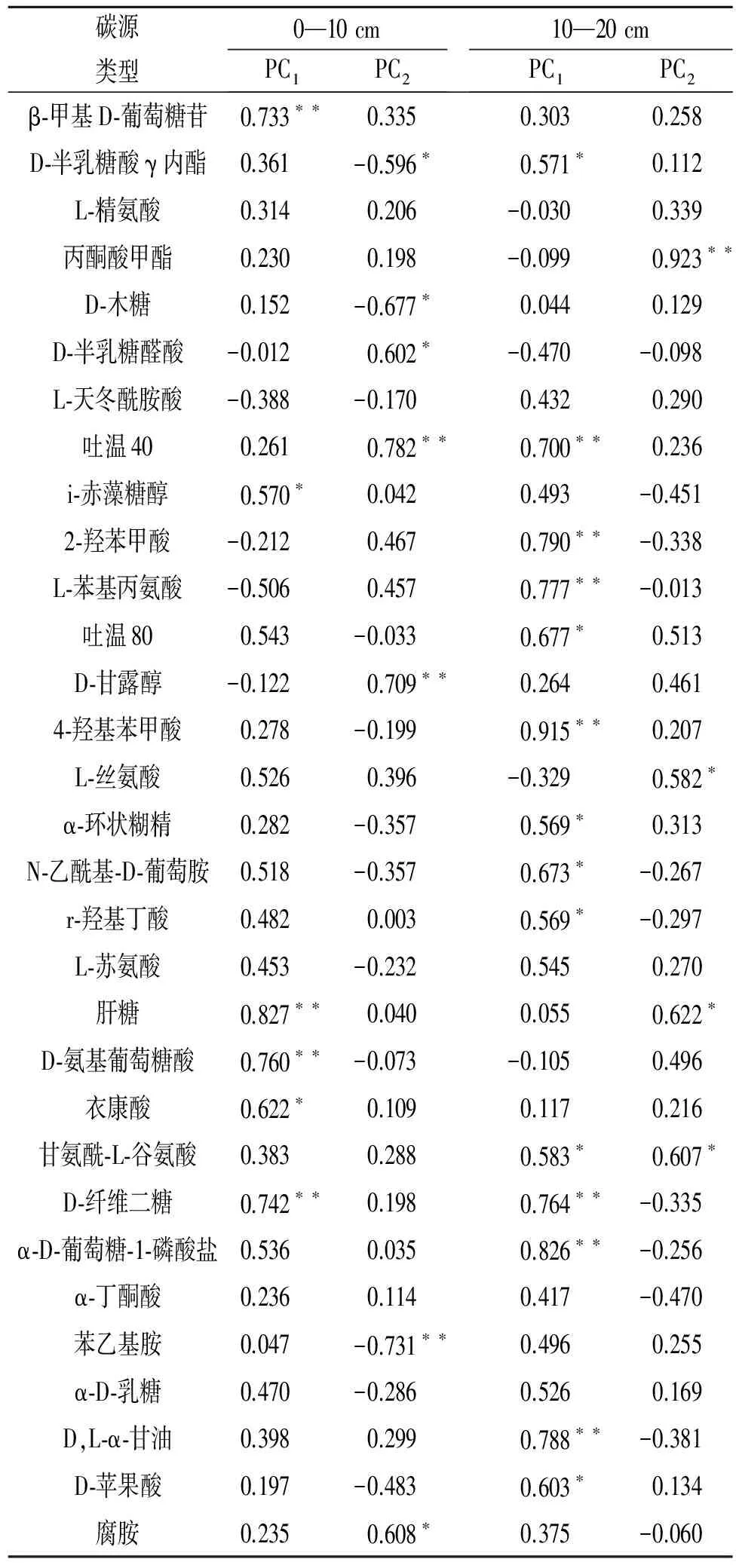
表3 31种碳源主成分载荷因子
注:*代表相关,**代表显著相关。
2.5 土壤微生物功能多样性的冗余分析
首先对不同施N肥梯度下培养72 h的Boilog 数据进行降趋对应分析,得到第一轴最大梯度长度为0.3,因此选择线性冗余分析(Redundancy analysis,RDA)对环境梯度进行直接排序分析,探讨不同施N肥处理下土壤理化性质对土壤微生物代谢特征的影响。在0—10 cm土层,RDA分析的轴1和轴2的解释变量分别为56.6%和12.6%,表明土壤理化性质对土壤微生物碳源代谢有较大的影响(图4A)。其中,SMC,AP和AN对碳源利用类型具有显著影响(p<0.05),SMC与糖类和酯类呈显著正相关,AP和AN与糖类呈显著正相关,与氨基酸呈显著负相关(图4A)。在10—20 cm土层,轴1和轴2的解释变量分别为61.6%和8.5%,前2轴的解释变异达到了70.1%,说明土壤理化性质对土壤微生物碳源利用类型影响较大(图4B)。其中,SMC,R∶S和AN对碳源利用有显著影响(p<0.05),AN和R∶S与6种碳源利用类型呈正相关,SMC与糖类、酸类和氨基酸类呈明显负相关(图4B)。
3 讨 论
3.1 不同N肥梯度对土壤理化性质的影响
土壤理化性质是土壤质量的重要组成,它不仅影响土壤保持和供应水分能力,而且对土壤通气状况、水分渗入、以及地表径流均有重要的作用[3]。施肥改变土壤的物理和化学性质。本研究发现,施N肥后土壤水分含量发生显著变化,不同梯度下存在显著差异。这是因为肥料需要水分的溶解才能进入土壤[16],经过一系列的化学过程,转变为能够被植物吸收利用的速效养分,因此,施肥在一定程度能够降低土壤含水量[17]。此外,中高水平氮肥的添加显著增加土壤速效养分,但是对全量养分无显著影响。这与王长庭[3]和张杰琦[18]等研究结果相似。因为N肥的添加改变了土壤的有效养分,促进植物生长,提高了草地生态系统的初级生产力,从而增加凋落物的数量,导致土壤有机成分增加[19]。另一方面,土壤C,N,P,K等养分的有效性及其在地上、地下的生态循环受到土壤微生物分解和调控[20],微生物活性强弱显著影响着土壤养分含量的高低[21],而施肥刺激土壤生物的活性,加快了土壤有机氮磷的分解,同时植物快速生长消耗了土壤的无机氮磷,从而对全量养分无显著增加[22]。根土比能够反映出高寒草甸植物根系生物量变化和空间分布规律[23],本研究发现施氮肥显著增加了根土比,说明施肥刺激了植物根系生长,从而表现出较高的根系生物量。而根系生物量增加可以为土壤提供更多的养分含量,从而使土壤中有效养分含量增加[24-25]。
3.2 不同N肥梯度对土壤微生物碳源利用的代谢活性的影响
AWCD能够反映土壤微生物代谢活性,微生物代谢活性的变化能够反映土壤生态系统的质量和健康水平[26]。研究表明,N肥添加会刺激土壤微生物活性。本研究发现,N肥降低了0—10 cm土层土壤微生物活性。这可能是N肥添加增加了土壤中可利用氮数量,导致0—10 cm土壤养分含量增加,促进植物根系的生长,而植物根系与微生物对养分存在竞争关系,根系大量繁殖分泌化学物质抑制了土壤微生物的活动、数量与活性[27-28]。而10—20 cm土层,施氮肥增加了土壤微生物活性。在自然状况下,青藏高原高寒草甸土壤中虽然储藏大量的TN,TP,但由于受到低温限制,其矿化速率非常低,可供利用的有效N,P仅占总量的1%左右[29],使土壤微生物利用养分受限,当施加氮肥后,快速补充了速效N,经过淋溶作用达到土壤深层,解除了土壤的N限制,促进了土壤的生长发育,进而增强了土壤微生物的活性[19]。此外,本研究还发现,在N20(20 g/m2)处理下土壤微生物活性最佳,即土壤微生物活性,生物量以及功能多样性的增加不是随着施肥量的增加而不断增加的,施肥量存在一个最大值,超过其最大值反而会对微生物产生抑制作用[3,30-31]。
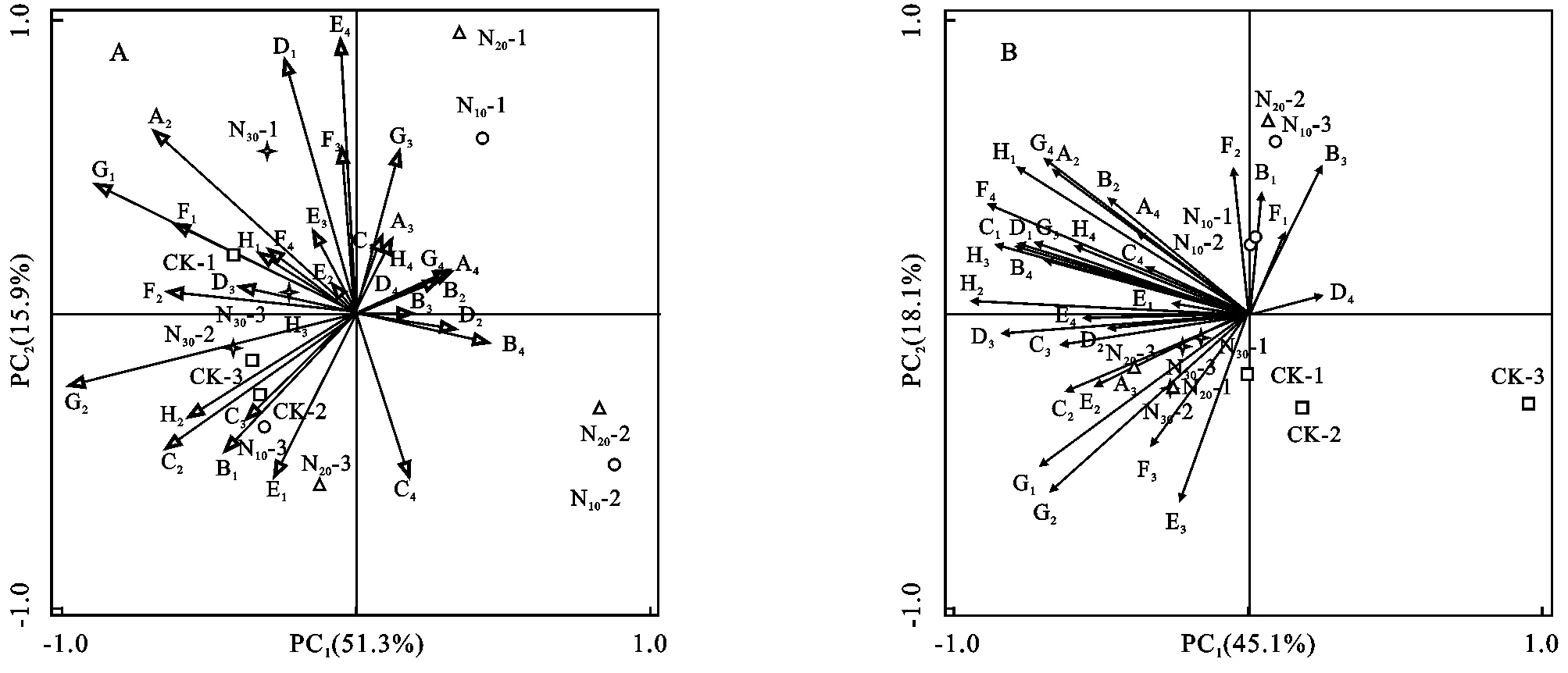
注:A2:β-甲基-D-葡萄糖苷;A3:D-半乳糖酸-γ-内脂;A4:L-精氨酸;B1:丙酮酸甲酯;B2:D-木糖;B3:D-半乳糖醛酸;B4:L-天门冬酰胺酸;C1:吐温40;C2:i-赤藓糖醇;C3∶2-羟基苯甲酸;C4:L-苯基丙氨酸;D1:吐温80 ;D2:D-甘露醇;D3:4-羟基苯甲酸;D4:L-丝氨酸;E1:α-环式糊;E2:N-乙酰-D-葡萄糖;E3:γ-羟基丁酸;E4:L-苏氨;F1:肝糖;F2:D-葡萄糖胺酸;F3:衣康酸;F4:甘氨酰-L-谷氨酸;G1:D-纤维二糖;G2:α-D-葡萄糖-1-磷酸;G3:α-丁酮酸;G4:苯乙胺;H1:α-D-乳糖;H2:D,L-α-磷酸甘油;H3:D-苹果酸;H4:腐胺。
图3不同施N肥梯度高寒草甸土壤微生物功能多样性主成分分析
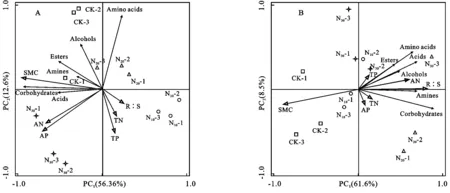
注:SMC:土壤含水量;TN:全氮;TP:全磷;AN:速效氮;AP:速效磷;R:S:根土比;糖类:Carbohydrates;氨基酸类:Amino acids;酯类:Esters;醇类:Alcohols;胺类:Amines;酸类:Acids。
图4不同施N肥梯度高寒草甸土壤养分与土壤微生物群落功能多样性的冗余分析
3.3 不同N肥梯度对土壤微生物功能多样性的影响
土壤多样性指数不仅能够反映土壤微生物群落物种及其个体的均匀分布程度、丰富度均一性[32],而且还可以用来评价不同土壤微生物群落多样性水平[28]。本研究表明,在0—10 cm土层,施氮降低了McIntosh指数、Shannon指数和Pielou指数。这一方面是氮肥的添加打破了植物与微生物原有的竞争模式,提高了植物获取土壤养分资源的能力,间接抑制了土壤微生物的生长繁殖,从而降低了土壤微生物多样性[19,24]。另一方面,土壤微生物绝大多数适宜在中性环境中生存繁殖,但是N肥添加降低0—10 cm土层的pH值导致土壤酸化,从而导致微生物多样性降低[9]。但在10—20 cm土层,N肥的添加对土壤微生物的多样性有促进作用。因为施N肥促进高寒草甸土壤有机氮素的矿化作用,增大深层氮的矿化量和矿化速率,从而对微生物群落的多样性具有明显的促进作用[33-34]。此外,土壤微生物多样性的变化也可能受到酶活性影响,乔江等[35]和裴海昆[36]认为施氮肥显著增强土壤酶活性。不同土层土壤微生物多样性对氮添加响应不一致,说明土层深度可能是影响微生物多样性的一个重要因子,而引起差异主要因素可能是土壤间养分含量的差异所致。
3.4 土壤微生物与土壤养分的关系
土壤养分是维系地上和地下生物活动最基本的营养元素,也是影响群落组分和生物多样性的重要因子[37]。土壤微生物是土壤养分转化、循环以及有机碳代谢的主要驱动力,其参与土壤中有机质的分解、矿质营养的吸收释放、物质循环和成土过程,并将有机物转化为植物可利用的养分[38-41]。土壤微生物与养分间存在显著相关性,本研究发现土壤含水量、根土比、速效氮、速效磷与土壤微生物碳源利用类型呈显著相关。这与以前的研究结果相一致,即土壤物理和化学性质与土壤微生物密切相关[42-43]。施N肥后土壤微生物对碳源的利用类型发生改变,土壤微生物对碳源利用的选择性改变了土壤微生物的组成结构和多样性,从而影响土壤微生物碳源代谢活性和功能多样性的变化[15]。尉建埔等[44]在帽儿山研究发现氮肥显著改变了云杉人工林的土壤理化性质,导致土壤微生物量、活性和群落结构改变。此外,外源N素的输入能够迅速提高土壤中植物可利用氮的含量,导致植物叶片氮含量提高,从而光合作用增强,向地下输入更多的光合产物,改变微生物对碳源的代谢活性[45]。因此,研究微生物多样性对于认识高寒草甸生态系统功能过程具有重要意义。
4 结 论
本研究基于Biolog-ECO板法评价了川西北高寒草甸土壤微生物功能多样性对不同N肥梯度的影响发现,施氮降低了表层(0—10 cm)土壤微生物活性而提高了深层(10—20 cm)土壤微生物活性;N10显著降低表层微生物多样性,而N20显著增加了深层土壤微生物多样性。施N肥后高寒草甸土壤微生物利用碳源类型主要是糖类、氨基酸类、酸类。综合来看,20 g /m2N肥(N20)添加有利于生态系统的稳定以及物种多样性的维持。此外,随着研究手段技术更替,今后的研究我们应该采用16S rRNA的V4区和ITS的ITS2区分别评价不同施肥梯度下细菌和真菌群落组成和多样性变化,以及从功能类群和基因方面入手,将有助于我们更好认识高寒草甸生态系统对N肥添加的响应以及生态功能过程。
参考文献:
[1]张艺.氮添加对若尔盖高寒泥炭湿地土壤碳稳定性的影响[D].北京:北京林业大学,2016.
[2]王杰,李刚,修伟明,等.氮素和水分对贝加尔针茅草原土壤酶活性和微生物量碳氮的影响[J].农业环境与发展,2014,31(3):237-245.
[3]王长庭,王根绪,刘伟,等.施肥梯度对高寒草甸群落结构、功能和土壤质量的影响[J].生态学报,2013,33(10):3103-3113.
[4]王伟,德科加.不同氮肥及施氮水平对称多县高寒草甸生物量和养分的影响[J].草地学报,2015,23(5):968-977.
[5]宗宁,石培礼,宋明华,等.模拟放牧改变了氮添加作用下高寒草甸生物量的分配模式[J].自然资源学报,2012,27(10):1696-1707.
[6]曹文侠,李文,李小龙,等.施氮对高寒草甸草原植物群落和土壤养分的影响[J].中国沙漠,2015,35(3):658-666.
[7]Compton J E, Watrud L S, Porteous L A, et al. Response of soil microbial biomass and community composition to chronic nitrogen additions at Harvard forest[J]. Forest Ecology & Management, 2004,196(1):143-158.
[8]Clegg C D, Lovell R D L, Hobbs P J. The impact of grassland management regime on the community structure of selected bacterial groups in soils[J]. Fems Microbiology Ecology, 2003,43(2):263-270.
[9]Yao M, Rui J, Li J, et al. Rate-specific responses of prokaryotic diversity and structure to nitrogen deposition in the Leymus chinensis, steppe[J]. Soil Biology & Biochemistry, 2014,79:81-90.
[10]阿的鲁骥,何兵,王长庭,等.入侵植物土荆芥对川西北高寒草甸3种培育牧草根际土壤酶活性、微生物数量及土壤养分的影响[J].西南农业学报,2015,28(2):815-821.
[11]鲍士旦.土壤农化分析[M].北京:中国农业出版社,2008.
[12]中国科学院南京土壤研究所.土壤理化分析[M].上海:上海科学技术出版社,1978.
[13]任继周.草业科学研究方法[M].北京:中国农业出版社,1998.
[14]向泽宇,张莉,张全发,等.青海不同林分类型土壤养分与微生物功能多样性[J].林业科学,2014,50(4):22-31.
[15]胡雷,阿的鲁骥,字洪标,等.高原鼢鼠扰动及恢复年限对高寒草甸土壤养分和微生物功能多样性的影响[J].应用生态学报,2015,26(9):2794-2802.
[16]侯彦林,王曙光,郭伟.尿素施肥量对土壤微生物和酶活性的影响[J].土壤通报,2004,35(3):303-306.
[17]孙锋,赵灿灿,李江涛,等.与碳氮循环相关的土壤酶活性对施用氮磷肥的响应[J].环境科学学报,2014,34(4):1016-1023.
[18]张杰琦,李奇,任正炜,等.氮素添加对青藏高原高寒草甸植物群落物种丰富度及其与地上生产力关系的影响[J].植物生态学报,2010,34(10):1125-1131.
[19]杨晓霞,任飞,周华坤,等.青藏高原高寒草甸植物群落生物量对氮、磷添加的响应[J].植物生态学报,2014,38(2):159-166.
[20]何振立.土壤微生物量及其在养分循环和环境质量评价中的意义[J].土壤,1997,29(2):61-69.
[21]张东杰.青藏高原高寒草甸植被与土壤特征[J].草业科学,2015,32(2):269-273.
[22]卡着才让,德科加,徐成体.不同施肥时间及施氮水平对高寒草甸生物量和土壤养分的影响[J].草地学报,2015,23(4):726-732.
[23]字洪标,阿的鲁骥,马力,等.高寒草甸不同类型草地群落根土比、土壤养分变化[J].西南农业学报,2016,29(12):2916-2921.
[24]周兴民.中国嵩草草甸[M].北京:科学出版社,2001.
[25]Zak D R, Holmes W E, White D C, et al. Plant diversity, soil microbial communities, and ecosystem function: are there any links [J]. Ecology, 2003,84(8):2042-2050.
[26]张瑞,张贵龙,陈冬青,等.不同施肥对农田土壤微生物功能多样性的影响[J].中国农学通报,2013,29(2):133-139.
[27]王伟,德科加.不同氮肥及施氮水平对称多县高寒草甸生物量和养分的影响[J].草地学报,2015,23(5):968-977.
[28]刘敏,王长庭,字洪标,等.火烧干扰下高寒草甸土壤微生物群落功能多样性变化特征[J].应用与环境生物学报,2016,22(2):263-270.
[29]赵新全.高寒草甸生态系统与全球变化[M].北京:科学出版社,2009.
[30]德科加,周青平,徐成体.不同施氮量对天然草场牧草产量影响[J].青海畜牧兽医杂志,2001,31(3):12-13.
[31]沈振西,陈佐忠.高寒矮嵩草草甸植物类群对模拟降水和施氮的响应[J].植物生态学报,2002,26(3):288-294.
[32]姬艳艳,张贵龙,张瑞,等.耕作方式对农田土壤微生物功能多样性的影响[J].中国农学通报,2013,29(6):117-123.
[33]Güsewell S, Gessner M O. N∶P ratios influence litter decomposition and colonization by fungi and bacteria in microcosms[J]. Functional Ecology, 2009,23(1):211-219.
[34]Strickland M S, Rousk J. Considering fungal: Bacterial dominance in soils-Methods, controls, and ecosystem implications[J]. Soil Biology & Biochemistry, 2010,42(9):1385-1395.
[35]乔江,赵建宁,王慧,等.施氮肥对草原生态系统影响的研究进展[J].草原与草业,2013,25(2):22-28.
[36]裴海昆.不同施肥量对天然草地土壤酶活性的影响[J].青海畜牧兽医杂志,2001,31(2):15-16.
[37]Huang P M, Lin T H, Tsai P R, et al. Intrapleural steroid instillation for multiple organ failure with acute respiratory distress syndrome[J]. Shock, 2013,40(5):392-397.
[38]Baldock J A. Role of the soil matrix and minerals in protecting natural organic materials against biological attack[J]. Organic Geochemistry, 2000,31(7/8):697-710.
[39]Rutigliano F A, Ascoli R D, Virzo De Santo A. Soil microbial metabolism and nutrient status in a Mediterranean area as affected by plant cover[J]. Soil Biology and Biochemistry, 2004,36(11):1719-1729.
[40]牛小云,孙晓梅,陈东升,等.辽东山区不同林龄日本落叶松人工林土壤微生物,养分及酶活性[J].应用生态学报,2015,26(9):2663-2672.
[41]翟辉,张海,张超,等.黄土峁状丘陵区不同类型林分土壤微生物功能多样性[J].林业科学,2016(12):84-91.
[42]Chung H, Zak D, Reich P, et al. Plant species richness, elevated CO2, and atmospheric nitrogen deposition alter soil microbial community composition and function[J]. Global Change Biology, 2007,13(5):980-989.
[43]Pietri J C A, Brookes P C. Nitrogen mineralisation along a pH gradient of a silty loam UK soil[J]. Soil Biology & Biochemistry, 2008,40(3):797-802.
[44]尉建埔,张洁,王文娜,等.施氮肥对东北帽儿山云杉人工林土壤微生物生物量和群落结构的影响[J].东北林业大学学报,2016,44(5):52-56.
[45]宗宁,石培礼,蔣婧,等.短期氮素添加和模拟放牧对青藏高原高寒草甸生态系统呼吸的影响[J].生态学报,2013,33(19):6191-6201.
