隔盐方式对设施盐渍化土壤主要盐离子空间分布及酶活性的影响
2018-04-11孙凯宁王克安
孙凯宁, 王克安, 杨 宁
(山东省农业科学院 蔬菜花卉研究所/国家蔬菜改良中心山东分中心/山东省设施蔬菜生物学重点实验室, 济南 250100)
目前我国设施农业生产区域分布广泛,主要集中于黄淮地区、东北南部、华北、西北等地区[1-2]。然而,设施生产高投入、高产出、高复种指数的生产模式,同时随着设施种植年限的延长,设施菜地土壤次生盐渍化现象不断出现并日益加重,部分种植年限长(一般5~8 年以上)的设施菜地已不能再继续生产,严重影响了蔬菜的产量和品质,阻碍蔬菜生产的可持续发展[3-5]。为此,前人尝试多种途径进行修复改良,如王金龙等用填闲作物改良温室次生盐渍化土壤[6],施毅超等采用轮作模式研究对土壤电导率和离子组成的影响[7]。张生田通过增施生物有机肥和改良剂以降低设施蔬菜土壤次生盐渍化危害[8]。以上改良方式多针对露天盐碱地,主要通过改变种植制度来实现,这在一些种植习惯固定的地区难以推广,且在盐渍化程度较高地区的效果并不理想,所需改良周期较长。隔盐层在盐碱地改良中有较多应用[9-12],隔盐层在土体中通过改变水盐运移轨迹,可以有效抑制潜水蒸发和土壤返盐,不用改变耕作制度,见效快,效果好,但该类改良方式多见于露天盐碱地,在设施盐渍化土壤中应用却少有报道。土壤生态系统中的微生物和土壤酶是农田土壤比较活跃的组分,共同推动着土壤代谢过程,对自然和人为因素造成的变化反应敏锐[13],也有研究者提出以脲酶、过氧化氢酶和磷酸酶所反映出的微生物学特性作为土壤环境质量变异的有效指标[14]。土壤酶既是土壤有机物转化的执行者,又是植物营养元素的活性库,并常被认为是土壤肥力与质量的重要衡量指标[15-16]。本研究在前人研究的基础上,设置了无机介质隔层、有机介质隔层以及复合隔层,探讨隔盐层在设施盐渍化土壤中的抑盐效果,分析不同隔盐方式对设施盐渍化土壤主要离子空间分布以及土壤酶活性的影响状况,为设施土壤改良提供数据支持,为设施农业可持续发展贡献微薄之力。
1 材料与方法
1.1 试验设计
采用土柱模拟试验,土柱长80 cm,内径为25 cm。土柱中的填充物分隔盐层和土壤,隔盐层分对照(无隔层,CK),砂砾层(厚10 cm,T1),复合有机物料层(生物炭、菌渣,厚10 cm,T2)、砂砾+复合有机物料层(厚20 cm,T3),共4各处理,各重复3次,每个土柱定植菠菜3株,土壤为通过人工方法均匀调配的中度盐碱土(含盐量0.3%),基本理化状况见表1。各处理隔层均在土柱上部30 cm土层以下。试验于2016年11 月8 日到2017年2 月22 日在山东省农业科学院蔬菜花卉研究所核心试验区进行,各处理管理方式保持一致。植株光合特性在收获当天测定,随机采集植株样品并采集0—10 cm,10—20 cm,20—30 cm的土壤样本,每个区内重复取样3次,植株样品采用液氮保存,土壤样品采用风干保存。

表1 供试土壤基本理化性质
1.2 测定项目与方法
1.2.1土壤离子7种离子形态采用美国戴安有限公司生产的离子色谱仪(Dionex ICS 3000),将0.1 g风干土溶到10 ml超纯水中,然后再稀释20倍,测定计算。
1.2.2土壤酶活性测定酶活性参照严昶升的方法[17]。脲酶采用苯酚—次氯酸钠比色法;过氧化氢酶采用高锰酸钾滴定法;蔗糖酶活性用3,5-二硝基水杨酸比色法测定;磷酸酶用磷酸苯二钠(4-氨基安替比林)比色法。
1.3 数据处理
试验数据均用Excel做图,SPSS 22.0软件进行统计分析,单因素方差分析采用LSD法。
2 结果与分析
2.1 隔盐层对设施盐渍化土壤主要盐离子空间分布的影响


图1不同处理Na+含量
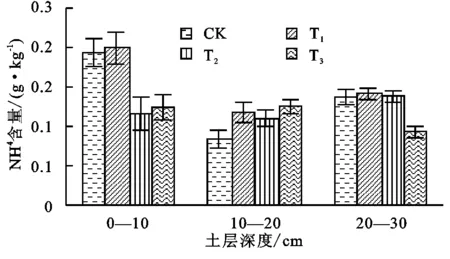


图3不同处理K+含量
2.2 隔盐层对设施盐渍化土壤酶活性的影响
从0—30 cm土层脲酶活性来看(图9),与CK相比,T1对脲酶活性有一定的抑制作用,T2和T3分别提高了6.25%和7.30%;土壤蔗糖酶各处理间差别较大(图10),T1,T2均较CK有所降低,而T3达到1 240.6 Glu.mg/(g·24 h),较CK升高了4.70%;就过氧化氢酶活性而言(图11),T1和T2较CK分别提高了0.87%和1.28%,而T3降低了8.53%;土壤磷酸酶与蔗糖酶的趋势接近(图12),T1,T2均较CK有所降低,T3较CK提高了3.58%。

图4不同处理Ca2+含量
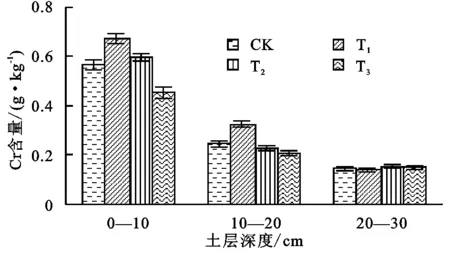
图5不同处理Cl-含量




3 讨 论
3.1 隔盐层对土壤主要盐离子的影响
土壤中的盐离子随着水分的蒸发一起向地表迁移,使下层土壤的盐分不断向上层聚集。设置隔沙层后,由于隔盐层物料和土壤毛管孔隙度的不同,使其阻断了上下土层间的水力联系,改变了土壤水分到沙层下界面时的运行速度和轨迹,使随土壤水分迁移盐离子在沙层下界面积累,盐分在上层土壤的积累减少[18]。
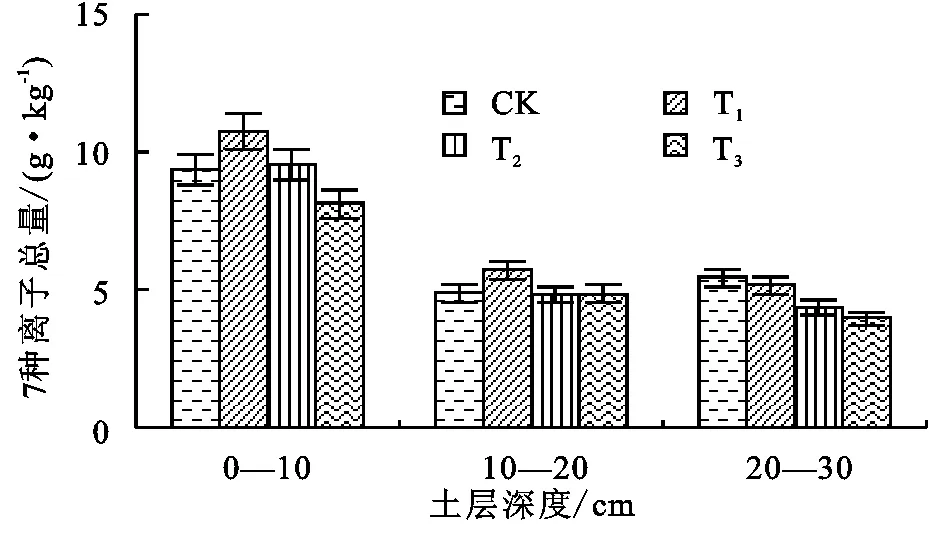
图8不同处理7种离子总含量
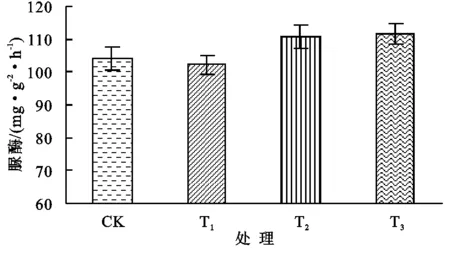
图9不同处理脲酶活性
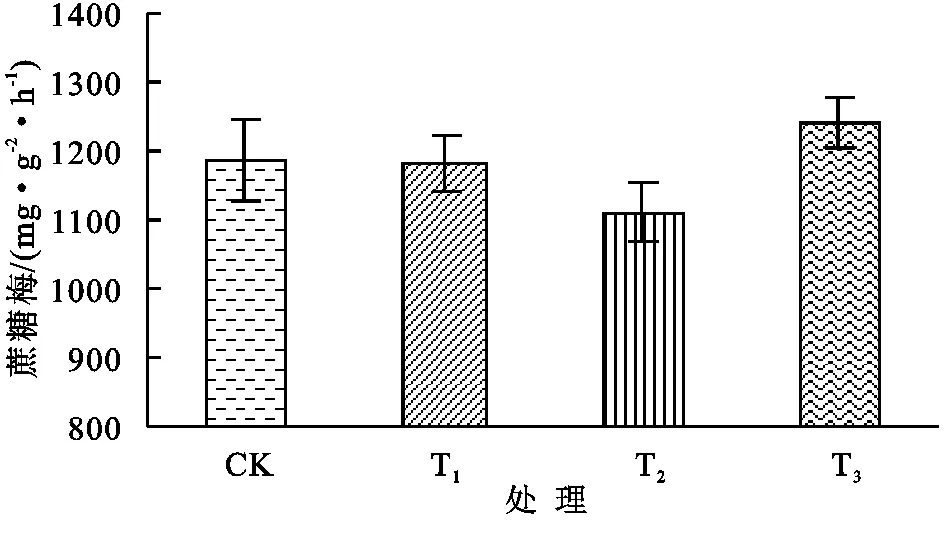
图10不同处理蔗糖酶活性

图11不同处理过氧化氢酶活性
砂层可以阻止水的入渗锋面向土砂界面以下渗入,直至水流在界面以上土体迅速聚积至所具有的能量大于砂层中水分的能量后,入渗水才能渗入砂层,可见砂层的在一定程度上增大了上层土体的储水能力,起到了阻水减渗作用[9]。砂砾层(T1)在本试验中0—30 cm土层的隔盐效果并不明显,可能与砂砾的粒度、设施小环境等有关,需进一步试验探究。生物炭具有丰富的孔隙结构,使其拥有巨大的比表面积,是一种良好的保水材料[19],将其作为隔盐层后,由于隔盐材料和土壤毛管孔隙度的不同,使得隔层以上的土壤水分运行到土壤—隔层界面时发生停滞,隔层以下的土壤水分迁移盐离子也在隔层下界面积累,盐分在上层土壤的积累减少。本试验中T2所用复合有机物料层(生物炭—菌渣)可在一定程度上降低土壤盐离子含量。T3(砂砾+复合有机物料层)为各处理中隔盐效果最优处理,0—30 cm土层平均降盐率达13.6%。设施土壤处于封闭状态,小气候因素明显,关于隔盐层的研究较少,在以后的研究中需进一步优化隔层参数,提高隔盐效果。

图12不同处理磷酸酶活性
3.2 隔盐层对土壤酶活性的影响
研究发现,对土壤酶活性的测定是最直接反映微生态状况的方法,也有研究者提出以脲酶、过氧化氢酶和磷酸酶所反映出的微生物学特性作为土壤环境质量变异的有效指标[14]。相对较高的盐含量抑制了脲酶、蔗糖酶、磷酸酶的活性,激发了过氧化氢酶活性升高。有报道称,当盐胁迫增强至一定程度时,过氧化氢酶活性降低[20],本试验未出现该现象,这可能与盐分含量有关。T1处理的7种盐离子总量高于其他处理,其过氧化氢酶也表现出相似的趋势,这也说明了盐胁迫促使过氧化氢酶活性的提高是其应激反应之一[20]。盐胁迫条件下,土壤中的微生物数量会减少,这势必会减少微生物向土壤中分泌的土壤酶量[21];另一方面,盐分使土壤环境发生改变,盐分产生的渗透胁迫及离子毒害都会抑制土壤酶的活性[22]。T3处理土壤含盐量较低,所受盐胁迫较弱,也表现出相似的特点,即脲酶、蔗糖酶和磷酸酶活性均有所提高。
4 结 论

(2)在设施土壤0—30 cm土层范围内,T3(砂砾+复合有机物料层)处理的脲酶、蔗糖酶、磷酸酶活性达较CK分别增加了7.30%,4.70%,3.58%,同时过氧化氢酶活性降低了8.53%,说明相对较高的盐含量可以抑制设施土壤中的脲酶、蔗糖酶、磷酸酶的活性,并激发了过氧化氢酶活性升高。
参考文献:
[1]张俊侠,孙德平,司友斌.设施土壤蔬菜栽培的障碍因子研究[J].安徽农学通报,2001(4):52-54.
[2]张金锦,段增强.设施菜地土壤次生盐渍化的成因、危害及其分类与分级标准的研究进展[J].土壤,2011,43(3):361-366.
[3]夏立忠,李忠佩,杨林章.大棚栽培番茄不同施肥条件下土壤养分和盐分组成与含量的变化[J].土壤,2005,37(6):620-625.
[4]孙凯宁,王克安,杨宁,等.轮作模式下设施菜地主要重金属元素空间分布特征[J].山东农业科学,2016,48(11):81-84.
[5]杜新民,吴忠红,张永清,等.不同种植年限日光温室土壤盐分和养分变化研究[J].水土保持学报,2007,21(2):78-80.
[6]王金龙,阮维斌.4种填闲作物对天津黄瓜温室土壤次生盐渍化改良作用的初步研究[J].农业环境科学学报,2009,28(9):1849-1854.
[7]施毅超,胡正义,龙为国,等.轮作对设施蔬菜大棚中次生盐渍化土壤盐分离子累积的影响[J].中国生态农业学报,2011,7(3):548-553.
[8]张生田.增施生物有机肥和改良剂对设施蔬菜土壤次生盐渍化的改良效果研究[J].北方园艺,2011(12):52-54.
[9]张莉,丁国栋,王翔宇,等.隔沙层对盐碱地土壤水盐运动的影响[J].干旱地区农业研究,2010,28(2):197-200,207.
[10]郭相平,杨泊,王振昌,等.秸秆隔层对滨海盐渍土水盐运移影响[J].灌溉排水学报,2016,35(5):22-27.
[11]翟鹏辉,李素艳,孙向阳,等.隔盐层对滨海地区盐分动态及国槐生长的影响[J].中国水土保持科学,2012,10(4):80-83.
[12]王婧,逄焕成,任天志,等.地膜覆盖与秸秆深埋对河套灌区盐渍土水盐运动的影响[J].农业工程学报,2012,28(15):52-59.
[13]谢显传,张少华,王冬生,等.阿维菌素对蔬菜地土壤微生物及土壤酶的生态毒理效应[J].土壤学报,2007,44(4):740-743.
[14]刘云国,李欣,徐敏,等.土壤重金属镉污染的植物修复与土壤酶活性[J].湖南大学学报:自然科学版,2002,29(4):108-113.
[15]Weretilnyk E A, Alexander K J, Drebenstedt M, et al. Main-taining methylation activities during salt stress: The involvement of adenosine kinase[J]. Plant Physiol.,2001,125(2):856-865.
[16]Chen S L, Li J K, Eberhard F, et al. Sodium and chloride distribution in roots and transport in three poplar genotypes under increasing NaCl stress[J]. For. Ecol. Man.,2002,168(1/3):217-230.
[17]严昶升.土壤肥力研究法[M].北京:农业出版社,1988.
[18]史文娟,沈冰,汪志荣,等.蒸发条件下浅层地下水埋深夹砂层土壤水盐运移特性研究[J].农业工程学报,2005,21(9):23-26.
[19]姚俊卿,侯建伟,索全义,等.不同炭化条件对黑沙蒿生物炭保水性能的影响[J].北方园艺,2017(6):171-176.
[20]周德平,吴淑杭,褚长彬,等.盐胁迫对蔬菜地土壤微生物及土壤酶活的毒害效应[J].农业环境科学学报,2011,30(8):1602-1607.
[21]Sardinha M, Muller T, Schmeisky H, et al. Microbial performance in soils along a salinity gradient under acidic conditions [J]. Applied Soil Ecology, 2003,23(3):237-244.
[22]刘善江,夏雪,陈桂梅,等.土壤酶的研究进展[J].中国农学通报,2011,27(21):1-7.
