青蒿琥酯对热化疗诱导人结肠上皮细胞损伤的保护机制研究
2018-04-11蒋师张兴强
蒋师,张兴强
(1.恩施土家族苗族自治州中心医院 消化内科,湖北 恩施 445000;2.恩施土家族苗族自治州中心医院 放射科,湖北 恩施 445000)
胃肠道肿瘤术后常常会因为腹腔内残留游离的肿瘤细胞或残留的微小癌灶导致肿瘤的复发,而研究报道温热化疗可以有效杀灭游离的肿瘤细胞或残留的微小癌灶,可以有效预防复发和提高患者的生存率。然而温热化疗在杀灭肿瘤细胞时,对周围增生活跃正常的结肠上皮细胞也会带来损害,临床上主要表现为恶心、呕吐和腹泻等不良反应[1]。研究发现产生这些不良反应的机制主要是温热化疗可以激活p53向细胞核内的转移,而引起结肠上皮细胞的凋亡[2-3]。前期研究报道p53抑制剂能够有效抑制不同刺激因素对p53的激活作用,从而抑制正常细胞的损伤[4-5]。青蒿琥酯(Artesunate)是青蒿素的一种半合成衍生物,与青蒿素一样对疟疾的治疗效果较显著,而且还具有抗炎和抗细胞凋亡的作用[6]。因此,本实验主要探讨青蒿琥酯对热化疗诱导人结肠上皮细胞损伤的保护作用,并初步研究了青蒿琥酯对ERK/P53信号通路活化的影响。
1 材料及仪器
1.1 材料
青蒿琥酯(百灵威科技有限公司,批号:88495630,≥98%);顺铂、二甲基亚砜和碘化丙啶(Sigma公司);HIEC培养基(美国ScienCell公司)、抗细菌/真菌溶液(美国ScienCell公司)、IV型胶原酶溶液(美国Sigma公司)、I型胶原酶溶液(美国Sigma公司)、胰蛋白酶(美国Sigma公司);CCK-8试剂盒(北京智杰方远科技有限公司);BCA蛋白浓度测定试剂盒(上海谷歌生物有限公司,批号:P0012S-07);Annexin V-FITC/PI试剂盒(北京嘉美纽诺生物科技有限公司);Western Blot发光试剂盒、β-actin、ERK、p-ERK、p53和p-p53一抗(美国Cell Signaling Technology),Bax、MDM2一抗(Abcam公司)。
1.2 仪器
单人超净台(北京六一仪器厂);CB15C02细胞培养箱(北京六一仪器厂);Victor3 1420 Multilable Counter酶标仪(美国BD,FACS AriaIII);HD-3000凝胶成像仪(上海上天精密仪器有限公司);Millipore流式细胞仪(北京维欣仪奥科技发展有限公司)。
2 方法
2.1 原代人结肠上皮细胞分离培养
取结肠组织置于无菌培养皿中,加入抗细菌/真菌溶液清洗干净,将组织剪成1mm3组织块。将组织块放入离心管中,用PBS反复吹打、洗涤5次。静置30 min,弃去PBS,加入0.1% IV型胶原酶溶液+0.1% I型胶原酶溶液(1∶1)混合消化液,消化30 min。消化完毕,用吸管反复吹打5 min,静置1 min,将上清液移至另一离心管中。重复上述步骤2~3次,收集上清液,1000 r·min-1离心5 min,弃上清液,加入培养基吹打,再1000 r·min-1离心5 min,重复上一步骤5~6次后加入培养液将细胞密度调节至4~5×104·mL-1,直接在培养瓶或板上种植。于37 ℃、5% CO2的培养箱中培养。每2 d换1次培养液,并在倒置显微镜下观察细胞生长状态[7]。
2.2 分组及处理
取对数生长期的人结肠上皮细胞,加入胰酶消化、计数、重悬后,取适量细胞数的重悬液加入96孔板或6孔板中,分别用于后续的CCK8实验和细胞凋亡检测、Western Blot分析,待细胞贴壁生长至80%~90%左右时,将人结肠上皮细胞分为3组:即正常对照组(CON)、热化疗组(HTC,将顺铂溶解稀释终质量浓度为10 mg·L-1处理细胞,在43 ℃恒温水浴箱中孵育30 min后,再用无菌的PBS溶液清洗细胞3次,加入培养基后将细胞继续培养2 h)、热化疗+不同浓度青蒿琥酯组[HTC+Ar,青蒿琥酯用DMSO进行溶解,在热化疗作用前4 h用完全培养基将药物浓度稀释为0.1、0.2、0.4 mmol·L-1(此时DMSO浓度均低于1‰)加入细胞中,然后的处理过程同热化疗组,在热化疗处理结束后,用无菌的PBS溶液清洗细胞3次,加入含不同浓度青蒿琥酯的培养基后将细胞继续培养2 h]。
2.3 CCK-8实验
按2.2分组处理细胞后,弃旧培养基,每孔加入含10 μL CCK-8试剂的新鲜培养基100 μL,每组设置6个复孔。继续培养1 h后置于酶标仪中450 nm处测定吸光度(A)值,并按公式(1)计算细胞的相对存活率。
细胞存活率(%)=(A实验组-A空白组)/(A对照组-A空白组)
(1)
2.4 细胞凋亡检测
按2.2分组处理细胞后,收集各组人结肠上皮细胞,与4 ℃、2000 r·min-1离心5 min后,用预冷的PBS重悬、离心,弃上清液后再次重悬离心,加Annexin V-FITC 溶液5 μL和PI溶液2.5 μL到100 μL细胞悬浮液中,混匀后避光反应10 min,加150 μL样品稀释液到样品中,混匀后上机检测,然后利用美国B-DFACSort Cell Quest软件做DNA分析,计算细胞凋亡率。
2.5 免疫印迹检测
按2.2分组处理细胞后,收集各组人结肠上皮细胞,加入RIPA裂解液充分裂解细胞,BCA试剂检测各组蛋白浓度,再加入蛋白上样缓冲液,于100 ℃加热煮沸10 min。每孔加入50 μg蛋白上样,在12%的SDS-PAGE凝胶中电泳分离,浓缩胶电泳分离时电压设置为70 V;分离胶电泳时电压设置为120 V;分离完成后在275 mA电流转膜70 min;再将NC膜用5%脱脂奶粉室温封闭1 h;一抗孵育过夜后,再二抗常温下孵育1 h,洗膜3次,显色成像,然后采用Quantity One 4.6.2 analysis software软件进行半定量分析。
2.6 统计分析
3 结果
3.1 青蒿琥酯对人结肠上皮细胞增殖的影响
青蒿琥酯对热化疗诱导人结肠上皮细胞增殖情况如图1所示,热化疗组细胞增殖率显著低于空白对照组(P<0.05);而经过低、中、高剂量青蒿琥酯处理后,细胞相对存活率显著高于热化疗组,差异均有统计学意义(P<0.05)。随着青蒿琥酯浓度上升,细胞增殖率显著上升,说明青蒿琥酯呈浓度依赖性改善热化疗诱导人结肠上皮细胞的损伤。
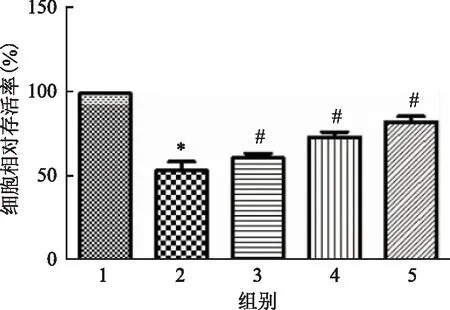
注:与空白对照组比较,*P<0.05;与热化疗组比较,#P<0.05;1.空白对照组;2.热化疗组;3.热化疗+0.1 mmol·L-1青蒿琥酯组;4.热化疗+0.2 mmol·L-1青蒿琥酯组;5.热化疗+0.4 mmol·L-1青蒿琥酯组;下同。图1 青蒿琥酯对人结肠上皮细胞增殖的影响(n=6)
3.2 青蒿琥酯对热化疗诱导人结肠上皮细胞凋亡的影响
人结肠上皮细胞自然凋亡率为(2.47±0.51)%,热化疗损伤后细胞凋亡率达到(25.26±2.47)%,与对照组相比差异有统计学意义(P<0.05)。青蒿琥酯呈浓度依赖性抑制热化疗引起的人结肠上皮细胞凋亡,凋亡率由(19.65±2.04)%逐渐下降至(7.28±0.73)%,与热化疗组相比凋亡率之间的差异均有统计学意义(P<0.05),结果见表1、图2。
表1 各组人结肠上皮细胞的凋亡率
注:与空白对照组比较,*P<0.05;与热化疗组比较,#P<0.05。

注:A.空白对照组;B.热化疗组;C.热化疗+0.1 mmol·L-1青蒿琥酯组;D.热化疗+0.2 mmol·L-1青蒿琥酯组;E.热化疗+0.4 mmol·L-1青蒿琥酯组。图2 各组代表性细胞凋亡检测的流式细胞图
3.3 青蒿琥酯对ERK/P53信号通路的影响
青蒿琥酯对人结肠上皮细胞中ERK/P53信号通路活化情况的影响如图3所示。结果表明,热化疗组中p-ERK和p-P53表达水平显著高于空白对照组(P<0.05),说明热化疗可诱导ERK/P53信号通路活化。经过低、中、高剂量青蒿琥酯作用后,p-ERK和p-P53表达水平显著低于热化疗组,差异均有统计学意义(P<0.05)。随着青蒿琥酯浓度上升,p-ERK和p-P53表达水平显著降低,说明青蒿琥酯呈浓度依赖性影响热化疗诱导人结肠上皮细胞中ERK/P53信号通路活化。
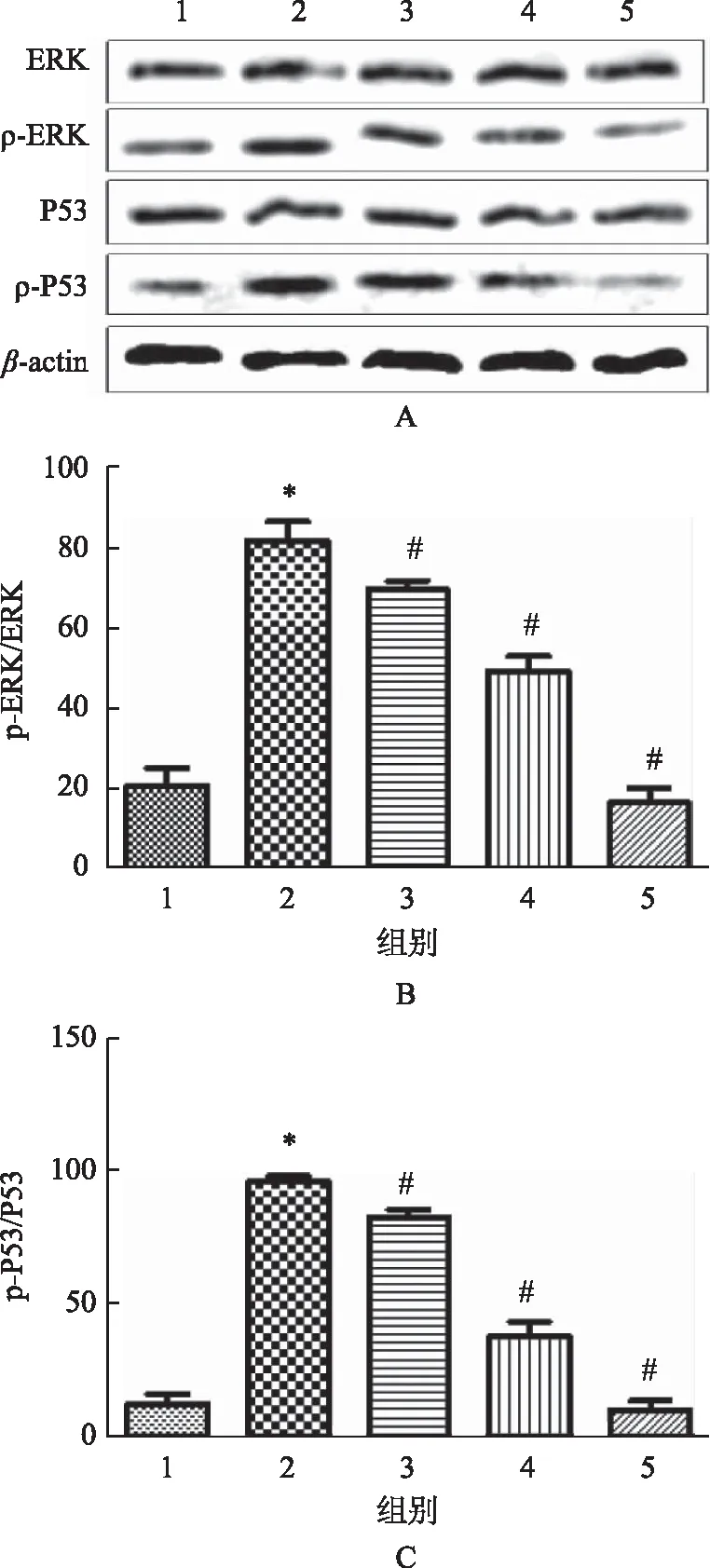
注:A.蛋白表达条带;B.ERK磷酸化水平;C.P53磷酸化水平。图3 青蒿琥酯对人结肠上皮细胞ERK/P53信号通路活化的影响(n=3)
3.4 青蒿琥酯对促凋亡蛋白Bax和MDM2表达的影响
青蒿琥酯对人结肠上皮细胞中促凋亡蛋白Bax和MDM2表达情况的影响如图4所示。结果表明,热化疗组中Bax和MDM2表达水平显著高于空白对照组(P<0.05)。经过低、中、高剂量青蒿琥酯作用后,Bax和MDM2表达水平显著低于热化疗组,差异均有统计学意义(P<0.05)。随着青蒿琥酯浓度上升,Bax和MDM2表达水平显著降低,说明青蒿琥酯呈浓度依赖性抑制热化疗诱导人结肠上皮细胞中促凋亡蛋白的表达。

注:A.蛋白表达条带;B.Bax表达水平;C.MDM2表达水平。图4 青蒿琥酯对人结肠上皮细胞中Bax和MDM2蛋白表达的影响(n=3)
4 讨论
前期研究报道ERK/P53信号通路的缺失或突变在较多肿瘤中均有出现,其中P53基因的缺失能够引起基因的不稳定性、肿瘤恶化加剧及机体对抗肿瘤药物产生耐药等。一般报道P53的缺失也许是不利的,于是在恶性癌症治疗中更多的是恢复P53的功能。然而,P53的功能不仅仅体现在对肿瘤细胞的杀伤作用,同时P53在许多正常组织中也存在较高的表达,在抗肿瘤的治疗过程中会对周围的正常组织或器官带来一定的损伤。因此,在前期较多研究中发现,肿瘤的化疗、放疗及腹腔温热灌注化疗常常引起显著的不良反应,从而降低了抗肿瘤的作用效果,并且这种不良反应的产生主要是P53介导的细胞凋亡所导致的[4-5]。
腹腔内温热灌注化疗是腹腔肿瘤扩散的有效治疗方案,然而对增生活跃的正常组织也会同时造成伤害。顺铂是一种常见的抗肿瘤药物,其作用机制是与DNA双链结合形成交链,抑制DNA合成而引起细胞周期停滞和细胞凋亡的出现,而温热可促进细胞对顺铂的摄取,提升顺铂的抗肿瘤作用[8-10]。本研究利用原代人结肠上皮细胞为体外研究模型,采用顺铂联合温热法处理细胞诱导、细胞凋亡的发生,P53蛋白活化程度明显升高,其中促凋亡蛋白Bax和MDM2表达明显上升。用青蒿琥酯预处理细胞后可降低ERK/P53信号通路的活化,进一步抑制促凋亡蛋白Bax和MDM2的表达,而使MDM2与P53结合减少,并抑制Bax启动子上P53反应元件,从而达到对人结肠上皮细胞的保护作用,改善细胞的相对存活率。
值得注意的是,一些研究报道青蒿琥酯能够诱导肿瘤细胞的凋亡,其促凋亡作用机制研究也较为明确,主要包括降低线粒体跨膜电位、促进细胞内凋亡物质的释放及诱导Caspase的激活、抑制NF-κB信号通路及抑制Cox-2的表达等方式来达到促凋亡的作用[11]。而本文中青蒿琥酯可以抑制热化疗诱导的人结肠上皮细胞凋亡,起着抗凋亡的作用,其作用机制可能与抑制ERK/P53信号通路活化和抑制促凋亡基因Bax及MDM2的表达有关,由此说明青蒿琥酯在不同细胞类型中可以通过不同的信号通路来达到不同的药理作用效果。综上所述,青蒿琥酯在细胞凋亡方面起着双向调节作用,当青蒿琥酯作用促凋亡和抗凋亡信号通路时,若对促凋亡信号通路的作用强于抗凋亡通路,便会表现出促凋亡的作用效果,反之亦然。于是,青蒿琥酯可以打破促/抗凋亡通路的平衡,并且最终表现的作用效果与相关作用机理的强弱相关。
最后,本实验在体外初步研究了不同浓度青蒿琥酯对热化疗引起的人结肠上皮细胞损伤的保护作用,实验结果也证实了该药物具有一定的保护效果,在后期会进一步进行动物实验,探讨该药物对热化疗动物的保护作用,以期为减轻抗肿瘤不良反应的临床运用奠定基础。
[1]张安平,刘宝华,张连阳,等.p53抑制剂对热化疗损伤结肠上皮细胞p53、Bax和MDM2表达的影响[J].消化外科,2006,5(5):340-344.
[2]Van der Vange N,Van Goethem A R,Zoetmulder F A,et al.Extensive cytoreductive surgery combined with intra-operative intraperitoneal perfusion with cisplatin under hyperthermic conditions(OVH IPEC)in patients with recurrent ovarian cancer:a feasibility pilot[J].Eur J Surg Oncol,2015,26(7):663-668.
[3]Shen P,Levine E A,Hall J,et al.Factors predicting survival after intraperitoneal hyperthermic chemotherapy with mitomycin C after cytoreductive surgery for patients with peritoneal carcinomatosis [J].Arch Surg,2013,138(1):26-33.
[4]Komarov P G,Komarova E A,Ko ndratov R V,et al.A chemical inhibitor of p53 that protects mice from the side effects of cancer therapy[J].Science,2009,285(5434):1733-1737.
[5]Komarova E A,Gudkov A V.Chemo protection from p53-dependent apoptosis:potential clinical applications of the p53 inhibitors[J].Biochem Pharmacol,2016,62(6):657-667.
[6]胡玉贞,李淼,张桐桐,等.青蒿琥酯脂质体粉雾剂的制备及其治疗大鼠急性肺损伤的作用[J].药学学报,2016,51(12):1906-1912.
[7]张伟平,聂占国,代忠明,等.人结肠上皮细胞的原代培养[J].现代肿瘤医学,2012,20(8):1546-1548.
[8]Ryu K S,Kim J H,Ko H S,et al.Effects of intra peritonealhy per the rmic chemotherapy in ovarian cancer[J].Gynecol Oncol,2014,94(2):325-332.
[9]Piso P,Dahlke M H,Loss M,et al.Cytoreductive surgery and hy perthermicintraperitoneal chemotherapy in peritoneal carcinomatosis from ovarian cancer[J].World J Surg Onco,2004,2(1):21.
[10] Hall J J,Loggie B W,Shen P,et al.Cytoreductive surgery with intraperitoneal hyperthermic chemotherapy for advanced gastric cancer [J].J Gastrointest Surg,2004,8(4):454-463.
[11] 李异兴,李曦雯,农晓琳.青蒿琥酯抗肿瘤作用机制与临床应用的研究进展[J].天然产物研究与开发,2016,28(12):986-989.
