基于氧化应激探讨松龄血脉康对自发性高血压大鼠血管的保护机制
2018-04-11施伟丽信琪琪滕传震丛伟红
施伟丽,袁 蓉,信琪琪,徐 磊,滕传震,丛伟红*
(1.中国中医科学院西苑医院,北京 100091;2.北京中医药大学,北京 100029;3.成都康弘制药有限公司,四川 成都 610036)
血管收缩和舒张功能障碍是血压异常的关键环节,氧化应激是血管损伤的重要因素。越来越多的研究提示,氧化应激参与高血压病的发生和发展,其机制可能与氧化损伤血管内皮,影响血管功能有关[1-2]。这也提示,药物通过调节血管氧化应激水平、恢复血管功能,可能成为治疗高血压病新的探索方向。本课题组前期实验结果表明松龄血脉康胶囊能降低自发性高血压大鼠的血压[3],同时提示其降压作用可能与抗氧化应激有关。故本研究借助qPCR阵列技术及String数据库,以自发性高血压大鼠为模型,进一步研究松龄血脉康对血管的保护作用,以期为松龄血脉康的临床应用提供参考。
1 材料
1.1 实验动物
9周龄SPF级雄性Wistar Kyoto大鼠(WKY)10只,自发性高血压大鼠40只,均购自北京维通利华实验动物有限公司,合格证书号SYXK(京)2012-0012。饲养于中国中医科学院西苑医院SPF级动物房,自由饮水及取食。
1.2 实验药物及试剂
松龄血康胶囊由成都康弘有限公司提供(批号160216),该胶囊主要由鲜松叶、葛根、珍珠层粉组成,0.5 g/粒;氯沙坦钾片由杭州默沙东制药有限公司提供(批号L016172),100 mg/粒。
1.3 试剂
一步法NO试剂盒(批号A013-2)、丙二醛(MDA)测试盒(批号20160804)、SOD试剂盒(WST-1法)(批号A001-3)均购自南京建成生物有限公司。RNA提取试剂盒(批号11667165001)购自Roche公司,All-in-One™First-Strand cDNA 合成试剂盒(批号AORT-0050),Allin-OneTM qPCR Mix及引物(批号AOPR-0200),购自GeneCopoeia公司。
1.3 实验仪器
脱水机(武汉俊杰电子有限公司:JJ-12J),包埋机(武汉俊杰电子有限公司:JB-P5),病理切片机(上海徕卡仪器有限公司:RM2016),组织摊片机(浙江省金华市科迪仪器设备有限公司:KD-P),烤箱(上海慧泰仪器制造有限公司:DHG-9140A),酶标仪(Biotek:Stnergy-4),正置光学显微镜(日本尼康:ECLIPSE CI),成像系统(日本尼康:DS-U3),LightCycler480 PCR仪(美国罗氏)。
2 实验方法
2.1 分组及给药方法
40只9周龄雄性自发性高血压大鼠适应性饲养1周后,随机分为4组(模型组、氯沙坦钾组、高剂量松龄血脉康组和常规剂量松龄血脉康组),每组10只,以WKY大鼠为正常对照组。氯沙坦钾片研磨后按每天31.5 mg·kg-1灌胃给药,高剂量松龄血脉康组以每天1g·kg-1灌胃,常规剂量松龄血脉康组以每天0.5g·kg-1灌胃,模型组及正常对照组给予等体积生理盐水,给药9周。
2.2 病理组织学检测
胸主动脉用福尔马林固定、石腊包埋、切片后Masson染色,观察主动脉纤维化程度。
2.3 血清氧化因子检测
血清NO、SOD和MDA检测均用南京建成生物工程研究所制备的试剂盒,其中NO采用硝酸还原酶法,SOD活力测定用黄嘌呤氧化酶法,MDA检测用硫代巴比妥酸法。操作按试剂盒说明书要求进行,根据各孔的吸光度计算浓度及活力。
2.4 qPCR阵列检测
模型组和高剂量松龄血脉康胶囊组分别提供5个主动脉组织,用All-in-OneTM first-strand cDNA synthesis试剂盒将提取的RNA逆转录为cDNA;后将All-in-OneTM qPCR mix与cDNA模板混合,将混合液滴入qPCR阵列孔中;Real-time PCR仪中反应;用GeneCopoeia的网上数据分析工具分析数据。
2.5 所得差异基因的网络分析
结合String(http://www.string-db.org)数据库对所得基因进行网络分析。
2.6 数据统计方法
采用SPSS 20.0统计软件对数据进行分析,计量资料以“±s”表示,采用t检验;计数资料以例数(n),百分数(%)表示,采用x2检验。以P<0.05为差异有统计学意义。
3 结 果
3.1 松龄血脉康胶囊对主动脉纤维化程度影响
通过马松染色可以观察主动脉纤维化程度,从图1-A2、B2中可以看出模型组主动脉内中膜厚度增加,同时胶原纤维增生明显(蓝绿色胶原纤维增生明显,掩盖正常红色肌纤维)。药物干预后与模型组比较,氯沙坦钾组、松龄血脉康高剂量组主动脉内中膜厚度减小,同时胶原纤维增生程度减轻,红色平滑肌纤维尚清晰(见图1)。
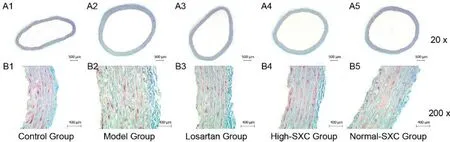
图1 松龄血脉康胶囊对主动脉纤维化程度影响
3.2 松龄血脉康胶囊对血清中氧化应激因子的影响
NO水平的消长是调节氧化和抗氧化的关键环节,与对照组比较,高血压模型组血清NO浓度明显降低(P<0.01),MDA浓度明显升高(P<0.05),提示自发性高血压大鼠血清氧化能力增强。各组间SOD活力未见明显变化(P>0.05)。给药后,与模型组比较,氯沙坦钾组NO浓度显著升高(P<0.01),MDA浓度显著降低(P<0.001)。松龄血脉康大剂量组和中剂量组MDA浓度较模型组均明显降低(P<0.001),NO浓度较模型组有升高趋势,但未见明显统计学意义(P>0.05)。见表1。
表1 松龄血脉康胶囊对血清中氧化应激因子的影响(±s)

表1 松龄血脉康胶囊对血清中氧化应激因子的影响(±s)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,△△P<0.01,△△△P<0.001;与氯沙坦钾组比较,##P<0.01。
组别 n NO(umol·L-1) SOD(U·ml-1) MDA(nmol·ml-1)对照组 10 2.49±0.63 230.71±49.03 6.41±1.17模型组 10 1.77±0.67** 206.41±44.88 8.10±1.69*氯沙坦钾组 10 2.61±0.83△△ 228.51±53.52 6.31±1.37△△△SLXM大剂量组 10 2.22±0.61 220.81±55.16 6.18±1.17△△△SLX常规剂量组 10 1.95±0.6*## 221.02±39.2 6.44±0.81△△△
3.3 松龄血脉康胶囊对氧化应激相关基因的调控分析
3.3.1 松龄血脉康组与模型组比较,差异表达基因结果
本研究通过qPCR阵列检测,共筛到75个有变化基因。高剂量松龄血脉康组与模型组比较差异倍数大于2的基因有9个,其中Gch1、FOS、IGF1R基因上调,PIK3CG、GPx2、CAV1、SOD1、PTEN、HSPA1B基因表达量下调(见表2)。
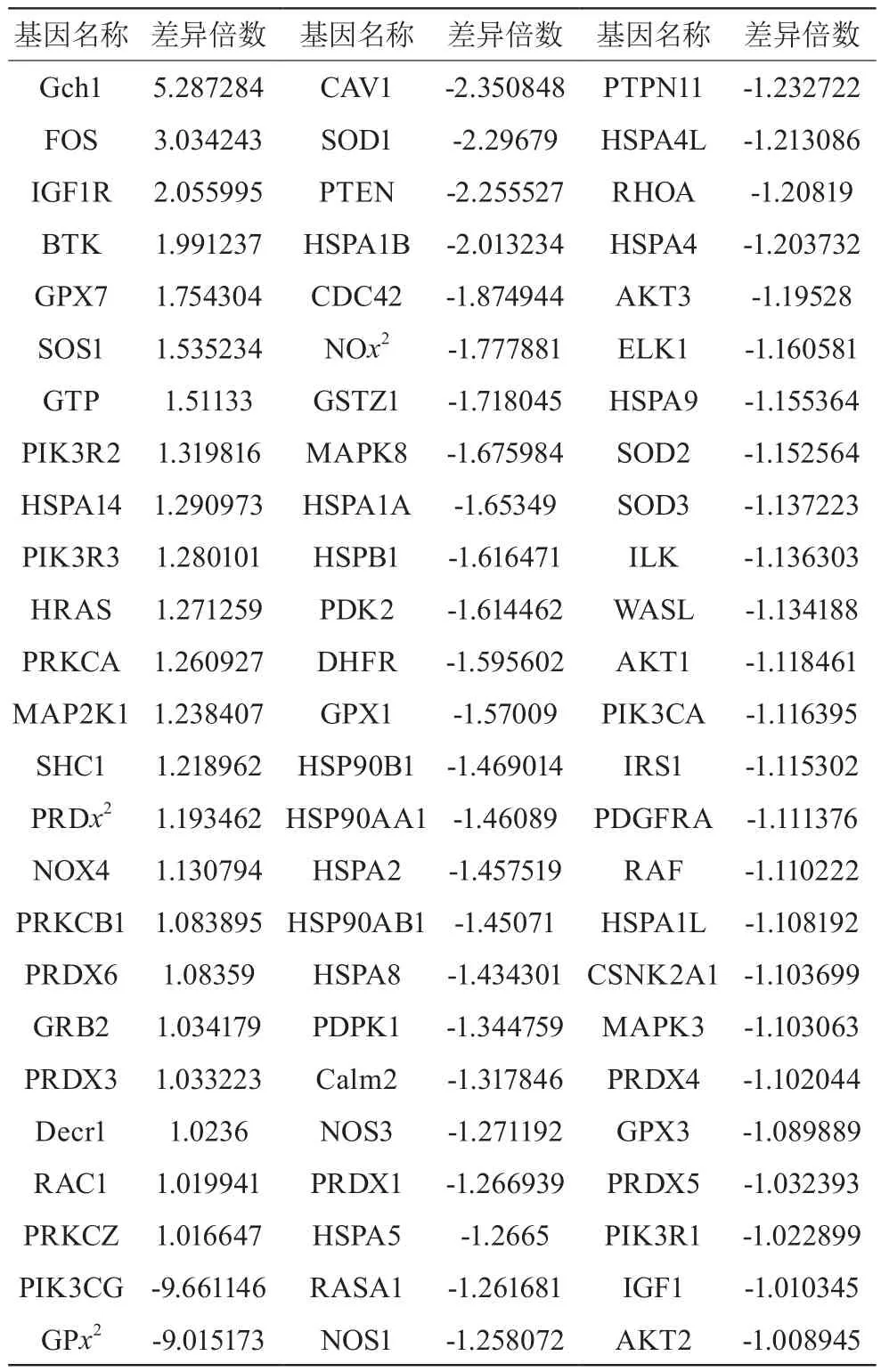
表2 松龄血脉康对氧化应激相关基因影响
3.3.2 借助String数据平台对差异表达基因分析结果
String数据库能够对多个基因进行网络分析,将差异表达基因Gch1、FOS、IGF1R、PIK3CG、GPx2、CAV1、SOD1、PTEN及HSPA1B放入该数据库进行分析得到。见图2。从图中可以看出FOS、IGF1R、PIK3CG、CAV1及PTEN关系密切,通过查阅文献发现IGF1R及CAV1与氧化应激密切相关。
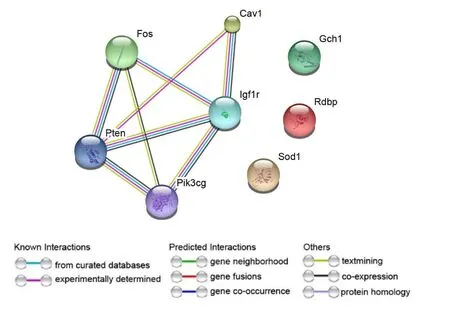
图2 差异表达基因网络分析图
4 讨 论
高血压病是遗传和环境因素共同作用的结果,其发病机制尚未完全明确,目前认为血压异常升高与肾素-血管紧张素醛固酮系统激活、交感神经异常兴奋、钠摄入过多等有关,不管何种因素,均无法全面解释高血压病的机制。随着对高血压机制研究的深入,人们越来越认识到氧化应激在高血压病中的重要作用。松龄血脉康胶囊主由葛根、鲜松叶、珍珠层粉组成,具有平肝潜阳、镇心安神的功效。长期持续高血压可引起全身动脉疾病,表现为动脉中层平滑肌细胞增殖和纤维化、管壁增厚和管腔狭窄,本研究中松龄血脉康胶囊能改善动脉纤维化程度,但这种药效是继发于大鼠血压的下降,还是药物直接作用于动脉获得的疗效,还尚待研究。此外,松龄血脉康可减轻长期高血压状态下大鼠主动脉氧化应激损伤,该作用可能与松龄血脉康调节小凹蛋白(caveolin,CAV1)和胰岛素样生长因子1受体(insulin-like growth factor 1 receptor,IGF1R)基因表达有关。
小凹是由小凹蛋白、胆固醇及鞘脂共同组成的具有转运胆固醇、信号传导等功能的细胞结构。小凹蛋白是组成小凹的主要骨架蛋白,可负性调控众多蛋白酶活性。CAV1是小凹形成不可缺少的的关键蛋白之一,在血管内皮细胞、平滑肌细胞分布广泛,可通过其脚手架域中相关的氨基酸残基来实现其对其他蛋白活性的调控[4]。内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)是细胞膜小凹上发现的第一个非受体蛋白,研究发现,CAV1通过其脚手架域,与eNOS相互作用并抑制eNOS活性,负性调控NO生成[5]。Drab等[6]用CAV1基因敲除小鼠,发现基础状态下NO、cGMP的表达都明显高于野生型鼠,缺少CAV1蛋白小鼠的主动脉缺乏稳定的收缩力,乙酰胆碱干预后舒张反应增加,对苯肾上腺素的反应降低。提示CAV1的缺少可能使肌张力降低,全身血压下降[7]。本研究中CAV1基因表达下调,提示松龄血脉康胶囊可能通过降低CAV1表达,增加NO生成。
胰岛素样生长因子1(insulin-like growth factor 1,IGF1)是一种多肽类物质,是体内多种细胞自分泌和旁分泌的产物。在体内有胰岛素样作用,在体外能促进细胞增殖。在氧化应激状态下,血管平滑肌细胞IGF1R表达受到抑制,这可能与p53和HDAC蛋白激活有关[8]。Baregamian等[9]用过氧化氢氧化损伤大鼠肠上皮细胞,发现通过抑制IGF1R的表达,增加细胞凋亡,提示IGF1R有抗氧化应激保护肠上皮细胞的作用。Amina等[10]用6-羟基多巴胺注入大鼠纹状体,制作多巴胺缺乏的帕金森模型,后给予IGF1治疗,发现IGF1能保护黑质和纹状体,减少氧化损伤,同时也发现这种保护作用先于AKT、ERK1/2等促生存因子的激活,提示IGF1同样有抗氧化应激作用。本研究中大剂量松龄血脉康组IGF1R基因表达量较模型组上调2倍,提示IGF1R可能参与主动脉的氧化应激中,松龄血脉康可能通过调节IGF1R表达抗氧化应激、保护血管功能。
受体内化不仅仅是结束受体及配体的活性态,同时是其调控下游效应器的调节信号。Martins等[11]研究发现CAV1参与尤文肉瘤细胞质膜上IGF1受体内化,对IGF1受体内化有抑制作用,下游AKT和MAPK磷酸化也会受到抑制。Tang等[12]也发现在肝癌细胞中,CAV1过表达能增加IGF1R表达从而激活PI3K/Akt及RAF/MEK/ERK通路。可见CAV1与IGF1R关系密切。但这些研究仅限于肿瘤实验,在高血压及氧化应激中CAV1是否影响IGF1R活性尚待深入。
[1] Guzik T J,Touyz R M.Oxidative Stress,Inflammation,and Vascular Aging in Hypertension[J].Hypertension,2017:117-7802.
[2] Dikalov S I,Dikalova A E.Contribution of mitochondrial oxidative stress to hypertension[J].Curr Opin Nephrol Hypertens,2016,25(2):73-80.
[3] 施伟丽,王 燕,信琪琪,等.松龄血脉康胶囊对自发性高血压大鼠高血压相关基因表达的影响[J].中国中医基础医学杂志,2017(05):634-637.
[4] Bucci M,Gratton J P,Rudic R D,et al. In vivo delivery of the caveolin-1 scaffolding domain inhibits nitric oxide synthesis and reduces inflammation[J].Nat Med,2000,6(12):1362-1367.
[5] Dessy C,Feron O,Balligand J.The regulation of endothelial nitric oxide synthase by caveolin:a paradigm validated in vivo and shared by the 'endothelium-derived hyperpolarizing factor'[J].Pflügers Archiv-European Journal of Physiology,2010,459(6):817-827.
[6] Drab M,Verkade P,Elger M, et al.Loss of caveolae,vascular dysfunction,and pulmonary defects in caveolin-1 gene-disrupted mice[J].Science,2001,293(5539):2449-2452.
[7] Albinsson S, Shakirova Y, Rippe A, et al. Arterial remodeling and plasma volume expansion in caveolin-1-deficient mice[J].AJP: Regulatory, Integrative and Comparative Physiology,2007,293(3):R1222-R1231.
[8] Kavurma M M,Figg N,Bennett M R,et al.Oxidative stress regulates IGF1R expression in vascular smooth-muscle cells via p53 and HDAC recruitment[J].Biochem J,2007,407(1):79-87.
[9] Baregamian N,Song J,Chung D.Effects of Oxidative Stress on Intestinal Type I Insulin-Like Growth Factor Receptor Expression[J].European Journal of Pediatric Surgery,2012,22(01):97-104.
[10] Ayadi A E,Zigmond M J,Smith A D.IGF-1 protects dopamine neurons against oxidative stress:association with changes in phosphokinases[J]. Exp Brain Res,2016,234(7):1863-1873.
[11] Martins A S,Ordonez J L,Amaral A T, et al. IGF1R signaling in Ewing sarcoma is shaped by clathrin-/caveolin-dependent endocytosis[J].PLoS One,2011,6(5):e19846.
[12] Tang W,Feng X,Zhang S,et al.Caveolin-1 Confers Resistance of Hepatoma Cells to Anoikis by Activating IGF-1 Pathway[J].Cell Physiol Biochem,2015,36(3):1223-1236.
