黄芪多糖对人子宫内膜癌裸鼠皮下移植瘤Wnt基因转导通路的影响
2018-04-10邱艳丽陈德森
邱艳丽,丁 妍, 陈德森
(1. 湖北省十堰市太和医院(湖北医药学院附属医院),湖北 十堰 442000;2. 湖北医药学院基础医学院,湖北 十堰 442000)
子宫内膜癌(EC)是妇科三大恶性肿瘤之一,占妇科恶性肿瘤的70%以上,病死率仅次于卵巢癌,其发病率呈持续增高趋势,严重威胁着女性的生命健康[1-2]。Wnt基因转导通路中相关因子β-连环蛋白(β-catenin)、E-钙黏蛋白(E-cadherin)及其基因表达与子宫内膜癌的发生密切相关,Wnt通路能通过β-catenin或E-cadherin蛋白与胞膜受体特异性结合而引发一连串级联反应,最终引起细胞核内基因表达改变,Wnt通路异常调控与子宫内膜癌、宫颈癌等恶性肿瘤的发生有重要相关性[3-4]。目前抗肿瘤的中医药研究热点较多,如黄芪、当归等。黄芪多糖是中药黄芪的主要有效成分,具有抗肿瘤的药理作用[5],但其在抗子宫内膜癌方面鲜有研究。本研究通过观察黄芪多糖对人子宫内膜癌裸鼠皮下移植瘤Wnt基因转导通路中相关因子β-catenin和E-cadherin表达的影响,探讨了黄芪多糖抗子宫内膜癌的作用及可能机制,旨在为其临床应用提供一定的理论依据。
1 实验资料
1.1实验动物SPF级雌性BALB/c品系裸小鼠30只,鼠龄4~5周,体质量(17.5±2.5)g,购自湖北医药学院实验动物中心,许可证号:SCXK(鄂)2016-0008。采用随机数字表编号后随机分为对照组、模型组、黄芪多糖组,每组10只。
1.2药物和试剂黄芪多糖注射液(北京维德尔生物科技有限公司),按小鼠体表面积换算黄芪多糖注射液用量为0.2 mL/(kg·d);胎牛血清和DMEM培养基(GIBCO公司);β-catenin和E-cadherin两步法免疫组化检测试剂盒(北京博凌科为生物科技有限公司);β-catenin和E-cadherin引物(南京建成生物工程研究所);人子宫内膜癌细胞系Ishikawa肿瘤细胞(十堰市太和医院生物科学研究所提供)。
1.3人子宫内膜癌裸鼠皮下移植瘤模型建立及干预先将人子宫内膜癌细胞系Ishikawa肿瘤细胞接种于含10%胎牛血清的DMEM培养基,置于5% CO2、37 ℃孵育箱培养,0.25%胰蛋白酶消化传代。待Ishikawa肿瘤细胞呈对数生长期时,可观察到Ishikawa肿瘤细胞沿培养瓶底生长,当生长达培养瓶底75%~85%时,弃掉培养液,用PBS冲洗2次,再用0.25%胰蛋白酶消化,收集肿瘤细胞,1 000 r/min离心5 min,用PBS重悬肿瘤细胞,然后制成 5×105mL-1Ishikawa细胞悬液备用。接种时在无菌条件下抽取Ishikawa瘤细胞悬液,按0.2 mL/鼠的剂量皮下注射于裸鼠右侧肩胛背部。接种后继续在SPF级层流室内饲养,每天观察其右侧肩胛背部是否有肿瘤生长,以接种部位出现肿瘤小结节或触及有小结节为成瘤标准,一般4周后即可成瘤,如第1次接种失败,可酌情再次接种Ishikawa瘤细胞直到成瘤[6]。本实验4周后所有造模裸小鼠均成瘤。 成瘤后,黄芪多糖组给予黄芪多糖注射液0.2 mL/(kg·d)肌肉注射,对照组、模型组肌肉注射等量生理盐水,均连续14 d。
1.4检测指标和方法
1.4.1移植瘤抑瘤率检测实验结束后处死所有大鼠,摘取瘤体,分离包膜,称质量,用游标卡尺准确测量瘤体长、短径各3次,取其均值计算瘤体积。瘤体积=肿瘤长径×肿瘤短径/2。抑瘤率= (模型组平均瘤质量-黄芪多糖组平均瘤质量)/模型组平均瘤质量×100%。
1.4.2β-catenin和E-cadherin蛋白表达检测取瘤组织(对照组取子宫内膜组织),采用二步法行免疫细胞化学染色检测β-catenin和E-cadherin蛋白表达情况。E-cadherin和β-catenin阳性判定:细胞膜或细胞质棕黄色。在高倍视野下,每张切片均随机选取6个视野进行结果判定。记分采用3个参数的半定量分析:即阳性细胞数、染色强度及两者记分的乘积。判定标准:棕褐色3分,棕黄色2分,淡黄色1分,无着色0分;阳性细胞数量分级和记分标准:1个视野内阳性着色细胞>75%为4分,>50%~75%为3分,>10%~50%计 2分,1%~10%计1分;无阳性细胞为阴性,计0分。将染色强度和阳性细胞数量两项积分相加,结果判定:0~3分为阴性,4~7分为阳性[7]。
1.4.3β-catenin和E-cadherin mRNA表达检测采用半定量RT-PCR检测。取瘤体组织(对照组取子宫组织)约50 mg,匀浆,采用Trizol法提取组织中的总RNA,取1 μg 总RNA,用AMV逆转录酶逆转录,逆转录产物PCR扩增,以GAPDH为内参, PCR扩增用 pfimer5 软件设计引物。PCR反应条件:95 ℃ 2 min 变性,95 ℃、52 ℃ 30 s,72 ℃ 30 s,扩增40个循环。以目的基因灰度值/GAPDH灰度值之比值表示β-catenin和E-cadherin mRNA的相对值[8]。β-catenin上游引物序列为5’-AGGCACTGGGGCTTCATCTGAC-3,下游引物序列为5’-GCCTTCCATCCCTTTGCTTAG-3,扩增产物长度为201 kDa;E-cadherin上游引物序列为5’-CCATGTCCAAAAGTGGTGTAAT-3,下游引物序列为5’-ATGGATGCATTGAGTGAAGTA-3,扩增产物长度为134 kDa;GAPDH上游引物序列为5’-GGAGAAACCTGCCAAGTATGAT-3,下游引物序列为5’-GAGTTGCTGTTGAAGTCG-3,扩增产物长度为125 kDa。

2 结 果
2.1各组瘤质量、瘤体积及抑瘤率比较对照组无肿瘤形成;黄芪多糖组瘤质量、瘤体积均明显低于模型组(P均<0.05),抑瘤率明显高于模型组(P<0.05)。见表1。

表1 模型组和黄芪多糖组瘤质量、瘤体积及抑瘤率比较
注:①与模型组比较,P<0.05。
2.2各组β-catenin和E-cadherin蛋白及mRNA表达情况对照组子宫组织中仅有少量β-catenin阳性表达,E-cadherin高表达。模型组瘤组织中β-catenin蛋白和β-catenin mRNA表达水平均明显高于对照组(P均 <0.05),而黄芪多糖组均明显低于模型组(P均<0.05);模型组瘤组织中E-cadherin蛋白和E-cadherin mRNA表达水平均明显低于对照组(P均<0.05),而黄芪多糖组均明显高于模型组(P均<0.05)。见表2。
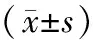
表2 各组β-catenin和E-cadherin蛋白及mRNA表达情况
注:①与对照组比较,P<0.05;②与模型组比较,P<0.05。
3 讨 论
子宫内膜癌早期发现后可采用手术和辅助放化疗治疗,但大多数患者临床确诊时已到中晚期,单纯采用西医治疗难以获得理想的疗效。中医药在延缓病情进展、提高患者生存质量等方面有其独特优势,故更多患者在手术和辅助放化后或治疗无望时求助于中医治疗[3]。中草药黄芪富含多种微量元素,如皂苷、叶酸、黄芪多糖、氨基酸等,其中黄芪多糖具有抗菌、抗炎、抗氧化、利尿、护肝、抗应激等作用[9-10],可增强自然杀伤细胞、巨噬细胞、B 淋巴细胞等的活性,并通过促进免疫因子释放强化机体免疫功能,促进细胞凋亡、抑制肿瘤细胞增殖而产生抑癌抗癌作用[11-12]。目前对黄芪的研究比较深入,临床应用也比较广泛,但黄芪多糖的抗肿瘤作用机制比较复杂,为此笔者进行了相关研究。
Wnt信号通路在胚胎的发育过程及多种肿瘤的发生发展中起重要的启动作用—Wnt通路被异常激活,而β-catenin是Wnt通路异常激活的关键因子。β-catenin作为癌基因,其与子宫内膜癌、乳腺癌、宫颈癌等恶性肿瘤的发生、发展及侵袭转移等密切相关[13]。Wnt信号通路分经典型和非经典型途径,经典Wnt信号通路蛋白与膜受体卷曲蛋白结合,通过β-catenin核易位来激活靶基因的转录活性,故经典Wnt信号通路与肿瘤发生发展密切相关[14]。研究表明,β-catenin如不能被糖原合成酶激酶3β磷酸化,可导致β-catenin不能被胞内泛素识别,不能被蛋白酶复合体降解,这造成的后果是β-catenin大量游离聚集于胞质中,当β-catenin进入胞核与核内转录因子T细胞因子/淋巴细胞增强因子等结合后会刺激一系列靶基因表达,包括发育控制基因、肿瘤发生相关基因和细胞增殖调控基因,引起细胞增殖异常并最终导致细胞癌变[15]。E-cadherin蛋白是钙依赖性黏附蛋白,广泛分布于上皮细胞膜黏附区,故正常上皮组织中E-cadherin蛋白阳性表达,其介导同嗜性细胞黏附及细胞与细胞间的粘连,与β-catenin介导细胞与基质连接,共同调控肿瘤细胞的侵袭及转移[16]。E-cadherin 蛋白在肿瘤组织中低表达或不表达,E-cadherin缺失或低表达可导致同型细胞或肿瘤细胞间的结构及功能异常,使介导细胞的黏附功能降低或丧失而造成细胞无限制增生,导致肿瘤浸润和扩散甚至转移[17-18]。因此,研究黄芪多糖对Wnt通路相关因子β-catenin和E-cadherin蛋白及基因调控的影响具有重要意义。
在本实验中,免疫组化染色发现,黄芪多糖组E-cadherin蛋白表达增强、β-catenin表达减弱,RT-PCR结果显示黄芪多糖组E-cadherin mRNA表达增强、β-catenin mRNA表达减弱,提示黄芪多糖是通过干预Wnt通路相关因子β-catenin和E-cadherin蛋白及基因调控达到抗癌作用的。在肿瘤分化增殖过程中,E-cadherin蛋白在正常子宫内膜组织中高表达,说明E-cadherin蛋白对维持子宫内膜上皮完整性具有重要意义,当E-cadherin蛋白表达阳性率降低时,细胞间的黏附功能降低,肿瘤细胞间会丧失接触性抑制,使其更容易分离、增生、增殖、脱落和扩散。黄芪多糖可能作用于这一环节,通过提高E-cadherin蛋白及其基因表达,提高细胞间的黏附功能,使细胞分化增殖趋于正常,达到抑癌的目的。另一方面,黄芪多糖还可能通过抑制β-catenin蛋白,通过抑制Wnt基因转导通路而发挥抗肿瘤作用。欧阳小明等[19]研究发现,黄芪多糖可通过作用于β-catenin和E-cadherin等抑制Wnt基因转导通路的异常激活而起到抗肿瘤作用。细胞结构和功能的完整性依赖E-cadherin和β-catenin形成E-cadherin/β-catenin 复合体来维持,在子宫内膜癌的发生及恶化过程中,E-cadherin表达降低会导致β-catenin从 E-cadherin/catenin 复合体中游离出来,Wnt 通路异常激活,β-catenin在胞浆中大量集聚并进入到细胞核,导致肿瘤细胞转移与恶化[20]。在本研究中,黄芪多糖组β-catenin蛋白及其基因表达减弱,这可能是黄芪多糖通过提高E-cadherin蛋白及其基因表达来提高细胞间的黏附功能,并通过抑制β-catenin在胞浆中集聚,避免Wnt通路被异常激活而达到抗癌作用。另外黄芪多糖组瘤体积和瘤质量均低于模型组,提示黄芪多糖具有抑制肿瘤生长的作用。
总之,黄芪多糖可促进E-cadherin蛋白和基因表达,抑制β-catenin蛋白和基因表达,通过调控Wnt基因转导通路而发挥抗肿瘤作用。但黄芪抗肿瘤作用机制复杂,关于其防治子宫内膜癌的其他作用机制还需进一步研究,以提高其临床应用范围。
[参考文献]
[1]刘清源,孙风华,刘爽,等. 子宫内膜癌腹腔镜切除术对患者膀胱功能及排尿功能的影响分析[J]. 癌症进展,2017,15(2):205-207
[2]曹楚楚,黄炉仁,傅芬,等. PI3K/Akt/mTOR信号通路及其相关基因突变与子宫内膜癌靶向性药物治疗的研究进展[J]. 基础医学与临床,2017,37(1):118-122
[3]侯安丽,李秀芬,张雅丽,等. SFRP4和β-catenin在宫颈鳞癌中的表达及其临床意义[J]. 临床和实验医学杂志,2013,12(16):1267-1268;1271
[4]卞奕丁,万小平. Wnt信号通路与子宫内膜癌研究进展[J]. 现代妇产科进展2015,24(11):867-868
[5]常培江,张国英,栾福玉,等. 黄芪注射液辅助治疗在早期高危子宫内膜癌化疗增效减毒的研究[J]. 中国中医急症,2016,25(9):1822-1825
[6]叶园英,黄煜,颜莉莉,等. 人子宫内膜癌裸鼠皮下移植瘤模型的建立[J]. 山东医药,2016,56(35):28-30
[7]任世文,李洪安,李霞,等. β-catenin和E-cadherin在子宫内膜癌中的表达和意义[J]. 石河子大学学报:自然科学版,2011,29(4):471-474
[8]张振华,李怡帆, 卢雯平,等. 中医治疗晚期妇科恶性肿瘤验案三则[J]. 国际中医中药杂志,2017,39(2):167-169
[9]秦丽,窦永起,李敏,等. 益气活血中药黄芪-丹参对脂多糖致急性肺损伤大鼠防治作用的机制研究[J]. 环球中医药,2017,10(1):2-6
[10] 罗泽飞,苏旭春,孔嘉欣,等. 黄芪多糖对环磷酰胺导致大鼠气虚血瘀证的影响[J]. 现代肿瘤医学,2016,24(1):30-32
[11] 徐静雯,王楠. 黄芪多糖对胃癌前病变模型大鼠胃黏膜P53、P65、VEGF蛋白表达及AI的影响[J]. 中国药房,2016,27(22):3069-3071
[12] 何文涓,袁志坚,何晓升,等. 黄芪多糖的药理作用研究进展[J]. 中国生化药物杂志,2012,33(5):692
[13] 秦娟,李海英, 寇莉,等. 组织β-CateninmRNA和IGF-1mRNA检测在子宫内膜癌和子宫内膜息肉疾病鉴别诊断中的应用[J]. 临床和实验医学杂志,2017,16(5):468-471
[14] Dawson K,Aflaki M,Nattel S. Role of the Wnt-Frizzled system in cardiac pathophysiology:a rapidly developing,poorly understood area with enormous potential[J]. J Physiol,2013,591(6):1409-1432
[15] Bilic J,Huang YL,Davidson G,et al. Wnt induces LRP6 signalosomes and prom-otes disheveled-dependent LRP6 phosphorylation[J]. Science,2007,316(5831):1619-1622
[16] Bansal N,Yendluri V,Wenham RM. The molecular biology of endometrial cancers and the implications for pathogenesis,classification,and targeted therapies[J]. Cancer Control,2009,16(1):8-13
[17] 董莉,王文革,王莉,等. 错配修复基因hMLH1、hMSH2及p53在子宫内膜癌中的表达及意义[J]. 实用药物与临床,2007,10(2):71-73
[18] 袁玲玲,龚晓虹,刘平,等. E-钙黏蛋白和β-连环蛋白在Ⅰ型子宫内膜癌中的表达及其意义[J]. 肿瘤研究与临床,2015,22(3):175-178
[19] 欧阳小明,郅程,周芸,等. 黄芪注射液对人子宫内膜癌细胞β-catenin和E-cadherin表达的影响[J].分子影像学杂志,2016,39(3):292-296
[20] Samarnthai N,Hall K,Yeh IT,et al. Molecular profiling of endometrial malignancies[J]. Obstet Gynecol Int,2010(1):162363
