右美托咪定混合低浓度罗哌卡因用于腹横肌平面阻滞的有效性及安全性*
2018-04-10易红陈小乐黄东升周大春
易红,陈小乐,黄东升,周大春
(1.安徽省芜湖市第一人民医院 麻醉科,安徽 芜湖 241000;2.浙江省武义县人民医院麻醉科,浙江 武义 321200;3.浙江省海盐县妇幼保健院 麻醉科,浙江 海盐 314300;4.浙江大学医学院附属邵逸夫医院 麻醉科,浙江 杭州 310016)
腹横肌平面(transversus abdominis plane,TAP)阻滞可以用于腹部手术的麻醉或术后镇痛。由于腹壁神经分散排列,必须一次性注入较大容量的局部麻醉(简称局麻)药物才能保证阻滞效果,这就增加了局麻药中毒风险。邵逸夫医院曾经有1例患者在实施TAP阻滞后主诉口唇麻木。GRIFFITHS等[1]报告剖腹产术毕采用罗哌卡因总量为2.5 mg/kg,用生理盐水稀释成40 ml,进行双侧TAP阻滞,有3例患者发生轻微中毒症状,并检测到3例患者罗哌卡因血药浓度峰值为(2.70±0.46)μg/ml,超过罗哌卡因的中毒临界水平2.2μg/ml。目前如何兼顾TAP效果与安全性的研究还非常缺乏。
右美托咪定[2]是一种新型的高选择性α2-肾上腺素能受体激动剂,目前已有研究证实右美托咪定作为佐剂混合局麻药用于臂丛神经阻滞[3-4]、椎管内麻醉[5]、椎旁阻滞[6],可以增强阻滞效果,延长阻滞时间。联合右美托咪定降低局麻药浓度用于TAP阻滞,对腹腔镜结直肠癌根治术后镇痛的效果与安全性鲜有研究。
1 资料与方法
1.1 一般资料
选择2014年10月-2015年3月拟择期在全身麻醉下行腹腔镜结直肠癌根治术患者60例。ASAⅠ~Ⅲ级,年龄18~80岁,性别不限,体重45~90 kg。排除对研究药物过敏、注射部位感染、凝血功能障碍、窦性心动过缓、房室传导阻滞、长期使用阿片类药物、严重肝肾功能不全、语言沟通或意识障碍不能配合、拒绝使用镇痛泵者。本研究已获浙江大学附属邵逸夫医院伦理委员会批准,并与患者及家属签署知情同意书。所有患者均采用4孔法建立气腹,距离肿瘤5 cm处切断肠管,结肠癌在病变侧或直肠癌在腹正中有4 cm的纵形切口,将肠管拉至腹壁外进行吻合。
1.2 分组方法
采用随机数字表法,将患者分成3组:0.19%罗哌卡因组(19R组)、0.19%罗哌卡因+右美托咪定组(19RD组)与0.25%罗哌卡因组(25R组),每组20例。3组患者入室后常规监测无创血压、心电图、脉搏血氧饱和度和BIS值。以舒芬太尼0.4μg/kg、丙泊酚1.5~2.0 mg/kg、顺苯磺酸阿曲库铵0.15 mg/kg静脉诱导,丙泊酚、瑞芬太尼持续静脉泵注,七氟烷持续吸入维持,间断注射顺苯磺酸阿曲库铵、舒芬太尼,维持脑电双频谱指数(BIS)值于40~60之间。手术结束前30 min静脉注射氟比洛芬酯50 mg。手术结束时停泵注静脉药和吸入药,接PCIA送至麻醉恢复室(post-anesthctic ICU,PACU)。PCIA配方:舒芬太尼200μg溶入200 ml生理盐水中注入电子镇痛泵。参数设置为无背景剂量,单次剂量2ml,锁定时间为5 min,1 h限量12 ml。在PACU监护完善后,即行超声引导下双侧腹横肌平面阻滞。常规苏醒后拔除气管导管。术后48 h内,未使用镇静药物,常规1次/d氟比洛芬酯50 mg静脉注射进行镇痛。
1.3 腹横肌平面阻滞方法
采用超声引导侧入路法(又称腋中线法),患者取仰卧位,穿刺点及周围皮肤消毒铺巾后,使用超声仪(迈瑞M7,深圳)进行定位,选择超声高频探头8~13 MHz,先将探头涂抹耦合剂,然后用无菌手术套包裹,将探头垂直腋前线轴向置于腹壁髂嵴与肋缘之间,扫描该区域腋中线至腋前线水平,由浅层入深层依次为皮下脂肪、腹外斜肌、腹内斜肌、腹横肌、腹膜及腹膜内组织,腹内斜肌与腹横肌之间的筋膜为腹横肌平面,与其他筋膜一样呈高回声。使用一次性18 G静脉穿刺针(规格1.3 mm×48 mm,美国BD公司),在超声探头纵轴中位线进针(平面内技术),超声引导下当针尖刺破腹外斜肌和腹内斜肌到达腹横肌平面后,回抽无血无气,19R组注入0.19%罗哌卡因+生理盐水30 ml,19RD组注入0.19%罗哌卡因+50μg右美托咪定30 ml;25R组注入0.25%罗哌卡因+生理盐水30 ml。超声图像可显示药液扩散及渗透,形成梭形液性暗区,腹横肌被推开(见图1)。对侧同法进行腹横肌平面阻滞。所有的阻滞操作及超声影像分析均由1名高年资医师进行。
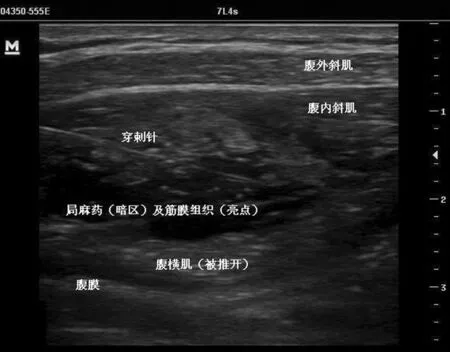
图1 腹横肌平面阻滞注药后腹壁超声图
1.4 观察项目
术后由1名不知道患者用药情况的麻醉医师随访,并记录术后 2(T1患者已拔管)、4(T2)、8(T3)、12(T4)及 24 h(T5)共 5 个时间点的 Ramsay 镇静评分、VAS评分(包括静息痛、咳嗽痛)。Ramsay镇静评分标准:1分为患者焦虑、躁动不安;2分为患者清醒、安静合作;3分为患者嗜睡、对指令有反应;4分为嗜睡、对轻叩眉间或大声听觉刺激反应敏捷;5分为嗜睡、对轻叩眉间或大声听觉刺激反应迟钝;6分为嗜睡、对轻叩眉间或大声听觉刺激无任何反应。VAS评分标准:0分为无痛,10分为无法忍受的剧痛。
记录术后3组患者首次请求PCIA距离手术结束时间(T),如果患者至48h时仍未按压镇痛泵,以48 h计算;24 h内镇痛泵舒芬太尼消耗总量(V),患者PCIA给药次数(D1)、PCIA请求次数(D2);记录术后24 h时患者对镇痛满意度,用百分制(0分为完全不满意,100分为完全满意)进行评价。观察并记录24 h有无呼吸抑制(呼吸频率<8次/min或SpO2<90%)、心动过缓(心率 <50 次 /min)、恶心、呕吐、皮肤瘙痒、尿潴留、穿刺部位血肿、感染或内脏损伤等不良反应的发生例数及有局麻药中毒症状的发生例数。
1.5 统计学方法
采用SAS9.4统计学软件进行数据分析,计量资料采用均数±标准差(±s)表示,计数资料采用率(%)表示,镇静和镇痛的效果分析采用线性混合效应模型处理重复测量数据,镇痛泵舒芬太尼需求与消耗之间比较采用单因素方差分析,多组间两两比较采用SNK-q检验,两组或多组率(%)的比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般情况比较
3组患者一般情况和手术术式、时间、失血量的比较,差异无统计学意义(P>0.05),见表1。
2.2 镇静镇痛效果
2.2.1镇静效果镇静Ramsay评分:①不同组别之间比较无差别(F=0.590,P=0.558),②不同时间点之间比较无差别(F=0.430,P=0.512),③不同组别之间,时间变化趋势比较无差别(F=0.680,P=0.509)。见表2、图2。
2.2.2静息镇痛效果镇痛效果评价分为静息时的VAS评分和咳嗽时的VAS评分。静息VAS评分:①不同组别之间比较有差别(F=21.690,P=0.000),进一步两两比较:19R组与19RD组比较,差异有统计学意义(t=5.090,P=0.000),25R组与19RD组比较,差异无统计学意义(t=-1.070,P=0.290);②不同时间点之间比较无差别(F=2.100,P=0.150);③不同组别之间,时间变化趋势比较无差别(F=2.290,P=0.103)(见表3、图3)。咳嗽VAS评分:①不同组别之间比较有差别(F=6.700,P=0.003),进一步两两比较,19R组与19RD组比较,差异有统计学意义(t=3.290,P=0.000),25R组与19RD组比较,差异无统计学意义(t=0.380,P=0.705);②不同时间点之间比较有差别(F=303.570,P=0.000);③19R组与19RD组比较,19R组随时间的延长变化幅度较19RD组小(t=-5.870,P=0.000),25R组与19RD比较,25R组随时间的延长的变化幅度与19RD组比较,差异无统计学意义(t=-1.940,P=0.054)。见表 4、图 4。
2.2.3患者自控镇痛泵舒芬太尼需求与消耗19R组患者第1次请求 PCIA距离手术结束时间(T)与25R组比较,差异有统计学意义(P<0.05),19R组较25R组短;19R组患者24 h舒芬太尼总消耗量(V)、PCA给药次数(D1)与PCA请求次数(D2)与25R组比较,差异有统计学意义(P<0.05),19R组均高于25R组;而19RD组与25R组比较,差异无统计学意义。见表5。
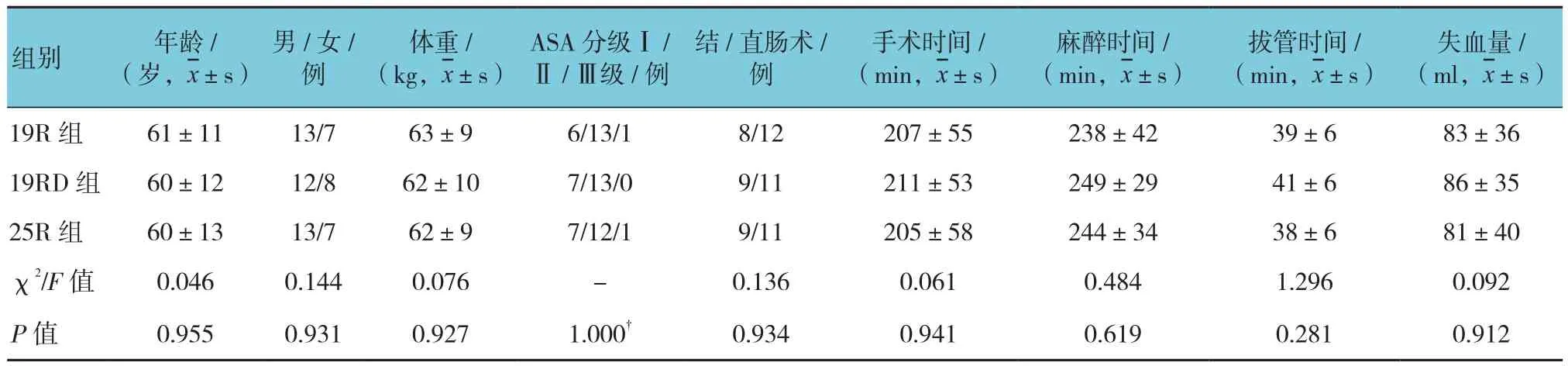
表1 患者一般情况和手术情况 (n =20)
表2 术后24 h内Ramsay镇静评分 (n =20,±s)

表2 术后24 h内Ramsay镇静评分 (n =20,±s)
组别 T1 T2 T3 T4 T5 19R 组 2.0±0.5 2.2±0.6 2.2±0.4 2.1±0.4 2.0±0.5 19RD 组 2.1±0.6 2.2±0.4 2.1±0.3 2.2±0.4 2.2±0.4 25R 组 2.3±0.5 2.2±0.5 2.0±0.3 2.3±0.5 2.1±0.3
表3 术后24 h内静息VAS评分 (n =20,±s)
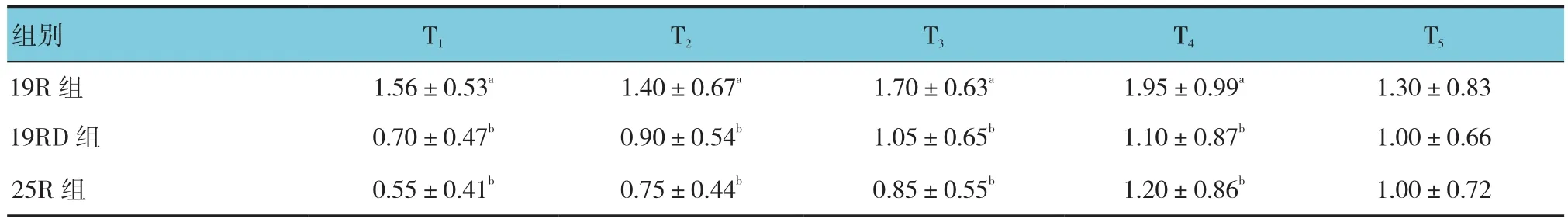
表3 术后24 h内静息VAS评分 (n =20,±s)
组别 T1 T2 T3 T4 T5 19R 组 1.56±0.53a 1.40±0.67a 1.70±0.63a 1.95±0.99a 1.30±0.83 19RD 组 0.70±0.47b 0.90±0.54b 1.05±0.65b 1.10±0.87b 1.00±0.66 25R 组 0.55±0.41b 0.75±0.44b 0.85±0.55b 1.20±0.86b 1.00±0.72
表4 术后24 h内咳嗽VAS评分 (n =20,±s)
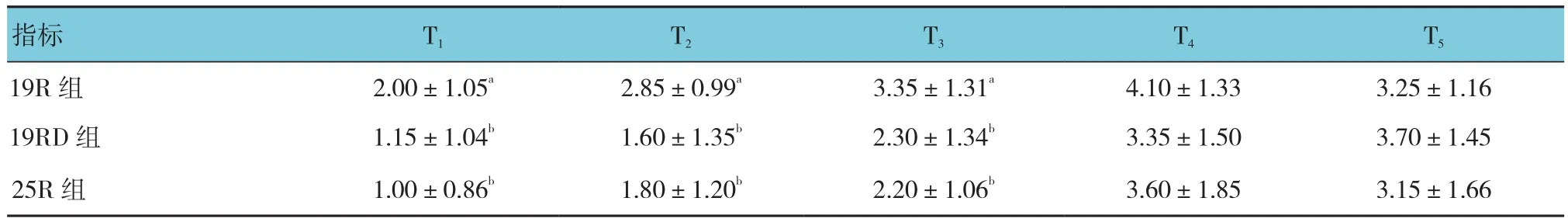
表4 术后24 h内咳嗽VAS评分 (n =20,±s)
指标 T1 T2 T3 T4 T5 19R 组 2.00±1.05a 2.85±0.99a 3.35±1.31a 4.10±1.33 3.25±1.16 19RD 组 1.15±1.04b 1.60±1.35b 2.30±1.34b 3.35±1.50 3.70±1.45 25R 组 1.00±0.86b 1.80±1.20b 2.20±1.06b 3.60±1.85 3.15±1.66
表5 患者自控镇痛泵舒芬太尼需求与消耗 (n =20,±s)
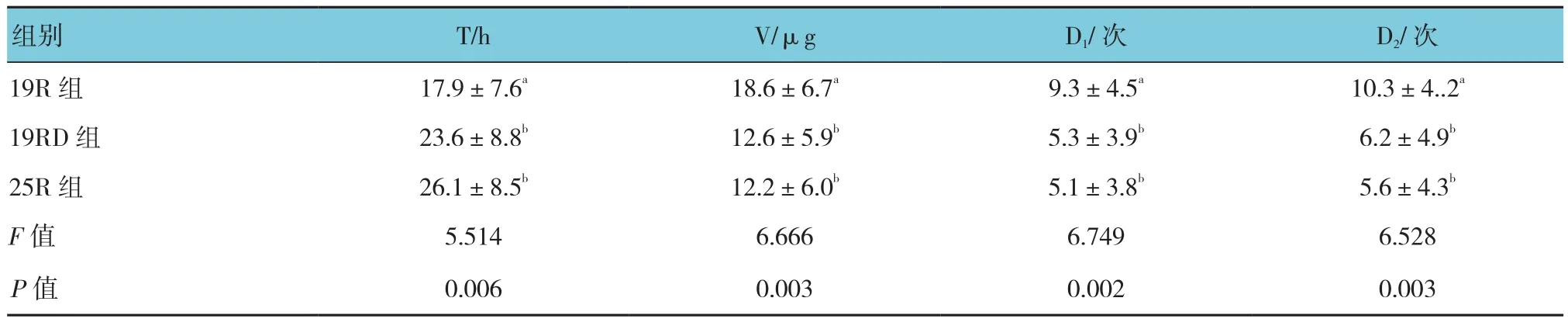
表5 患者自控镇痛泵舒芬太尼需求与消耗 (n =20,±s)
注:多组间两两比较,符号不同表示P <0.05。T:首次PCIA请求时间;V:24 h舒芬太尼总消耗量;D1:PCIA给药次数;D2:PCIA请求次数
组别 T/h V/μg D1/次 D2/次19R 组 17.9±7.6a 18.6±6.7a 9.3±4.5a 10.3±4..2a 19RD 组 23.6±8.8b 12.6±5.9b 5.3±3.9b 6.2±4.9b 25R 组 26.1±8.5b 12.2±6.0b 5.1±3.8b 5.6±4.3b F值 5.514 6.666 6.749 6.528 P值 0.006 0.003 0.002 0.003
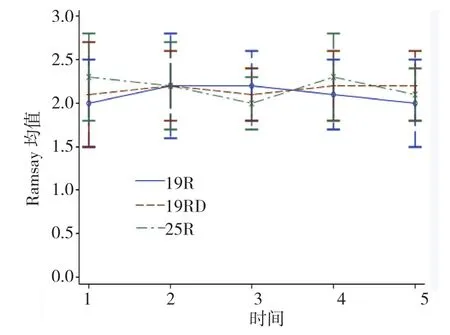
图2 不同组别24 h内Ramsay镇静评分
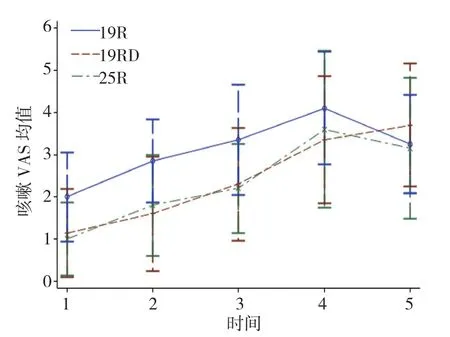
图4 不同组别24 h内咳嗽VAS评分
2.3 不良反应
19R组发生恶心3例、呕吐1例、尿潴留1例;19RD组发生恶心3例;25R组发生恶心2例、呕吐1例;3组均无穿刺部位血肿、感染及皮肤瘙痒、呼吸抑制、局麻药中毒症状等不良反应的发生,组间比较差异无统计学意义。19R组患者镇痛满意度评分(82±7)分低于25R 组(92±7)分,差异有统计学意义(P<0.05)。19RD组患者镇痛满意度评分(91±8)分与25R组(92±7)分比较,差异无统计学意义(P>0.05)。
3 讨论
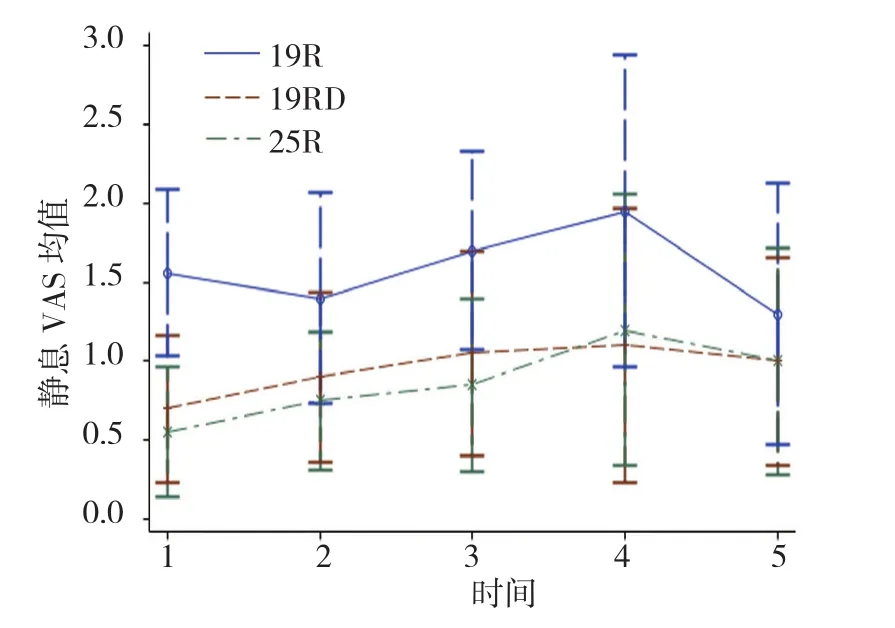
图3 不同组别24 h内静息VAS评分
李露[7]报道0.8μg/kg右美托咪定混合罗哌卡因用于臂丛神经阻滞,可以使罗哌卡因臂丛神经半数有效浓度从0.44%降低为0.32%,下降27.3%。肖萍等[6]报道20μg右美托咪定混合罗哌卡因用于椎旁神经阻滞,可以使罗哌卡因半数有效浓度从0.27%降低为0.22%,下降了18.5%。参考以上结果,本研究选取浓度为0.75%罗哌卡因按1∶4稀释成为0.19%罗哌卡因,比常用的0.25%浓度降低了24%,介于18.5%至27.3%之间并且在预实验中,笔者观察到0.19%浓度的罗哌卡因能产生镇痛效果。中国成年人体重以50~70 kg常见,以右美托咪定常用剂量0.8~1.0μg/kg计算,最终右美托咪定剂量定为50μg。该剂量是否是最佳剂量,需要大样本、多中心进一步研究。
在预实验时笔者试图观察TAP的阻滞范围及其消退过程,但多数患者不能够明确分辨出痛觉或温度觉的阻滞边界,因此仅用疼痛评分评价效果。术后疼痛应该包括切口痛和内脏痛,但患者一般无法区分。TAP阻滞只影响切口痛。咳嗽等运动时切口受到牵拉,神经阻滞的镇痛效果更容易体现在运动痛(咳嗽痛)改变上。既出于伦理原因考虑,又作为观察指标,所有患者均配备了没有设置背景剂量的PCIA泵,患者首次请求PCIA的时间以及PCIA的需求量成为评价神经阻滞维持时间以及效果的间接指标。考虑到单次神经阻滞维持时间不超过24 h,因此只分析了24 h内PCIA需求量。如果直至48 h患者仍无PCIA请求,首次PCIA请求时间以48 h计算。
本研究结果发现24 h内19RD组的咳嗽痛与25R组相似,低于19R组,PCIA的首次请求时间,总需求量也与25R组相似,低于19R组,提示50μg右美托咪定混合0.19%罗哌卡因的镇痛效果、维持时间相当于0.25%罗哌卡因,优于单用0.19%罗哌卡因。
本组没有发现局麻药中毒相关症状。GRIFFITHS等[1]研究发现罗哌卡因最大血药浓度时间为TAP后。本研究部分患者在行TAP阻滞后30 min尚未完全苏醒,可能会影响中毒症状的报告。但局麻药中毒是低概率事件,前瞻性研究不一定会发生。作为临床安全策略,能够减少局麻药用量应该有利于减少中毒风险。
右美托咪定被吸收入血后产生镇静镇痛的全身作用完全有可能,但本研究没有发现3组在镇静评分上的差别。MARHOFER等[8]报道罗哌卡因用于神经阻滞中观察感觉持续时间,联合右美托咪定神经阻滞组最长,使用右美托咪定静脉注射组次之,单纯罗哌卡因组作用时间最短。右美托咪定作为佐剂增强局麻药行外周神经阻滞的局部作用得到肯定,但具体机制尚不完全清楚。α2肾上腺素受体激动剂产生镇痛镇静作用可能是多因素的[9]。①在中枢,右美托咪定兴奋脊髓后角突触后α2肾上腺素受体,减少背角神经元中镇痛神经递质P物质的释放,同时激活大脑蓝斑核的α2受体而产生镇痛、镇静作用。②在外周,右美托咪定刺激外周α2肾上腺素受体,减少交感神经末梢释放去甲肾上腺素的释放,抑制神经纤维动作电位达到镇痛作用。③BRUMMETT等[10]通过小鼠坐骨神经实验提示右美托咪定延长镇痛持续时间与抑制超极化阳离子电流(Ⅰh电流)有关。Ⅰh电流可以使周围神经恢复到静息电位。由于Ⅰh电流受抑制,动作电位处于超极化状态,不能引起新的动作电位,神经纤维需要先恢复到静息电位才能引发新的动作电位。这种作用对支配痛觉的无髓鞘的C纤维较支配运动的Aa纤维更明显。因此右美托咪定对痛觉的作用比对运动的作用强。④右旋美托咪定还可直接作用外周血管的α2受体,收缩血管从而延缓局麻药的吸收,延长作用时间。⑤右旋美托咪定具有高脂溶性,给药后迅速吸收进入血液,并能通过血脑屏障进人中枢神经系统产生镇静效应,消除了疼痛引起的焦虑、紧张、恐惧等情绪反应,从而提高了对疼痛的耐受力。
右美托咪定对局麻药的增强作用在TAP阻滞与其他神经阻滞时类似,但其临床意义更为重要。在局麻药需要量较小的神经阻滞,可以选择提高局麻药浓度来强化或延长阻滞效果,而像TAP阻滞这类需要大容量局麻药液的阻滞,中毒风险高,因此限制了局麻药浓度,加用右美托咪定就更有临床意义。
一般的腹腔镜手术通过对穿刺孔进行局部浸润麻醉就可以达到良好的镇痛[11]。但腹腔镜结直肠癌根治术还需要在腹正中有4 cm的纵形辅助切口,将肠管拉至腹壁外进行吻合。这个较大的切口,用局部浸润镇痛比较困难。临床体会腹腔镜结直肠癌根治术运用TAP阻滞比较适合[12],腋中线TAP阻滞主要阻滞下腹部T7~11的神经支配[13],可以覆盖所有穿刺孔和辅助切口。有报道与硬膜外镇痛相比,TAP阻滞不引起尿潴留,拔除导尿管时间更早,不影响血流动力学平衡,保护下肢运动功能,可以用于使用抗凝药的患者,对护理干预要求较低,患者满意度TAP组更高[14]。
综上所述,右美托咪定50μg混合低浓度(0.19%)罗哌卡因能安全、有效地用于腹腔镜结直肠手术的术后镇痛,其阻滞效果、阻滞维持时间与0.25%罗哌卡因相当,是降低局麻药中毒风险的实用方法。
(致谢:承蒙皖南医学院金岳龙对本文的统计学处理做了指导,特此感谢!)
参 考 文 献:
[1]GRIFFITHS J D, LE N V, GRANT S, et al. Symptomatic local anaesthetic toxicity and plasma ropivacaine concentrations after transversus abdominis plane block for Caesarean section[J]. Br J Anaesth, 2013, 110(6): 996-1000.
[2]AFONSO J, RELS F. Dexmedetomidine: current role in anesthesia and intensive care[J]. Rev Bras Anestesiol, 2012, 62(1): 118-133.
[3]ESMAOGLU A, YEQENOGLU F, AKIN A, et al.Dexmedetomidine added to levobupivacaine prolongs axillary brachial plexus block[J]. Anesth Analg, 2010, 111(6): 1548-1551.
[4]AMMAR A S, MAHMOUD K M. Ultrasound-guided single injection infraclavicular brachial plexus block using bupivacaine alone or combined with dexmedetomidine for pain control in upper limb surgery: A prospective randomized controlled trial[J]. Saudi Journal of Anaesthesia, 2012, 6(2): 109-114.
[5]KANAZI G E, AOUAD M T, JABBOUR-KHOURY S I, et al. Effect of low-dose dexmedetomidine or clonidine on the characteristics of bupivacaine spinal block[J]. Acta Anaesthesiol Scand, 2006, 50(2): 222-227.
[6]肖萍, 李亚楠, 周大春. 右美托咪定局部用药对罗哌卡因椎旁神经阻滞半数有效浓度影响[J]. 中华麻醉学杂志, 2015, 35(5):587-589.
[7]李露, 王晓林, 周海滨, 等. 右美托咪定局部用药对罗哌卡因臂丛神经阻滞半数有效浓度的影响[J]. 中华麻醉学杂志, 2013,33(3): 328-330.
[8]MARHOFER D, KETTNER S C, MARHOFER P, et al.Dexmedetomidine as an adjuvant to ropivacaine prolongs peripheral nerve block: a volunteer study[J]. British Journal of Anaesthesia, 2013, 110(3): 438-442.
[9]ODA A, IIDA H, TANAHASHI S, et al. Effects of alpha2-adrenoceptor agonists on tetrodotoxin-resistant Na+channels in rat dorsal root ganglionneurons[J]. Eur J Anaesthesiol, 2007, Nov;24(11): 934-941.
[10]BRUMMETT C M, NORAT M A, PALMISANO J M, et al.Perineural administration of dexmedetomidine in combination with bupivacaine enhances sensory and motor blockade in sciatic nerve block without inducing neurotoxicity in rat[J].Anesthesiology, 2008, 109(3): 502-511.
[11]祝继洪, 何非方, 钟泰迪. 腹腔镜胆囊切除术的多模式镇痛[J].浙江医学, 2006, 28(10): 833-835.
[12]黄东升, 马晓东, 周大春. 超声引导腹横肌平面阻滞用于半结肠切除术后镇痛的效果[J]. 中华医学杂志, 2014, 94(21):1623-1626.
[13]MUROUCHI T, YAMAUCHI M, GI E, et al. Ultrasound-guided subcostal and mid-axillary transverus abdominis plane block: a cadaveric study of the spread of injectate[J]. Masui, 2013, 62(1):60-63.
[14]NIRAJ G, KELKAR A, HART E, et al. Comparison of analgesic efficacy of four-quadrant transversus abdominis plane (TAP)block and continuous posterior TAP analgesia with epidural analgesia in patients undergoing Laparoscopic colorectal surgery:an open-label, randomized non-inferiority trial[J]. Anaesthesia,2014, 69(4): 348-355.
